SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Fastum 2,5 % Gel
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
100 g gel bevat 2,5 g ketoprofen.
Hulpstof(fen) met bekend effect:
Ethanol, citral, citronellolen, coumarine, farnesol, geraniol, d-limoneen en linalool.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Gel
Gel met viskeuze consistentie, kleurloos of licht gelig, bijna transparant, met een aromatische geur.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Fastum Gel is als symptomatische of aanvullende lokale behandeling aangewezen om ontsteking en pijn bij verschillende aandoeningen te verzachten:
- in de reumatologie
tendinitis, bursitis, artrose van de kleine gewrichten, pijnlijke artropathieën, synovitis, periarthritis, scheefhals, lumbago, spierpijn.
- in de traumatologie
verstuikingen, luxaties, contusies, oedemen en post-traumatische pijn.
4.2 Dosering en wijze van toediening
Dosering
Een kleine hoeveelheid Fastum Gel 2 tot 4 maal per dag op de plaats van de ontsteking aanbrengen.
- Gel in tube: 5 cm.
- Gel in dispenser: bij tweemaal volledig indrukken van het doseerpompje komt
ongeveer 2 g gel vrij, hetgeen overeenkomt met 5 cm.
De gel door een zachte en aanhoudende massage goed doen indringen op de plaats van de ontsteking.
Pediatrische patiënten
De veiligheid en werkzaamheid van Fastum gel bij kinderen en adolescenten tot 15 jaar zijn nog niet vastgesteld.
Fastum Gel mag niet worden gebruikt bij kinderen en adolescenten jonger dan 15 jaar wegens veiligheids-/werkzaamheidsbezwaren.
Wijze van toediening
Voor cutaan gebruik
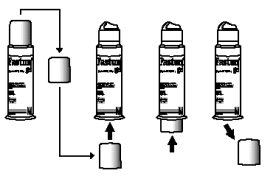
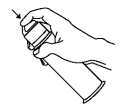
Bij het eerste gebruik van de dispenser wordt aangeraden om met de dop druk uit te oefenen op de onderkant van de dispenser.
Bij een volgend gebruik het doseerpompje volledig indrukken om de gel te verkrijgen.
Enkel bij het eerste gebruik Nadien
4.3 Contra-indicaties
- Voorgeschiedenis van overgevoeligheid voor de werkzame stof of voor één van de in rubriek 6.1 vermelde hulpstoffen.
- Aanbrengen op huidaandoeningen zoals eczeem of acne, bij een ontstoken huid of open wonden.
- Voorgeschiedenis van een fotosensibiliteitsreactie.
- Gekende overgevoeligheidsreacties, zoals symptomen van astma, allergische rinitis, voor ketoprofen, fenofibraat, tiaprofeenzuur, acetylsalicylzuur, of andere niet-steroïdale anti-inflammatoire geneesmiddelen.
- Voorgeschiedenis van huidallergie voor ketoprofen, tiaprofeenzuur, fenofibraat, UV-blokkers of parfums.
- Blootstelling aan de zon, zelfs indien bewolkt, UV-licht van een zonnebank inbegrepen, dient vermeden te worden tijdens de behandeling en 2 weken na het stoppen ervan (zie rubriek 4.4).
- Derde trimester van de zwangerschap (zie rubriek 4.6).
4.8 Bijwerkingen
Er zijn meldingen geweest van gelokaliseerde huidreacties die vervolgens verder dan de toedieningsplaats kunnen uitbreiden. Gevallen van ernstigere reacties zoals bulleus of flyctenulair eczeem dat kan uitbreiden of veralgemeend kan worden, zijn zelden voorgekomen.
Andere systemische effecten van anti-inflammatoire geneesmiddelen: deze hangen af van de diffusie van het werkzaam bestanddeel doorheen de huid en dus van de hoeveelheid gel die aangebracht werd, van de behandelde oppervlakte, van de graad van integriteit van de huid, van de duur van de behandeling en van het gebruik van occlusief verband (overgevoeligheid, gastro-intestinale en niereffecten).
Sinds het op de markt brengen, zijn de volgende bijwerkingen gemeld. Ze worden vermeld volgens systeem/orgaanklassen en als volgt gerangschikt volgens hun frequentie: Zeer vaak (≥1/10); vaak (≥1/100 tot <1/10); soms (≥1/1.000 tot <1/100); zelden (≥1/10.000 tot <1/1.000); zeer zelden (<1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Systeem/ | Soms | Zelden | Zeer zelden | Niet bekend |
Immuunsysteem-aandoeningen |
|
|
| Anafylactische reacties, waaronder anafylactische shock, |
Maagdarmstelsel-aandoeningen |
|
| Ulcus pepticum, |
|
Huid- en onderhuid-aandoeningen | Lokale huidreacties zoals erytheem, | Dermato-logische reacties (Fotosensiviteit, | Contact-dermatitis |
|
Nier- en urineweg-aandoeningen |
|
| Het ontwik-kelen van nieuwe of het verergeren van bestaande nierinsuf-ficiëntie |
|
Oudere patiënten zijn in het bijzonder gevoelig voor bijwerkingen van niet-steroïdale anti-inflammatoire geneesmiddelen.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg worden verzocht alle vermoedelijke bijwerkingen te melden in België via het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten, Afdeling Vigilantie, Postbus 97, B-1000 BRUSSEL, Madou -Website: www.eenbijwerkingmelden.be - e-mail: adr@fagg.be en in Luxemburg via het Centre Régional de Pharmacovigilance de Nancy of de Division de la pharmacie et des médicaments de la Direction de la santé. Website: www.guichet.lu/pharmacovigilance.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Menarini Benelux N.V./S.A.
De Kleetlaan 3
B-1831 Machelen
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
België
Tube: BE155145
Dispenser: BE219046
Luxemburg
Nummer van de vergunning voor het in de handel brengen: 2011041086
Nationale nummers:
- Fastum Gel Tube 30 g: 0306143
- Fastum Gel Tube 60 g: 0195707
- Fastum Gel Dispenser 70 g: 0239721
- Fastum Gel Dispenser 120 g: 0239734
10. DATUM VAN HERZIENING VAN DE TEKST
Datum van herziening van de tekst: 12/2023
Goedkeuringsdatum: 08/2024
1
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1075027 | FASTUM GEL 2,5% 60 GR | M02AA10 | € 10,25 | - | Ja | - | - |
| 1597210 | FASTUM GEL DISPENSER 120 G | M02AA10 | € 17,31 | - | Ja | - | - |