SAMENVATTING VAN DE PRODUCTKENMERKEN
![]() Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
1. NAAM VAN HET GENEESMIDDEL
JEMPERLI 500 mg concentraat voor oplossing voor infusie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Een injectieflacon met 10 ml concentraat voor oplossing voor infusie bevat 500 mg dostarlimab.
Iedere ml concentraat voor oplossing voor infusie bevat 50 mg dostarlimab.
Dostarlimab is een gehumaniseerd, monoklonaal anti‑programmed cell death protein‑1 (PD‑1)-antilichaam (mAb) van het type immunoglobuline G4 (IgG4), geproduceerd door recombinant-DNA‑technologie in zoogdiercellen (ovariumcellen van de Chinese hamster, CHO).
Hulpstof met bekend effect
2 mg polysorbaat 80 in elke doseringseenheid.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Concentraat voor oplossing voor infusie (steriel concentraat).
Heldere tot licht opaalachtige, kleurloze tot gele oplossing, in wezen vrij van zichtbare deeltjes.
Het concentraat voor oplossing voor infusie heeft een pH van ongeveer 6,0 en een osmolaliteit van ongeveer 300 mOsm/kg.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
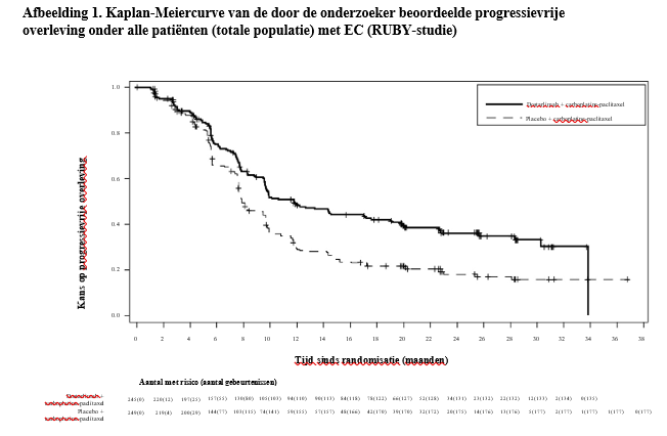
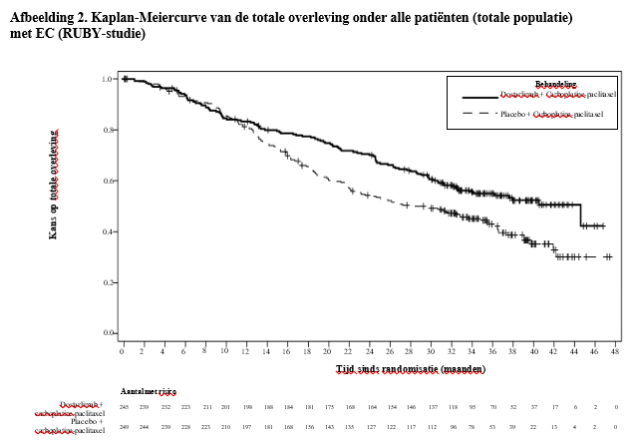
JEMPERLI is geïndiceerd in combinatie met carboplatine en paclitaxel voor de eerstelijnsbehandeling van volwassen patiënten met primair gevorderd of gerecidiveerd endometriumcarcinoom (EC) die in aanmerking komen voor systemische behandeling.
JEMPERLI is geïndiceerd als monotherapie voor de behandeling van volwassen patiënten met mismatch‑reparatiedeficiënt (dMMR)/microsatellietinstabiliteit-hoog (MSI‑H), gerecidiveerd of gevorderd EC met ziekteprogressie tijdens of na een eerdere platinabevattende behandeling.
4.2 Dosering en wijze van toediening
De behandeling moet worden ingesteld en gecontroleerd door specialisten met ervaring in de behandeling van kanker.
De identificatie van de dMMR/MSI‑H‑tumorstatus moet plaatsvinden aan de hand van een gevalideerde testmethode zoals IHC, PCR of NGS* (zie rubriek 5.1 voor informatie over testen die tijdens de onderzoeken zijn gebruikt).
*IHC = immunohistochemie; PCR = polymerasekettingreactie; NGS = next‑generation sequencing
Dosering
JEMPERLI in combinatie met carboplatine en paclitaxel
Raadpleeg in geval van toediening van JEMPERLI in combinatie met carboplatine en paclitaxel de volledige productinformatie van de middelen waarmee JEMPERLI wordt gecombineerd (zie ook rubriek 5.1).
De aanbevolen dosis is 500 mg dostarlimab elke 3 weken in combinatie met carboplatine en paclitaxel elke 3 weken voor 6 cycli, gevolgd door 1000 mg dostarlimab als monotherapie elke 6 weken voor alle cycli daarna.
Het doseringsschema voor gebruik in combinatie met carboplatine en paclitaxel staat in tabel 1.
![]()
Tabel 1. Doseringsschema voor gebruik van JEMPERLI in combinatie met carboplatine en paclitaxel
| 500 mg eenmaal per 3 weken |
| 1000 mg eenmaal per 6 weken als monotherapie tot ziekteprogressie of onaanvaardbare toxiciteit, of gedurende maximaal 3 jaar (1 cyclus = 6 weken) | ||||||||
Cyclus | Cyclus 1 | Cyclus 2 | Cyclus 3 | Cyclus 4 | Cyclus 5 | Cyclus 6 | Cyclus 7 | Cyclus 8 | Cyclus 9 |
| |
Week | 1 | 4 | 7 | 10 | 13 | 16 | 19 | 25 | 31 | ||
3 weken tussen cyclus 6 en cyclus 7
a Dien dostarlimab toe voorafgaand aan carboplatine en paclitaxel, op dezelfde dag.
De toediening van dostarlimab moet voortgezet worden volgens het aanbevolen schema tot ziekteprogressie of onaanvaardbare toxiciteit, of gedurende maximaal 3 jaar (zie rubriek 5.1).
JEMPERLI als monotherapie
De aanbevolen dosis als monotherapie is 500 mg dostarlimab elke 3 weken voor 4 cycli, gevolgd door 1000 mg elke 6 weken voor alle cycli daarna.
Het doseringsschema voor gebruik als monotherapie staat in tabel 2.
Tabel 2. Doseringsschema voor gebruik van JEMPERLI als monotherapie
| 500 mg eenmaal per 3 weken |
| 1000 mg eenmaal per 6 weken tot ziekteprogressie of onaanvaardbare toxiciteit (1 cyclus = 6 weken) | ||||||
Cyclus | Cyclus 1 | Cyclus 2 | Cyclus 3 | Cyclus 4 | Cyclus 5 | Cyclus 6 | Cyclus 7 |
| |
Week | 1 | 4 | 7 |
| 13 | 19 | 25 | ||
3 weken tussen cyclus 4 en cyclus 5
De toediening van dostarlimab moet voortgezet worden volgens het aanbevolen schema tot ziekteprogressie of onaanvaardbare toxiciteit (zie rubriek 5.1).
Dosisaanpassingen
Een dosisverlaging wordt niet aanbevolen. Uitstel of stopzetting van de toediening kan nodig zijn op basis van individuele veiligheid en verdraagbaarheid. Aanbevolen dosisaanpassingen voor de behandeling van bijwerkingen staan in tabel 3.
Gedetailleerde richtlijnen voor de behandeling van immuungerelateerde bijwerkingen en infusiegerelateerde reacties staan in rubriek 4.4.
Tabel 3. Aanbevolen dosisaanpassingen voor JEMPERLI | ||
Immuungerelateerde bijwerkingen | Ernstgraada | Dosisaanpassing |
Colitis | 2 of 3 | Onderbreek toediening. Hervat toediening wanneer de toxiciteit afneemt naar graad 0 of 1. |
4 | Staak definitief. | |
Hepatitis | Graad 2 met ASATb of ALATc > 3 en | Onderbreek toediening. Hervat toediening wanneer de toxiciteit afneemt naar graad 0 of 1. |
Graad ≥ 3 met ASAT of ALAT > 5 × ULN | Staak definitief (zie uitzondering hieronder)e. | |
Diabetes mellitus type 1 | 3 of 4 (hyperglykemie) |
|
Hypofysitis of bijnierinsufficiëntie | 2, 3 of 4 | Onderbreek toediening. Hervat toediening wanneer de toxiciteit afneemt naar graad 0 of 1. Staak definitief bij recidief of verslechtering terwijl een adequate hormoontherapie wordt gebruikt. |
Hypothyreoïdie of hyperthyreoïdie | | Onderbreek toediening. Hervat toediening wanneer de toxiciteit afneemt naar graad 0 of 1. |
Pneumonitis | 2 | Onderbreek toediening. Hervat toediening wanneer de toxiciteit afneemt naar graad 0 of 1. Staak definitief bij terugkeer naar graad 2. |
3 of 4 | Staak definitief. | |
Nefritis | 2 | Onderbreek toediening. Hervat toediening wanneer de toxiciteit afneemt naar graad 0 of 1. |
3 of 4 | Staak definitief. | |
Exfoliatieve dermatologische aandoeningen (bijv. SJSf, TENg, DRESSh) | Vermoed | Onderbreek toediening voor alle graden. Hervat toediening indien niet bevestigd en wanneer de toxiciteit afneemt naar graad 0 of 1. |
Bevestigd | Staak definitief. | |
Myocarditis | 2, 3 of 4 | Staak definitief. |
Ernstige neurologische toxiciteiten (myasthenisch syndroom/myasthenia gravis, syndroom van Guillain-Barré, encefalitis, myelitis transversa) | 2, 3 of 4 | Staak definitief. |
Andere immuungerelateerde bijwerkingen (waaronder maar niet beperkt tot myositis, sarcoïdose, auto‑immuunhemolytische anemie, pancreatitis, iridocyclitis, uveïtis, diabetische ketoacidose, artralgie, transplantaatafstoting van een solide orgaan, graft‑versus‑hostziekte) | 3 | Onderbreek toediening. Hervat toediening wanneer de toxiciteit afneemt naar graad 0 of 1. |
4 | Staak definitief. | |
| 3 of 4 | Staak definitief. |
Andere bijwerkingen | Ernstgraada | Dosisaanpassing |
Infusiegerelateerde reacties | 2 | Onderbreek toediening. Wanneer de reacties binnen 1 uur na onderbreking verdwijnen, kan de toediening hervat worden op 50% van de oorspronkelijke infusiesnelheid, of de toediening kan hervat worden wanneer de symptomen verdwijnen met premedicatie. Staak definitief bij terugkeer van graad 2 met geschikte premedicatie. |
3 of 4 | Staak definitief. | |
a Toxiciteit ingedeeld in graad volgens de National Cancer Institute Common Terminology Criteria for Adverse Events (CTCAE) versie 5.0.
b ASAT = aspartaataminotransferase
c ALAT = alanineaminotransferase
d ULN = bovengrens van de normaalwaarde
e Voor patiënten met levermetastasen die de behandeling beginnen met een toename in ASAT of ALAT van graad 2, moet de behandeling gestaakt worden als de ASAT of ALAT toeneemt met ≥ 50% ten opzichte van baseline en ten minste 1 week aanhoudt
f SJS = Stevens-Johnson-syndroom
g TEN = toxische epidermale necrolyse
h DRESS = geneesmiddelenreactie met eosinofilie en systemische symptomen.
Patiëntenkaart
Alle voorschrijvers van JEMPERLI moeten patiënten informeren over de patiëntenkaart waarop wordt uitgelegd wat ze moeten doen als ze last krijgen van een symptoom van een immuungerelateerde bijwerking. De arts geeft de patiëntenkaart aan iedere patiënt.
Bijzondere populaties
Ouderen
Er wordt geen dosisaanpassing aanbevolen voor patiënten die 65 jaar of ouder zijn.
Er zijn beperkte klinische gegevens beschikbaar over dostarlimab bij patiënten van 75 jaar of ouder (zie rubriek 5.1).
Verminderde nierfunctie
Er wordt geen dosisaanpassing aanbevolen bij patiënten met een licht tot matig verminderde nierfunctie. Er zijn beperkte gegevens beschikbaar over patiënten met een ernstig verminderde nierfunctie of met eindstadium nierfalen die gedialyseerd worden (zie rubriek 5.2).
Verminderde leverfunctie
Er wordt geen dosisaanpassing aanbevolen bij patiënten met een licht verminderde leverfunctie. Er zijn beperkte gegevens beschikbaar over patiënten met een matig verminderde leverfunctie en geen gegevens over patiënten met een ernstig verminderde leverfunctie (zie rubriek 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van JEMPERLI bij kinderen en adolescenten jonger dan 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
JEMPERLI is uitsluitend bedoeld voor intraveneuze infusie. JEMPERLI moet met behulp van een intraveneuze infuuspomp worden toegediend via intraveneuze infusie gedurende 30 minuten.
JEMPERLI mag niet worden toegediend als een intraveneuze push‑ of bolusinjectie.
Voor instructies over verdunning van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Dostarlimab gaat vooral gepaard met immuungerelateerde bijwerkingen. De meeste hiervan, waaronder ernstige bijwerkingen, verdwenen na het starten van passende medische behandeling of stopzetting van dostarlimab (zie ‘Beschrijving van geselecteerde bijwerkingen’ hieronder).
Dostarlimab als monotherapie
De veiligheid van dostarlimab is beoordeeld bij 605 patiënten met EC of andere gevorderde solide tumoren. Deze patiënten kregen dostarlimab als monotherapie in de GARNET‑studie. Onder hen waren 153 patiënten met gevorderd of gerecidiveerd dMMR/MSI‑H EC. Patiënten kregen gedurende 4 cycli elke 3 weken doses van 500 mg gevolgd door doses van 1000 mg elke 6 weken tijdens alle cycli daarna.
Bij patiënten met gevorderde of gerecidiveerde solide tumoren (n = 605) waren de vaakst voorkomende bijwerkingen (> 10%) anemie (28,6%), diarree (26,0%), nausea (25,8%), braken (19,0%), artralgie (17,0%), pruritus (14,2%), rash (13,2%), pyrexie (12,4%), aspartaataminotransferasen verhoogd (11,2%) en hypothyreoïdie (11,2%). JEMPERLI werd permanent gestaakt vanwege bijwerkingen bij 38 patiënten (6,3%); het ging hierbij vooral om immuungerelateerde bijwerkingen. Bijwerkingen waren ernstig bij 11,2% van de patiënten; de meeste ernstige bijwerkingen waren immuungerelateerde bijwerkingen (zie rubriek 4.4).
Het veiligheidsprofiel voor patiënten met dMMR/MSI‑H EC in de GARNET‑studie (n = 153) verschilde niet van dat van de gehele monotherapiepopulatie uit tabel 4.
Dostarlimab in combinatie met carboplatine en paclitaxel
De veiligheid van dostarlimab is beoordeeld bij 241 patiënten met primair gevorderd of gerecidiveerd EC die dostarlimab in combinatie met carboplatine en paclitaxel kregen in de RUBY-studie. De patiënten kregen gedurende 6 cycli elke 3 weken doses van 500 mg dostarlimab, gevolgd door doses van 1000 mg dostarlimab elke 6 weken tijdens alle cycli daarna.
Bij patiënten met primair gevorderd of gerecidiveerd EC (n = 241) waren de vaakst voorkomende bijwerkingen (≥ 10%) rash (23,2%), rash maculo-papulair (14,5%), hypothyroïdie (14,5%), pyrexie (12,9%), alanine-aminotransferase verhoogd (12,9%), aspartaataminotransferase verhoogd (12,0%) en droge huid (10,0%). JEMPERLI werd permanent gestaakt vanwege bijwerkingen bij 12 patiënten (5,0%); het ging hierbij vooral om immuungerelateerde bijwerkingen. Bijwerkingen waren ernstig bij 5,8% van de patiënten. De vaakst voorkomende (> 1%) ernstige bijwerking was pyrexie (2,9%). De vaakst voorkomende (> 10%) immuungerelateerde bijwerking was hypothyroïdie (12,0%), en maculopapulaire rash (1,2%) was de vaakst voorkomende (> 1%) immuungerelateerde bijwerking die tot stopzetting van de behandeling leidde (zie rubriek 4.4).
Samenvattende tabel van bijwerkingen
Bijwerkingen die gemeld werden in klinische onderzoeken naar dostarlimab als monotherapie of dostarlimab in combinatie met chemotherapie, zijn opgenomen in tabel 4. Deze bijwerkingen zijn vermeld per systeem/orgaanklasse en frequentie. De frequenties van bijwerkingen in de ‘dostarlimab als monotherapie’-kolom zijn gebaseerd op de frequentie van bijwerkingen van alle oorzaken die zijn vastgesteld bij 605 patiënten met gevorderde of gerecidiveerde solide tumoren uit de GARNET‑studie die zijn blootgesteld aan monotherapie met dostarlimab gedurende een mediane behandelduur van 24 weken (spreiding: 1 week tot 229 weken). Tenzij anders aangegeven zijn de frequenties van bijwerkingen in de ‘Dostarlimab in combinatie met chemotherapie’-kolom gebaseerd op de frequentie van bijwerkingen van alle oorzaken die zijn vastgesteld onder de 241 patiënten met primair gevorderd of gerecidiveerd EC uit de RUBY-studie die zijn blootgesteld aan dostarlimab in combinatie met carboplatine en paclitaxel gedurende een mediane behandelduur van 43 weken (spreiding: 3 tot 193 weken). Raadpleeg bij gebruik van dostarlimab in combinatie met carboplatine en paclitaxel voor aanvullende veiligheidsinformatie de productinformatie van de geneesmiddelen die in combinatie met dostarlimab worden toegediend.
Bijwerkingen waarvan bekend is dat ze kunnen optreden bij gebruik van dostarlimab als monotherapie of bij gebruik van carboplatine en paclitaxel, kunnen ook optreden tijdens een behandeling waarbij deze geneesmiddelen worden gecombineerd, zelfs als deze bijwerkingen niet gemeld zijn bij klinische onderzoeken met dostarlimab in combinatie met carboplatine en paclitaxel. De bijwerkingen worden getoond per systeem/orgaanklasse en frequentie. De frequenties worden gedefinieerd als: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 4: Bijwerkingen bij patiënten die behandeld werden met dostarlimab
| Dostarlimab als monotherapie | Dostarlimab in combinatie met chemotherapie |
Bloed- en lymfestelselaandoeningen | ||
Zeer vaak | Anemiea |
|
Endocriene aandoeningen | ||
Zeer vaak | Hypothyroïdie*b | Hypothyroïdiee |
Vaak | Hyperthyroïdie*, bijnierinsufficiëntie* | Hyperthyroïdie |
Soms | Thyreoïditis*c, hypofysitisd | Thyreoïditis, bijnierinsufficiëntie |
Voedings- en stofwisselingsstoornissen | ||
Soms | Type 1 diabetes mellitus, diabetische ketoacidose | Type 1 diabetes mellitus |
Zenuwstelselaandoeningen | ||
Soms | Encefalitis, myasthenia gravis | Myasthenisch syndroom†, |
Oogaandoeningen | ||
Soms | Uveïtisg | Uveïtis |
Hartaandoeningen | ||
Soms |
| Myocarditis†h |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | ||
Vaak | Pneumonitis*i | Pneumonitis |
Maagdarmstelstelaandoeningen | ||
Zeer vaak | Diarree, nausea, |
|
Vaak | Colitis*j, pancreatitisk, gastritis | Colitis†l, pancreatitis |
Soms | Oesofagitis | Immuungemedieerde gastritis†, gastro-intestinale vasculitis† |
Lever- en galaandoeningen | ||
Vaak | Hepatitis*m |
|
Huid- en onderhuidaandoeningen | ||
Zeer vaak | Rash*n, pruritus | Rasho, droge huid |
Skeletspierstelsel- en bindweefselaandoeningen | ||
Zeer vaak | Artralgie* |
|
Vaak | Myalgie |
|
Soms | Immuungemedieerde artritis, polymyalgie rheumatica, immuungemedieerde myositis | Immuungemedieerde artritis, myositis† |
Nier- en urinewegaandoeningen | ||
Soms | Nefritis*p |
|
Algemene aandoeningen en toedieningsplaatsstoornissen | ||
Zeer vaak | Pyrexie | Pyrexie |
Vaak | Koude rillingen |
|
Soms |
| Systemisch ontstekingsreactiesyndroom† |
Onderzoeken | ||
Zeer vaak | Transaminasen verhoogdq | Alanine-aminotransferase verhoogd, |
Letsels, intoxicaties en verrichtingscomplicaties | ||
Vaak | Infusie gerelateerde reactie*r |
|
† Omvat gevallen die zijn geïdentificeerd uit andere klinische onderzoeken bij patiënten met solide tumoren die dostarlimab kregen in combinatie met verschillende soorten antikankerbehandelingen.
* Zie rubriek ‘Beschrijving van geselecteerde bijwerkingen’
a Omvat anemie en auto-immuunhemolytische anemie
b Omvat hypothyroïdie en immuungemedieerde hypothyreoïdie
c Omvat thyreoïditis en immuungemedieerde thyreoïditis
d Omvat hypofysitis en lymfocytaire hypofysitis
e Omvat hypothyroïdie en immuungemedieerde hypothyreoïdie
f Omvat Guillain-Barré-syndroom en demyeliniserende polyneuropathie
g Omvat uveïtis en iridocyclitis
h Omvat myocarditis en immuungemedieerde myocarditis
i Omvat pneumonitis, interstitiële longziekte en immuungemedieerde longziekte
j Omvat colitis, enterocolitis en immuungemedieerde enterocolitis
k Omvat pancreatitis en pancreatitis acuut
l Omvat colitis en enteritis
m Omvat hepatitis, auto-immuunhepatitis en hepatische cytolyse
n Omvat rash, rash maculo-papulair, erytheem, rash vlekkerig, rash pruritus, rash erythemateus, rash papulair, erythema multiforme, huidtoxiciteit, geneesmiddeleneruptie, toxische huideruptie, exfoliatieve uitslag en pemfigoïd
o Omvat rash en rash maculo-papulair
p Omvat nefritis en tubulo-interstitiële nefritis
q Omvat transaminasen verhoogd, alanine-aminotransferase verhoogd, aspartaataminotransferase verhoogd en hypertransaminasemie
r Omvat infusie gerelateerde reactie en overgevoeligheid.
Beschrijving van geselecteerde bijwerkingen
De hieronder beschreven geselecteerde bijwerkingen zijn gebaseerd op de veiligheid van dostarlimab in een gecombineerde monotherapie‑veiligheidsdatabase van 605 patiënten in de GARNET‑studie bij patiënten met EC of andere gevorderde solide tumoren. Immuungerelateerde bijwerkingen werden gedefinieerd als bijwerkingen van graad 2 en hoger; de frequenties hieronder omvatten geen bijwerkingen van graad 1. De richtlijnen voor de behandeling van deze bijwerkingen staan in rubriek 4.2.
Immuungerelateerde bijwerkingen (zie rubriek 4.4)
Immuungerelateerde pneumonitis
Immuungerelateerde pneumonitis trad op bij 14 van de patiënten (2,3%), waaronder pneumonitis van graad 2 (1,3%), graad 3 (0,8%) en graad 4 (0,2%). Pneumonitis leidde bij 8 patiënten (1,3%) tot staking van dostarlimab.
Systemische corticosteroïden (prednison ≥ 40 mg per dag of gelijkwaardig) waren nodig bij 11 patiënten (78,6%) met pneumonitis. Pneumonitis verdween bij 11 patiënten (78,6%).
Immuungerelateerde colitis
Colitis trad op bij 8 patiënten (1,3%), waaronder colitis van graad 2 (0,7%) en graad 3 (0,7%). Colitis leidde bij geen van de patiënten tot staking van dostarlimab.
Systemische corticosteroïden (prednison ≥ 40 mg per dag of gelijkwaardig) waren nodig bij 5 patiënten (62,5%). Bij 5 patiënten met colitis (62,5%) verdween colitis.
Immuungerelateerde hepatitis
Hepatitis trad op bij 3 patiënten (0,5%) en was bij allen graad 3. Systemische corticosteroïden (prednison ≥ 40 mg per dag of gelijkwaardig) waren nodig bij 2 patiënten (66,7%). Hepatitis leidde tot staking van dostarlimab bij 1 patiënt (0,2%) en verdween bij 2 van de 3 patiënten.
Immuungemedieerde endocrinopathieën
Hypothyreoïdie trad op bij 46 patiënten (7,6%) en was bij allemaal van graad 2. Hypothyreoïdie leidde niet tot staking van dostarlimab en verdween bij 17 patiënten (37,0%).
Hyperthyreoïdie trad op bij 14 patiënten (2,3%), waaronder van graad 2 (2,1%) en graad 3 (0,2%). Hyperthyreoïdie leidde niet tot staking van dostarlimab en verdween bij 10 patiënten (71,4%).
Thyreoïditis trad op bij 3 patiënten (0,5%) en was bij allen graad 2. Geen van de gevallen van thyreoïditis verdween; dostarlimab werd niet gestaakt vanwege thyreoïditis.
Bijnierinsufficiëntie trad op bij 7 patiënten (1,2%), waaronder van graad 2 (0,5%) en graad 3 (0,7%). Bijnierinsufficiëntie leidde tot staking van dostarlimab bij 1 patiënt (0,2%) en verdween bij 4 patiënten (57,1%).
Immuungemedieerde nefritis
Nefritis, waaronder tubulo‑interstitiële nefritis, trad op bij 3 patiënten (0,5%) en was in alle gevallen van graad 2. Systemische corticosteroïden (prednison ≥ 40 mg per dag of gelijkwaardig) waren nodig bij 2 patiënten (66,7%) met nefritis. Nefritis leidde tot staking van dostarlimab bij 1 patiënt (0,2%) en verdween bij alle 3 patiënten.
Immuungerelateerde rash
Immuungerelateerde rash (rash, maculopapulaire rash, vlekkerige rash, jeukende rash, pemfigoïd, geneesmiddeleneruptie, huidtoxiciteit en toxische huideruptie) trad op bij 31 patiënten (5,1%), waaronder van graad 3 bij 9 patiënten (1,5%) die dostarlimab kregen. De mediane tijd tot eerste begin van rash was 57 dagen (spreiding: 2 dagen tot 1485 dagen). Systemische corticosteroïden (prednison ≥ 40 mg per dag of gelijkwaardig) waren nodig bij 9 patiënten (29,0%) met rash. Rash leidde tot staking van dostarlimab bij 1 patiënt (0,2%) en verdween bij 24 patiënten (77,4%).
Immuungerelateerde artralgie
Immuungerelateerde artralgie trad op bij 34 patiënten (5,6%). Immuungerelateerde artralgie van graad 3 werd gemeld bij 5 patiënten (0,8%) die dostarlimab kregen. De mediane tijd tot eerste begin van artralgie was 94,5 dagen (spreiding: 1 dag tot 840 dagen). Systemische corticosteroïden (prednison ≥ 40 mg per dag of gelijkwaardig) waren nodig bij 3 patiënten (8,8%) met artralgie. Artralgie leidde tot staking van dostarlimab bij 1 patiënt (0,2%) en verdween bij 19 patiënten met artralgie (55,9%).
Infusiegerelateerde reacties
Infusiegerelateerde reacties waaronder overgevoeligheid traden op bij 6 patiënten (1,0%), waaronder infusiegerelateerde reacties van graad 2 (0,3%) en graad 3 (0,2%). Alle patiënten herstelden van de immuungerelateerde reactie.
Klasse-effecten van immuuncheckpointremmers
Tijdens de behandeling met andere immuuncheckpointremmers zijn gevallen van de volgende bijwerkingen gemeld, die ook tijdens de behandeling met dostarlimab kunnen optreden: coeliakie, pancreatische exocriene insufficiëntie.
Immunogeniciteit
In de GARNET-studie werd getest op antilichamen tegen geneesmiddelen (anti‑drug antibodies, ADA’s) bij 315 patiënten die dostarlimab kregen en de incidentie van de tijdens de behandeling met dostarlimab optredende ADA’s was 2,5%. Neutraliserende antilichamen werden aangetoond bij 1,3% van de patiënten. Gelijktijdige toediening met carboplatine en paclitaxel had geen nadelig effect op de immunogeniciteit van dostarlimab. In de RUBY-studie was er onder de 225 patiënten die behandeld waren met dostarlimab in combinatie met carboplatine en paclitaxel en bij wie de aanwezigheid van ADA’s beoordeeld kon worden, geen incidentie van tijdens de behandeling met dostarlimab optredende ADA’s of tijdens de behandeling optredende neutraliserende antilichamen.
Bij de patiënten die ADA’s ontwikkelden, was er geen bewijs van een veranderde werkzaamheid of veiligheid van dostarlimab.
Oudere patiënten
Van de 605 patiënten die werden behandeld met dostarlimab als monotherapie, was 51,6% jonger dan 65 jaar, 36,9% was 65-75 jaar en 11,5% was 75 jaar of ouder. Van de 241 patiënten die werden behandeld met dostarlimab in combinatie met carboplatine-paclitaxel, was 52,3% jonger dan 65 jaar, was 36,5% 65-75 jaar en was 11,2% 75 jaar of ouder. Er werden geen algemene verschillen in veiligheid gemeld tussen oudere (≥ 65 jaar) en jongere patiënten (< 65 jaar).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
GlaxoSmithKline Trading Services Limited
12 Riverwalk
Citywest Business Campus
Dublin 24
Ierland
D24 YK11
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/21/1538/001
10. DATUM VAN HERZIENING VAN DE TEKST
15/09/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4309209 | JEMPERLI 500 mg concentraat voor oplossing voor infusie | - | € 5631,07 | Ja | - | - |