1. NAAM VAN HET GENEESMIDDEL
Combivent® 0,5 mg/2,5 ml + 2,5 mg/2,5 ml
Verneveloplossing
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
2,5 ml oplossing voor inhalatie bevat 522 mcg ipratropiumbromide monohydraat (= 500 mcg ipratropium bromide watervrij) en 3013 mcg salbutamolsulfaat (= 2500 mcg salbutamol base).
Voor een volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Verneveloplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Combivent is aangewezen voor de behandeling van bronchospasmen bij volwassenen met chronisch obstructief longlijden die behoefte hebben aan een symptomatische behandeling met een combinatie anticholinergicum/bèta‑2‑mimeticum.
4.2 Dosering en wijze van toediening
Dosering
Combivent verneveloplossing is uitsluitend bestemd voor volwassenen.
Volwassenen (ook ouderen)
- De aanbevolen posologie bedraagt 1 ampul, 3 à 4 maal daags.
Bijzondere populaties
Nier- of leverinsufficiëntie
- Er zijn geen gegevens beschikbaar. Combivent verneveloplossing moet met de nodige omzichtigheid worden gebruikt bij deze patiënten.
Pediatrische populatie
- Combivent mag niet worden gebruikt bij kinderen en jongeren.
Astma
In geval van astma moet een gelijktijdige anti-inflammatoire behandeling worden overwogen.
Behandeling van acute aanvallen
In de meeste gevallen is 1 ampul voldoende om de symptomen te verlichten.
In ernstige gevallen, wanneer de aanval niet met 1 ampul kan worden verlicht, kan de toediening van een tweede ampul nodig zijn. De patiënt wordt dan aangeraden om onmiddellijk een arts te raadplegen of zich naar het dichtstbijzijnde ziekenhuis te begeven.
Als hogere dosissen Combivent dan aanbevolen noodzakelijk zijn om de symptomen onder controle te brengen, moet het behandelingsplan van de patiënt opnieuw worden geëvalueerd.
Wanneer bij snel verergerende dyspneu de behandeling met Combivent verneveloplossing voor inhalatie geen verbetering brengt, wordt de patiënt aangeraden om onmiddellijk een arts te raadplegen of zich naar het dichtstbijzijnde ziekenhuis te begeven.
Wijze van toediening
- Combivent verneveloplossing moet via een vernevelaar of via een toestel met positieve intermittente druk worden toegediend.
- Elke ampul is gebruiksklaar en moet niet meer worden opgelost. Sommige toestellen vergen echter een hoger volume dan 2,5 ml: in die gevallen voegt men aan Combivent fysiologisch serum toe om het vereiste minimale volume te bereiken.
- De oplossing is voor inhalatie bestemd en niet voor orale inname of parenterale toediening.
- De behandeling moet onder medisch toezicht worden opgestart en toegediend, bijvoorbeeld in een ziekenhuis. Een behandeling thuis wordt slechts in uitzonderlijke gevallen aanbevolen (ernstige symptomen of patiënten die hogere doses nodig hebben) wanneer een lage dosis snelwerkende bèta-agonisten onvoldoende verlichting heeft geboden, en na raadpleging van een ervaren arts.
- De behandeling met de verneveloplossing voor inhalatie moet altijd worden begonnen aan de laagst aanbevolen dosis (1 ampul). In zeer ernstige gevallen is het soms nodig om 2 ampullen te gebruiken om de symptomen te verlichten. De toediening moeworden stopgezet zodra de symptomen voldoende onder controle zijn.
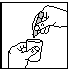
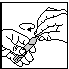
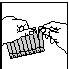
tek. 1 tek. 2 tek. 3
1. De inhalator voorbereiden volgens de instructies van de arts of de fabrikant.
2. Een ampul met monodosis afscheuren (tek. 1).
3. De ampul met monodosis openen door aan het bovenste uiteinde te draaien (tek. 2).
4. De inhoud in het reservoir van de inhalator ledigen en het verdunningsmiddel toevoegen (tek. 3).
5. De inhalator conform de instructies gebruiken.
6. Na gebruik, de eventuele resten van de oplossing weggooien en het toestel schoonmaken.
Aangezien de ampul voor eenmalig gebruik geen bewaarmiddel bevat, is het belangrijk om de oplossing voor inhalatie na openen te gebruiken en voor elke aerosoltoepassing een nieuwe ampul te openen om microbiële besmetting te voorkomen. Gedeeltelijk gebruikte, geopende of beschadigde ampullen moeten worden weggegooid.
Het wordt sterk aanbevolen de Combivent verneveloplossing niet met andere geneesmiddelen in dezelfde inhalator te mengen.
4.3 Contra-indicaties
Combivent is niet geïndiceerd bij patiënten met:
- Obstructieve hypertrofische cardiomyopathie, tachyaritmie.
- Overgevoeligheid voor de werkzame stof, of voor een van de hulpstoffen vermeld in rubriek 6.1.
4.8 Bijwerkingen
Overzicht van het veiligheidsprofiel
Het merendeel van de bijwerkingen kan worden toegeschreven aan de anticholinergische en β- adrenergische eigenschappen van Combivent. Zoals bij elke plaatselijke behandeling kan Combivent lokale irritaties veroorzaken.
De vaakst voorkomende bijwerkingen die gerapporteerd werden tijdens de klinische studies zijn: hoofdpijn, irritatie van de keel, hoest, droge mond, problemen met de gastro-intestinale motiliteit (met inbegrip van constipatie, diarree en braken), misselijkheid en duizeligheid.
Overzicht in tabelvorm van bijwerkingen
De bijwerkingen zijn geclassificeerd in functie van hun incidentie, gebruik makend van het volgende systeem:
Zeer vaak (1/10); vaak (1/100, <1/10); soms ( 1/1.000, <1/100); zelden (1/10.000, <1/1.000); zeer zelden (<1/10.000)
Immuunsysteemaandoeningen | |
Voedings- en stofwisselingsstoornissen: | |
Psychische stoornissen: | |
Zenuwstelselaandoeningen: | |
Oogaandoeningen: | |
Hartaandoeningen: | |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen: | |
Maagdarmstelselaandoeningen: | |
Aandoeningen van de huid en van het onderhuidse bindweefsel: | |
Skeletspierstelsel- en bindweefselaandoeningen: | |
Nier- en urinewegaandoeningen: | |
Algemene aandoeningen en toedieningsplaatsstoornissen: | |
Onderzoeken: | |
* Bijwerking in geen enkele van de geselecteerde klinische proeven over Combivent waargenomen. Een schatting van de vervangfrequentie werd uitgevoerd volgens de Europese SPK-richtlijn met 3/3488=0,00086, dat als “zelden” wordt gerapporteerd.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten - Afdeling Vigilantie
Postbus 97 - B-1000 Brussel Madou
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
Luxemburg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Website : www.guichet.lu/pharmacovigilance
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Boehringer Ingelheim SComm
Arnaud Fraiteurlaan 15-23
1050 Brussel
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Belgium: BE187056
Luxembourg : 0632/01097766
- NN 0250701 : 1*20 ampullen
- NN 0306806 : 1*60 ampullen
- NN 0306823 : 2*60 ampullen
10. DATUM VAN HERZIENING VAN DE TEKST: 24/11/2023
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1404920 | COMBIVENT VIAL MONODOSE 20X2,5ML | R03AL02 | € 12,36 | - | Ja | € 2,31 | € 1,39 |
| 1688951 | COMBIVENT MONODOSE VIAL 60X2,5ML | R03AL02 | € 22,08 | - | Ja | € 5,6 | € 3,36 |