SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Cotellic 20 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke filmomhulde tablet bevat cobimetinib‑hemifumaraat overeenkomend met 20 mg cobimetinib.
Hulpstof met bekend effect
Elke filmomhulde tablet bevat 36 mg lactosemonohydraat.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet.
Witte, ronde filmomhulde tabletten met een diameter van ongeveer 6,6 mm, met ‘COB’ op één zijde gegraveerd.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Cotellic is geïndiceerd voor gebruik in combinatie met vemurafenib voor de behandeling van volwassen patiënten met een inoperabel of gemetastaseerd melanoom met een BRAF V600-mutatie (zie rubriek 4.4 en 5.1).
4.2 Dosering en wijze van toediening
De behandeling met Cotellic in combinatie met vemurafenib dient alleen geïnitieerd te worden door en onder toezicht plaats te vinden van een bevoegd arts met ervaring in het gebruik van oncologische geneesmiddelen.
Voordat deze behandeling wordt gestart, moeten patiënten een bevestiging hebben dat de tumor positief is voor een BRAF V600-mutatie door middel van een gevalideerde test (zie rubriek 4.4 en 5.1).
Dosering
De aanbevolen dosering van Cotellic is 60 mg (3 tabletten van 20 mg) eenmaal daags.
Cotellic wordt genomen gedurende een cyclus van 28 dagen. Elke dosis bestaat uit drie tabletten van 20 mg (60 mg) en moet eenmaal daags worden ingenomen gedurende 21 opeenvolgende dagen (dag 1 tot 21 ‑ behandelperiode); gevolgd door een 7-daagse onderbreking (dag 22 tot 28 ‑ onderbreking behandeling). Elke volgende Cotellic-behandelcyclus moet na deze onderbreking van 7 dagen worden gestart.
Raadpleeg de SmPC van vemurafenib voor informatie over de dosering van vemurafenib.
Duur van de behandeling
Behandeling met Cotellic moet worden voortgezet tot de patiënt niet langer voordeel ondervindt of tot het optreden van onacceptabele toxiciteit (zie tabel 1 hieronder).
Gemiste dosis
Wanneer een dosis wordt gemist, kan deze worden ingenomen tot 12 uur voorafgaand aan de volgende dosis om zo het eenmaaldaagse schema te behouden.
Braken
In geval van braken nadat Cotellic is ingenomen, dient de patiënt op die dag geen extra dosis in te nemen en dient de behandeling zoals voorgeschreven de volgende dag te worden voortgezet.
Algemene doseringsaanpassingen
De beslissing over het al dan niet verlagen van de dosering voor één of beide behandelingen moet gebaseerd zijn op het oordeel van de behandelend arts met betrekking tot de veiligheid en verdraagbaarheid van de individuele patiënt. Doseringsaanpassing van Cotellic is onafhankelijk van de doseringsaanpassing van vemurafenib.
Indien doses achterwege worden gelaten vanwege toxiciteit, moeten deze niet worden ingehaald. Als de dosering eenmaal is verlaagd, moet deze later niet weer worden verhoogd.
Tabel 1 hieronder geeft algemene richtlijnen voor doseringsaanpassing van Cotellic.
Tabel 1 Aanbevolen doseringsaanpassingen voor Cotellic
Graad (CTC‑AE)* | Aanbevolen Cotellic‑dosering |
Graad 1 of graad 2 (draaglijk) | Geen dosisverlaging. Handhaaf Cotellic met een dosering van 60 mg eenmaal daags (3 tabletten) |
Graad 2 (ondraaglijk) of graad 3/4 |
|
1e optreden | Onderbreek behandeling tot verbetering naar graad ≤ 1, hervat behandeling met 40 mg eenmaal daags (2 tabletten) |
2e optreden | Onderbreek behandeling tot verbetering naar graad ≤ 1, hervat behandeling met 20 mg eenmaal daags (1 tablet) |
3e optreden | Overweeg de behandeling definitief te staken |
*De hevigheid van de klinische bijwerkingen zoals gegradeerd door de ‘Common Terminology Criteria for Adverse Events‘ v4.0 (CTC‑AE)
Advies over doseringsaanpassing bij bloeding
Graad 4-voorvallen of cerebrale bloeding: De behandeling met Cotellic moet worden onderbroken. De behandeling met Cotellic moet definitief worden gestaakt bij bloedingen die zijn toegeschreven aan Cotellic.
Graad 3-voorvallen: De behandeling met Cotellic moet worden onderbroken tijdens de evaluatie om een mogelijke bijdrage aan de bijwerking te voorkomen. Er zijn geen gegevens beschikbaar over de effectiviteit van doseringsaanpassing van Cotellic bij bloedingen. Als hervatten van de Cotellic-behandeling wordt overwogen, moet dat klinisch worden beoordeeld. De dosering van vemurafenib kan worden voortgezet als de Cotellic-behandeling wordt onderbroken, indien klinisch geïndiceerd.
Advies over doseringsaanpassing bij linkerventrikeldisfunctie
Het definitief staken van de behandeling met Cotellic moet worden overwogen als cardiale symptomen worden toegeschreven aan Cotellic en deze niet verbeteren na tijdelijke onderbreking.
Tabel 2 Aanbevolen doseringsaanpassingen voor Cotellic bij patiënten met linkerventrikelejectiefractie (LVEF)-daling ten opzichte van baseline
Patiënt | LVEF-waarde | Aanbevolen doserings-aanpassing voor Cotellic | LVEF-waarde na onderbreking behandeling | Aanbevolen dagelijkse dosis Cotellic |
Asymptomatisch | ≥ 50% | Doorgaan met huidige dosis | N.v.t. | N.v.t. |
< 40% | Behandeling 2 weken onderbreken | < 10% absolute daling ten opzichte van baseline | 1e optreden: 40 mg | |
2e optreden: 20 mg | ||||
3e optreden: | ||||
< 40% | Definitief staken | |||
Symptomatisch | N.v.t. | Behandeling 4 weken onderbreken | Asymptomatisch en < 10% absolute daling ten opzichte van baseline | 1e optreden: 40 mg |
2e optreden: 20 mg | ||||
3e optreden: | ||||
Asymptomatisch en < 40% | Definitief staken | |||
Symptomatisch ongeacht LVEF | Definitief staken |
N.v.t = niet van toepassing
De behandeling met vemurafenib kan worden voortgezet als de Cotellic-behandeling wordt aangepast, indien klinisch geïndiceerd.
Advies over doseringsaanpassing bij rabdomyolyse en verhoogde creatinefosfokinase (CPK)
Rabdomyolyse of symptomatisch verhoogde CPK
De behandeling met Cotellic moet worden onderbroken. Als rabdomyolyse of symptomatisch verhoogde CPK niet binnen 4 weken verbeteren, moet de Cotellic-behandeling definitief worden gestaakt. Als de ernst binnen 4 weken is verbeterd met minstens één graad dan kan Cotellic worden hervat met een dosisverlaging van 20 mg, indien klinisch geïndiceerd. Patiënten moeten nauwlettend worden gecontroleerd. De dosering van vemurafenib kan worden voortgezet als de Cotellic-behandeling wordt aangepast.
Asymptomatisch verhoogde CPK
Graad 4: De behandeling met Cotellic moet worden onderbroken. Als de verhoogde CPK niet binnen 4 weken verbetert tot graad ≤ 3 na onderbreking van de dosering moet de Cotellic-behandeling definitief worden gestaakt. Als de ernst binnen 4 weken is verbeterd naar graad ≤ 3 dan kan Cotellic worden hervat met een dosisverlaging van 20 mg, indien klinisch geïndiceerd en de patiënt moet nauwlettend worden gecontroleerd. De dosering van vemurafenib kan worden voortgezet als de Cotellic-behandeling wordt aangepast.
Graad ≤ 3: Nadat rabdomyolyse is uitgesloten, hoeft de Cotellic-dosering niet te worden aangepast.
Advies over doseringsaanpassing van Cotellic indien gebruikt met vemurafenib
Afwijkingen van de leverfunctiewaarden
Bij graad 1- en 2-afwijkingen van de leverfunctiewaarden moeten Cotellic en vemurafenib worden gehandhaafd volgens de voorgeschreven dosering.
Graad 3: Cotellic moet worden gehandhaafd volgens de voorgeschreven dosering. De dosering van vemurafenib kan verlaagd worden, zoals klinisch is aangewezen. Raadpleeg hiervoor de SmPC van vemurafenib.
Graad 4: De behandeling met Cotellic en vemurafenib moet worden onderbroken. Als afwijkingen van de leverfunctiewaarden binnen 4 weken verbeteren tot graad ≤ 1, moet Cotellic worden hervat met een dosisverlaging van 20 mg en vemurafenib met een klinisch geschikte dosering, volgens de bijbehorende SmPC.
De behandeling met Cotellic en vemurafenib moet worden gestaakt als afwijkingen van de leverfunctiewaarden niet binnen 4 weken verbeteren tot graad ≤ 1, of als graad 4‑afwijkingen van de leverfunctiewaarden terugkeren na aanvankelijke verbetering.
Lichtgevoeligheid
Graad ≤ 2 (draaglijk) lichtgevoeligheid moet worden behandeld met ondersteunende zorg.
Graad 2 (ondraaglijk) of graad ≥ 3 lichtgevoeligheid: Cotellic en vemurafenib moeten onderbroken worden tot verbetering tot graad ≤ 1. De behandeling kan worden hervat zonder aanpassing van de dosering van Cotellic. De dosering van vemurafenib dient zoals klinisch aangewezen te worden verlaagd, raadpleeg de SmPC van vemurafenib voor meer informatie.
Uitslag
Uitslag kan zowel met Cotellic- als vemurafenib-behandeling voorkomen. De dosering van Cotellic en/of vemurafenib kan ofwel tijdelijk worden onderbroken en/of verlaagd, zoals klinisch geïndiceerd. Aanvullend, voor:
Graad ≤ 2 (draaglijke) uitslag moet behandeld worden met ondersteunende zorg. De dosering van Cotellic kan zonder aanpassing worden gehandhaafd.
Graad 2 (ondraaglijk) of graad ≥ 3 acnevormige uitslag: De algemene aanbevelingen voor doseringsaanpassingen voor Cotellic in tabel 1 moeten worden gevolgd. De dosering van vemurafenib kan worden gehandhaafd als de behandeling met Cotellic wordt aangepast (indien klinisch geïndiceerd).
Graad 2 (ondraaglijk) of graad ≥ 3 niet‑acnevormige of maculopapuleuze uitslag: de dosering van Cotellic kan ongewijzigd worden gehandhaafd, indien klinisch geïndiceerd. De dosering van vemurafenib kan zowel tijdelijk worden onderbroken en/of verlaagd. Raadpleeg de SmPC van vemurafenib voor meer informatie.
QT-verlenging
Raadpleeg de SmPC van vemurafenib (zie rubriek 4.2) voor doseringsaanpassingen van vemurafenib als tijdens behandeling de QTc de 500 msec overschrijdt. Voor Cotellic is geen doseringsaanpassing vereist wanneer het in combinatie met vemurafenib wordt gebruikt.
Speciale populaties
Ouderen
Er is geen doseringsaanpassing nodig voor patiënten ≥ 65 jaar.
Verminderde nierfunctie
Bij patiënten met een licht of matig verminderde nierfunctie wordt doseringsaanpassing niet aanbevolen op basis van de farmacokinetische populatie-analyse (zie rubriek 5.2). Er zijn zeer beperkte gegevens beschikbaar voor Cotellic bij patiënten met een ernstig verminderde nierfunctie, daarom kan een effect niet worden uitgesloten. Voorzichtigheid is geboden bij het gebruik van Cotellic bij patiënten met een ernstig verminderde nierfunctie.
Verminderde leverfunctie
Bij patiënten met een verminderde leverfunctie wordt doseringsaanpassing niet aanbevolen. Patiënten met een ernstig verminderde leverfunctie kunnen verhoogde plasmaconcentraties van ongebonden cobimetinib hebben vergeleken met patiënten met een normale leverfunctie (zie rubriek 5.2). Afwijkingen van de leverfunctiewaarden kunnen optreden met Cotellic en voorzichtigheid is geboden bij patiënten met enige mate van verminderde leverfunctie (zie rubriek 4.4).
Niet-blanke patiënten
De veiligheid en werkzaamheid van Cotellic zijn niet vastgesteld bij niet-blanke patiënten.
Pediatrische patiënten
De veiligheid en werkzaamheid van Cotellic zijn niet vastgesteld bij kinderen en adolescenten jonger dan 18 jaar. De momenteel beschikbare gegevens worden beschreven in rubriek 4.8, 5.1 en 5.2, maar er kan geen doseringsadvies worden gegeven.
Wijze van toediening
Cotellic is bestemd voor oraal gebruik. De tabletten moeten in hun geheel worden doorgeslikt met water. Ze kunnen zowel met als zonder voedsel worden ingenomen.
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
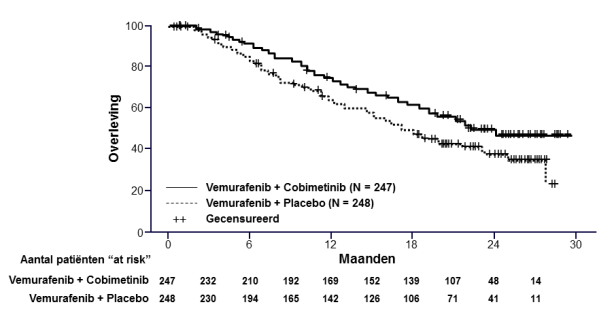
De veiligheid van Cotellic in combinatie met vemurafenib is onderzocht bij 247 patiënten met gevorderd BRAF V600-gemuteerd melanoom in onderzoek GO28141. De mediane tijd tot het ontstaan van de eerste graad ≥ 3 bijwerkingen was 0,6 maanden in de behandelarm met Cotellic plus vemurafenib vs. 0,8 maanden in de behandelarm met placebo plus vemurafenib.
De veiligheid van Cotellic in combinatie met vemurafenib is tevens onderzocht bij 129 patiënten met gevorderd BRAF V600-gemuteerd melanoom in onderzoek NO25395. Het veiligheidsprofiel van onderzoek NO25395 was consistent met hetgeen waargenomen werd in onderzoek GO28141.
In onderzoek GO28141 waren de meest voorkomende bijwerkingen (> 20%) die met een hogere frequentie werden waargenomen in de behandelarm met Cotellic plus vemurafenib diarree, uitslag, misselijkheid, koorts, lichtgevoeligheidsreactie, verhoogd alanineaminotransferase, verhoogd aspartaataminotransferase, verhoogd creatinefosfokinase in het bloed en braken. De meest voorkomende bijwerkingen (> 20%) die met een hogere frequentie werden waargenomen in de behandelarm met placebo plus vemurafenib waren artralgie, alopecia en hyperkeratose. Vermoeidheid werd met eenzelfde frequentie waargenomen in beide behandelarmen.
Raadpleeg de SmPC van vemurafenib voor een volledige beschrijving van alle bijwerkingen die geassocieerd zijn met de vemurafenib-behandeling.
Tabel met een samenvatting van de bijwerkingen
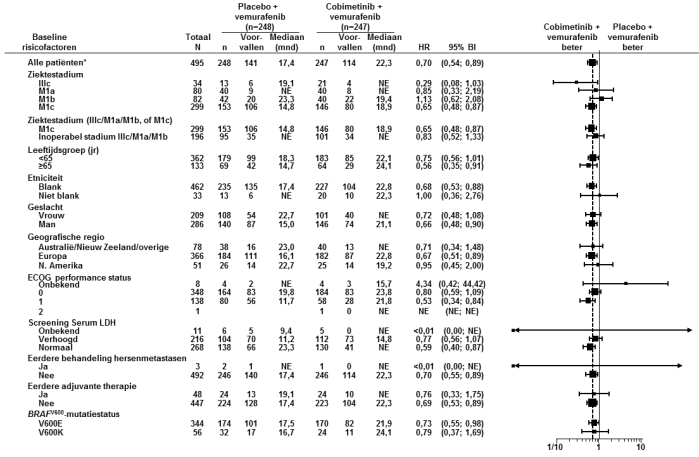
Bijwerkingen zijn gebaseerd op resultaten van een multicenter, gerandomiseerd, dubbelblind, placebogecontroleerd, fase III-onderzoek (GO28141) ter beoordeling van de veiligheid en werkzaamheid van Cotellic in combinatie met vemurafenib vergeleken met alleen vemurafenib bij patiënten met inoperabel lokaal gevorderd (stadium IIIc) of gemetastaseerd melanoom (stadium IV) dat positief is voor de BRAF V600-mutatie en die niet eerder waren behandeld.
Bijwerkingenfrequenties zijn gebaseerd op de veiligheidsanalyse van patiënten die behandeld werden met cobimetinib en vemurafenib met een mediane follow-up van 11,2 maanden (cut-off-datum voor gegevens van 19 september 2014).
Bijwerkingen die werden gemeld bij patiënten met melanoom zijn hieronder weergegeven naar systeem/orgaanklassen, frequentie en graad van ernst volgens MedDRA. De volgende termen zijn gebruikt voor de classificatie van frequentie:
Zeer vaak ≥ 1/10
Vaak ≥ 1/100, < 1/10
Soms ≥ 1/1.000, < 1/100
Zelden ≥ 1/10.000, < 1/1,000
Zeer zelden < 1/10.000
Tabel 3 is een opsomming van bijwerkingen die geassocieerd worden met het gebruik van Cotellic. Binnen elke frequentiegroep worden bijwerkingen weergegeven in volgorde van afnemende ernst en deze werden gemeld volgens de NCI‑CTCAE v 4.0 (‘common toxicity criteria’) voor de beoordeling van toxiciteit in onderzoek GO28141.
Tabel 3 Bijwerkingen bij patiënten die behandeld werden met Cotellic in combinatie met vemurafenib in onderzoek GO28141^
Systeem/orgaanklasse | Zeer vaak | Vaak | Soms |
Neoplasmata, benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) |
| Basaalcelcarcinoom, cutaan plaveiselcelcarcinoom**, keratoacanthoom** |
|
Bloed- en lymfestelselaandoeningen | Anemie |
|
|
Voedings- en stofwisselingsstoornissen |
| Dehydratie, hypofosfatemie, hyponatriëmie, hyperglykemie |
|
Oogaandoeningen | Sereuze retinopathiea, wazig zien | Verminderd gezichtsvermogen |
|
Bloedvataandoeningen | Hypertensie, |
|
|
Ademhalingsstelsel-, borstkas- en mediastinum-aandoeningen |
| Pneumonitis |
|
Maagdarmstelsel-aandoeningen | Diarree, |
|
|
Huid- en onderhuid-aandoeningen | Lichtgevoeligheidb, uitslag, maculopapuleuze uitslag, acnevormige dermatitis, hyperkeratose**, |
|
|
Sketelspierstelsel- en bindweefselaandoeningen |
|
| Rabdomyolyse*** |
Algemene aandoeningen en toedieningsplaats-stoornissen | Koorts, |
|
|
Onderzoeken | Verhoogd CPK in bloed, | Verlaagde ejectiefractie (EF), |
|
^ Cut-off-datum voor gegevens van 19 september 2014
* Raadpleeg de paragraaf Bloeding in de rubriek ‘Omschrijving van specifieke bijwerkingen’
** Raadpleeg de paragraaf Cutaan plaveiselcelcarcinoom, keratoacanthoom en hyperkeratose in de rubriek ‘Omschrijving van specifieke bijwerkingen’
*** Raadpleeg de paragraaf Rabdomyolyse in de rubriek ‘Omschrijving van specifieke bijwerkingen’
a Omvat zowel voorvallen van chorioretinopathie als loslating van het netvlies die indicatief zijn voor sereuze retinopathie (zie rubriek 4.4)
b Gecombineerd getal omvat meldingen van lichtgevoeligheidsreactie, zonnebrand, zonnedermatitis, actinische elastose
cBijwerkingen zijn vastgesteld in een onderzoek met cobimetinib als monotherapie (ML29733; VS-onderzoek). Echter, dit zijn ook de gemelde bijwerkingen voor de combinatie van cobimetinib en vemurafenib in klinische onderzoeken uitgevoerd bij patiënten met inoperabel of gemetastaseerd melanoom.
Omschrijving van specifieke bijwerkingen
Bloeding
Bloedingen werden vaker gemeld in de behandelarm met Cotellic plus vemurafenib dan in de behandelarm met placebo plus vemurafenib (alle types en graden: 13% vs. 7%). De mediane tijd tot ontstaan was 6,1 maanden in de behandelarm met Cotellic plus vemurafenib.
Het merendeel van de voorvallen was graad 1 of 2 en niet ernstig. De meeste voorvallen verdwenen zonder verandering in Cotellic-dosering. Ernstige bloedingen (waaronder intracraniale en maag-darmbloedingen) werden gemeld na het in de handel brengen. Bij gelijktijdig gebruik van anti-aggregantia of anticoagulantia kan het risico op bloedingen verhoogd zijn. Als een bloeding optreedt behandel dan zoals klinisch geïndiceerd (zie rubriek 4.2 en 4.4).
Rabdomyolyse
Rabdomyolyse werd gemeld na het in de handel brengen. Symptomen van rabdomyolyse vereisen een geschikte klinische beoordeling en behandeling zoals geïndiceerd, met daarnaast dosisaanpassing van Cotellic of staken van de behandeling naargelang de ernst van de bijwerking (zie rubriek 4.2 en 4.4).
Lichtgevoeligheid
Lichtgevoeligheid werd met een hogere frequentie waargenomen in de behandelarm met Cotellic plus vemurafenib vs. behandelarm met placebo plus vemurafenib (47% vs. 35%). Het merendeel van de voorvallen was graad 1 of 2, met graad ≥ 3 voorvallen bij 4% van de patiënten in de behandelarm met Cotellic plus vemurafenib vs. 0% in de behandelarm met placebo plus vemurafenib.
Er waren geen duidelijke trends in de tijd tot het ontstaan van de graad ≥ 3-voorvallen. Graad ≥ 3 lichtgevoeligheidsvoorvallen in de behandelarm met Cotellic plus vemurafenib werden behandeld met primair topische geneesmiddelen in combinatie met dosisonderbreking van zowel cobimetinib als vemurafenib (zie rubriek 4.2).
Er is geen bewijs voor het optreden van lichtgevoeligheid bij Cotellic als monotherapie.
Cutaan plaveiselcelcarcinoom, keratoacanthoom en hyperkeratose
Cutaan plaveiselcelcarcinoom werd met een lagere frequentie gemeld in de behandelarm met Cotellic plus vemurafenib vs. behandelarm met placebo plus vemurafenib (alle graden: 3% vs. 13%). Er werd een lagere frequentie van keratoacanthoom gemeld in de behandelarm met Cotellic plus vemurafenib vs. behandelarm met placebo plus vemurafenib (alle graden: 2% vs. 9%). Er werd een lagere frequentie van hyperkeratose gemeld in de behandelarm met Cotellic plus vemurafenib vs. behandelarm met placebo plus vemurafenib (alle graden: 11% vs. 30%).
Sereuze retinopathie
Gevallen van sereuze retinopathie werden gemeld bij patiënten die behandeld werden met Cotellic (zie rubriek 4.4.) Bij patiënten die nieuwe of verergerde visusstoornissen melden, wordt een oogheelkundig onderzoek aanbevolen. Sereuze retinopathie kan behandeld worden door onderbreking, dosisverlaging of het staken van de behandeling (zie tabel 1 in rubriek 4.2).
Linkerventrikeldisfunctie
Daling van LVEF ten opzichte van baseline werd gemeld bij patiënten die Cotellic kregen (zie rubriek 4.4). LVEF moet beoordeeld worden voor aanvang van de behandeling om de baselinewaarden vast te stellen, daarna na de eerste maand van de behandeling en ten minste elke 3 maanden, of zoals klinisch geïndiceerd tot het staken van de behandeling. Daling van LVEF ten opzichte van baseline kan behandeld worden door onderbreking, dosisverlaging of het staken van de behandeling (zie rubriek 4.2).
Afwijkende laboratoriumuitslagen
Afwijkingen van de leverfunctiewaarden
Afwijkingen van de leverfunctiewaarden, in het bijzonder ALAT, ASAT en AF, werden waargenomen bij patiënten die werden behandeld met Cotellic in combinatie met vemurafenib (zie rubriek 4.4). Laboratoriumtesten voor de lever moeten voor aanvang van de combinatiebehandeling gecontroleerd worden en maandelijks tijdens de behandeling of vaker indien klinisch geïndiceerd (zie rubriek 4.2).
Verhoogd creatinefosfokinase in bloed
Asymptomatisch verhoogde CPK-waarden in het bloed werden met een hogere frequentie waargenomen in de behandelarm met Cotellic plus vemurafenib vs. behandelarm met placebo plus vemurafenib in onderzoek GO28141 (zie rubriek 4.2 en 4.4). In elke behandelarm van het onderzoek werd een voorval van rabdomyolyse waargenomen met gelijktijdige verhoging van CPK in bloed.
Tabel 4 geeft de frequentie weer van de gemeten afwijkingen van de leverfunctiewaarden en de verhoogde creatinefosfokinase voor alle graden en graad 3‑4.
Tabel 4 Leverfunctie‑ en andere laboratoriumtesten waargenomen in fase III-onderzoek GO28141
Veranderingen in gerapporteerde laboratoriumgegevens | Cobimetinib plus vemurafenib | Placebo plus | ||
| Alle graden | Graad 3‑4 | Alle graden | Graad 3‑4 |
Leverfunctietest | ||||
Verhoogd AF | 69 | 7 | 55 | 3 |
Verhoogd ALAT | 67 | 11 | 54 | 5 |
Verhoogd ASAT | 71 | 7 | 43 | 2 |
Verhoogd GGT | 62 | 20 | 59 | 17 |
Verhoogd bloedbilirubine | 33 | 2 | 43 | 1 |
Andere afwijkende laboratoriumtesten | ||||
Verhoogd CPK in bloed | 70 | 12 | 14 | < 1 |
Speciale populaties
Ouderen
In het fase III-onderzoek met Cotellic in combinatie met vemurafenib bij patiënten met een inoperabel of gemetastaseerd melanoom (n = 247) waren 183 patiënten (74%) < 65 jaar en 44 patiënten (18%) waren 65-74 jaar, 16 patiënten (6%) waren 75-84 jaar en 4 patiënten (2%) waren 85 jaar. Het aantal patiënten dat bijwerkingen ervoer was vergelijkbaar bij patiënten met een leeftijd van < 65 jaar en die met een leeftijd van 65 jaar. Patiënten 65 jaar ervoeren vaker ernstige bijwerkingen (SAE’s) en bijwerkingen die leidden tot het staken van cobimetinib dan patiënten < 65 jaar.
Pediatrische patiënten
De veiligheid van Cotellic bij kinderen en adolescenten is niet volledig vastgesteld. De veiligheid van Cotellic werd beoordeeld in een multicenter, open-label, dosis-escalatieonderzoek met 55 pediatrische patiënten in de leeftijd van 2 tot 17 jaar met solide tumoren. Het veiligheidsprofiel van Cotellic bij deze patiënten was consistent met dat bij de volwassen populatie (zie rubriek 5.2).
Verminderde nierfunctie
Er zijn geen farmacokinetische onderzoeken uitgevoerd bij patiënten met een verminderde nierfunctie. Doseringsaanpassing wordt niet aanbevolen bij een licht tot matig verminderde nierfunctie op basis van resultaten van de farmacokinetische populatieanalyse. Er zijn zeer beperkte gegevens beschikbaar voor Cotellic bij patiënten met een ernstig verminderde nierfunctie. Voorzichtigheid is geboden bij het gebruik van Cotellic bij patiënten met een ernstig verminderde nierfunctie.
Verminderde leverfunctie
Bij patiënten met een verminderde leverfunctie wordt doseringsaanpassing niet aanbevolen (zie rubriek 5.2).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/15/1048/001
10. DATUM VAN HERZIENING VAN DE TEKST
18 maart 2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3383593 | COTELLIC 20MG FILMOMH TABL 63 X 20MG | L01EE02 | - | € 5474 | Ja | - | - |