SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Erivedge 150 mg harde capsules
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke harde capsule bevat 150 mg vismodegib.
Hulpstof met bekend effect
Elke harde capsule bevat 71,5 mg lactosemonohydraat.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Harde capsule (capsule).
Roze ondoorzichtige onderste capsulehelft met de aanduiding ‘150 mg’ en een grijze opake bovenste capsulehelft met de aanduiding ‘VISMO’ in zwarte inkt. Het formaat van de capsule is ‘Size 1’ (afmetingen 19,0 x 6,6 mm).
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Erivedge is geïndiceerd voor gebruik bij volwassen patiënten met:
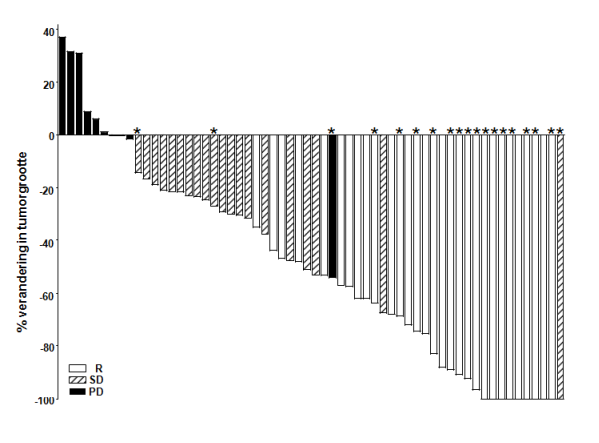
symptomatisch gemetastaseerd basaalcelcarcinoom;
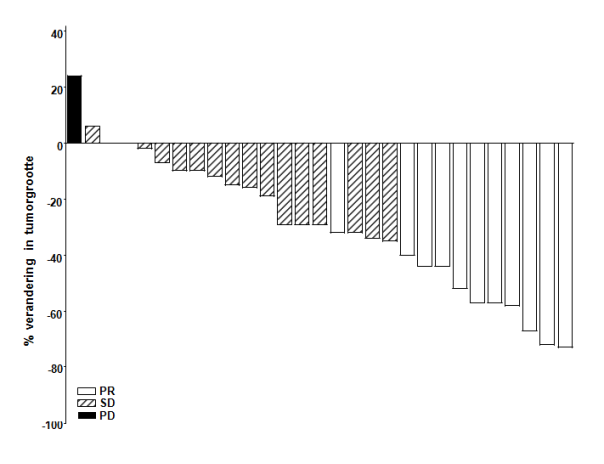
lokaal uitgebreid basaalcelcarcinoom dat ongeschikt is voor chirurgie of radiotherapie (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Erivedge dient alleen te worden voorgeschreven door of onder toezicht van een medisch specialist met ervaring in de behandeling van de toegelaten indicatie.
Dosering
De aanbevolen dosering is eenmaal daags één capsule van 150 mg.
Vergeten doses
Als een dosis wordt vergeten, dienen patiënten de instructie te krijgen om de vergeten dosis niet in te nemen, maar door te gaan met de volgende geplande dosis.
Duur van de behandeling
In klinische onderzoeken werd behandeling met Erivedge voortgezet tot progressie van de ziekte of tot onacceptabele toxiciteit. Onderbreking van de behandeling was toegestaan voor maximaal 4 weken, gebaseerd op de individuele verdraagbaarheid.
De baat van een voortgezette behandeling moet regelmatig worden geëvalueerd, waarbij de optimale duur van de behandeling varieert voor elke individuele patiënt.
Speciale populaties
Ouderen
Er is geen dosisaanpassing nodig bij patiënten van ≥ 65 jaar oud (zie rubriek 5.2). Op een totaal aantal van 138 patiënten in 4 klinische onderzoeken naar Erivedge bij uitgebreid basaalcelcarcinoom was ongeveer 40% van de patiënten ≥ 65 jaar oud en werden over het geheel genomen geen verschillen in veiligheid en werkzaamheid waargenomen tussen deze patiënten en jongere patiënten.
Verminderde nierfunctie
Het wordt niet verwacht dat een licht en matig ernstig verminderde nierfunctie de eliminatie van vismodegib beïnvloed en er is geen doseringsaanpassing nodig. Zeer beperkte gegevens zijn beschikbaar van patiënten met een ernstig verminderde nierfunctie. Patiënten met een ernstig verminderde nierfunctie dienen nauwlettend te worden gecontroleerd op bijwerkingen.
Verminderde leverfunctie
Er is geen doseringsaanpassing nodig voor patiënten met een licht, matig ernstig of ernstig verminderde leverfunctie, bepaald volgens de criteria van de National Cancer Institite Organ Dysfunction Workgroup (NCI-ODWG) voor verminderde leverfunctie (zie rubriek 5.2):
licht: totaal bilirubine (TB) ≤ bovengrens van normaalwaarde (ULN), aspartaataminotransferase (ASAT) > ULN of ULN < TB ≤ 1,5 x ULN, elke ASAT
matig ernstig: 1,5 x ULN < TB < 3 x ULN, elke ASAT
ernstig: 3 x ULN < TB < 10 x ULN, elke ASAT
Pediatrische patiënten
De veiligheid en werkzaamheid van Erivedge bij kinderen en adolescenten jonger dan 18 jaar zijn niet vastgesteld.
Om veiligheidsredenen (zie rubriek 4.4 en 5.3) mag dit geneesmiddel niet worden gebruikt bij kinderen en adolescenten jonger dan 18 jaar.
Wijze van toediening
Erivedge is bedoeld voor oraal gebruik. De capsules moeten in hun geheel worden doorgeslikt met water, met of zonder voedsel (zie rubriek 5.2). De capsules mogen niet worden geopend om onbedoelde blootstelling van patiënten en zorgverleners te voorkomen.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Vrouwen die zwanger zijn of borstvoeding geven (zie rubriek 4.4 en 4.6).
Vrouwen die zwanger kunnen worden en zich niet houden aan het Erivedge Zwangerschapspreventie-programma (zie rubriek 4.4 en 4.6).
Gelijktijdige toediening van sint-janskruid (Hypericum perforatum) (zie rubriek 4.5).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest voorkomende bijwerkingen die bij ≥ 30% van de patiënten optraden waren spierspasmen (74,6%), alopecia (65,9%), dysgeusie (58,7%), gewichtsafname (50,0%), vermoeidheid (47,1%), misselijkheid (34,8%) en diarree (33,3%).
Lijst van bijwerkingen in tabelvorm
Bijwerkingen worden in de onderstaande tabel 1 weergegeven per systeem/orgaanklasse en absolute frequentie.
Frequenties zijn gedefinieerd als:
Zeer vaak (≥ 1/10)
Vaak (≥ 1/100, < 1/10)
Soms (≥ 1/1000, < 1/100)
Zelden ( 1/10.000, <1/1000)
Zeer zelden (< 1/10.000)
Niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Binnen elke frequentiegroep zijn bijwerkingen gerangschikt naar afnemende ernst.
De veiligheid van Erivedge is beoordeeld in klinische onderzoeken met 138 patiënten die werden behandeld voor uitgebreid basaalcelcarcinoom, wat zowel gemetastaseerd BCC als lokaal uitgebreid BCC omvat. In vier klinische open-label fase- 1- en 2-onderzoeken werden patiënten behandeld met ten minste één dosis Erivedge als monotherapie in doses van 150 mg. Doses > 150 mg resulteerden in klinische onderzoeken niet in hogere plasmaconcentraties en patiënten met doses > 150 mg zijn in de analyse opgenomen. Daarnaast werd de veiligheid beoordeeld in een onderzoek na verlening van de handelsvergunning (post-approval onderzoek) met 1215 patiënten met uitgebreid BCC met evalueerbare veiligheidsgegevens die werden behandeld met 150 mg. Over het algemeen was het waargenomen veiligheidsprofiel consistent bij zowel patiënten met gemetastaseerd BCC als patiënten met lokaal uitgebreid BCC en in de verschillende onderzoeken, zoals hieronder beschreven.
Tabel 1 Bijwerkingen die optraden bij met Erivedge behandelde patiënten
Systeem/orgaanklasse volgens MedDRA | Zeer vaak | Vaak | Frequentie niet bekend |
Endocriene aandoeningen |
|
| Pubertas praecox**** |
Voedings- en stofwisselingsstoornissen | Verminderde eetlust | Uitdroging |
|
Zenuwstelselaandoeningen | Dysgeusie | Hypogeusie |
|
Maag-darmstelselaandoeningen | Misselijkheid | Pijn in de bovenbuik |
|
Lever- en galaandoeningen |
| Verhoogde hepatische enzymen** | Geneesmiddelgeïnduceerd leverletsel***** |
Huid- en onderhuidaandoeningen | Alopecia | Madarose | Stevens-johnsonsyndroom (SJS)/toxische epidermale necrolyse (TEN), Geneesmiddelexantheem met eosinofilie en systemische symptomen (DRESS)/acuut gegeneraliseerd pustuleus exantheem (AGEP) ****** |
Skeletspierstelsel- en bindweefselaandoeningen | Spierspasmen | Rugpijn | Voortijdige sluiting epifysen**** |
Voortplantingsstelsel- en borstaandoeningen | Amenorroe* |
|
|
Algemene aandoeningen en toedieningsplaatsstoornissen | Gewichtsafname | Asthenie |
|
Alle rapportage is gebaseerd op bijwerkingen van alle gradaties aan de hand van de National Cancer Institute - Common Terminology Criteria for Adverse Events v 3.0, tenzij anders aangegeven. | |||
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal agentschap voor geneesmiddelen en gezondheidsproducten
Afdeling Vigilantie
Galileelaan 5/03 | Postbus 97 |
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/13/848/001
10. DATUM VAN HERZIENING VAN DE TEKST
1 juli 2021
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau (http://www.ema.europa.eu).
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3025376 | ERIVEDGE CAPS 28 X 150 MG | L01XJ01 | - | € 4161,87 | Ja | - | - |