RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Erivedge 150 mg, gélules
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque gélule contient 150 mg de vismodegib.
Excipient à effet notoire
Chaque gélule contient 71,5 mg de lactose monohydraté.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Gélule.
Le corps de la gélule rose opaque porte l’inscription « 150 mg » et la coiffe de la gélule gris opaque porte l’inscription « VISMO » à l’encre noire.
La gélule est de taille « N°1 » (dimensions : 19,0 x 6,6 mm).
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Erivedge est indiqué pour le traitement des patients adultes atteints de :
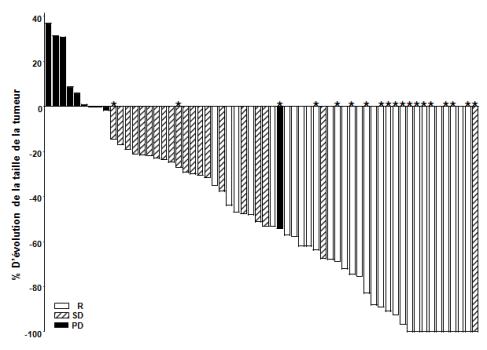
carcinome baso-cellulaire métastatique symptomatique
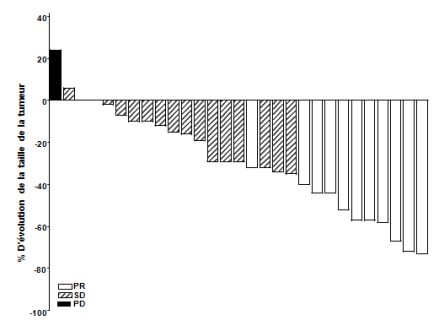
carcinome baso-cellulaire localement avancé pour lequel la chirurgie ou la radiothérapie ne sont pas appropriées (voir rubrique 5.1).
4.2 Posologie et mode d’administration
Erivedge doit être uniquement prescrit par ou sous le contrôle d’un médecin spécialiste expérimenté dans la gestion de l’indication autorisée.
Posologie
La dose recommandée est une gélule de 150 mg, une fois par jour.
Omission d’une dose
Si une dose est omise, les patients doivent être informés de ne pas prendre la dose oubliée, mais de reprendre le traitement à la prochaine dose planifiée.
Durée du traitement
Dans les études cliniques, le traitement par Erivedge a été poursuivi jusqu’à progression de la maladie ou toxicité inacceptable. Des interruptions de traitement allant jusqu’à 4 semaines ont été autorisées en fonction de la tolérance individuelle.
Les bénéfices de la poursuite du traitement doivent être évalués régulièrement, la durée optimale de traitement étant variable d’un patient à l’autre.
Populations particulières
Personnes âgées
Aucune adaptation posologique n'est nécessaire chez les patients âgés de 65 ans et plus (voir rubrique 5.2). Sur un total de 138 patients inclus dans 4 études cliniques évaluant Erivedge dans le carcinome baso-cellulaire avancé, environ 40 % des patients étaient âgés de 65 ans et plus. Aucune différence globale relative à la sécurité et l'efficacité n’a été observée entre ces patients et les patients plus jeunes.
Insuffisants rénaux
Une insuffisance rénale légère et modérée ne devrait pas impacter l’élimination du vismodegib et aucune adaptation posologique n’est nécessaire. Des données très limitées sont disponibles chez les patients atteints d'insuffisance rénale sévère. Les patients atteints d’insuffisance rénale sévère doivent être surveillés attentivement pour les effets indésirables.
Insuffisants hépatiques
Aucune adaptation posologique n’est nécessaire chez les patients atteints d’insuffisance hépatique légère, modérée ou sévère, défini selon les critères d’insuffisance hépatique établis par le NCI-ODWG (National Cancer Institute - Organ Dysfunction Working Group) (voir rubrique 5.2) :
Légère : bilirubine totale (BT) ≤ limite normale supérieure (LNS), aspartate aminotransférase (ASAT) > LNS ou LNS < BT ≤ 1,5 x LNS, ASAT quelle que soit la valeur ;
Modérée : 1,5 x LNS < BT < 3 x LNS, ASAT quelle que soit la valeur ;
Sévère : 3 x LNS < BT < 10 x LNS, ASAT quelle que soit la valeur
Population pédiatrique
La sécurité et l’efficacité de Erivedge chez les enfants et les adolescents âgés de moins de 18 ans n’ont pas été établies.
Pour des raisons de sécurité (voir rubriques 4.4 et 5.3), ce médicament ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans.
Mode d’administration
Erivedge s’administre par voie orale. Les gélules doivent être avalées entières avec de l'eau, avec ou sans nourriture (voir rubrique 5.2). Elles ne doivent pas être ouvertes afin d’éviter l’exposition involontaire des patients et des professionnels de santé.
4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Femmes enceintes ou allaitant (voir rubriques 4.4 et 4.6).
Femmes en âge de procréer qui ne respectent pas le Programme de Prévention de la Grossesse de Erivedge (voir rubriques 4.4 et 4.6).
Administration concomitante avec du millepertuis (Hypericum perforatum) (voir rubrique 4.5).
4.8 Effets indésirables
Résumé du profil de tolérance
Les effets indésirables (EI) les plus fréquents, survenus chez au moins 30 % des patients ont été les suivants : spasmes musculaires (74,6 %), alopécies (65,9 %), dysgueusie (58,7 %), perte de poids (50,0 %), fatigue (47,1 %), nausées (34,8 %) et diarrhées (33,3 %).
Liste des effets indésirables sous forme de tableau
Les EI sont présentés dans le tableau 1 ci-dessous par système organe-classe MedDRA, et fréquence absolue.
Les fréquences sont définies comme suit :
Très fréquent (≥ 1/10)
Fréquent (≥ 1/100 à < 1/10)
Peu fréquent (≥ 1/1 000 à < 1/100)
Rare (≥ 1/10 000 à < 1/1 000)
Très rare (< 1/10 000)
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
Dans chaque groupe de fréquence, les EI sont présentés suivant un ordre décroissant de sévérité.
La sécurité de Erivedge a été évaluée dans des études cliniques avec 138 patients traités pour un carcinome baso-cellulaire avancé (CBC avancé), comprenant à la fois le carcinome baso-cellulaire métastatique (CBC métastatique) et le carcinome baso-cellulaire localement avancé (CBC localement avancé). Dans quatre études cliniques de phase 1 et 2 en ouvert, les patients ont été traités avec au moins une dose de Erivedge en monothérapie à des doses 150 mg. Les doses > 150 mg n'ont pas entraîné de concentrations plasmatiques plus élevées dans les études cliniques. Les patients recevant des doses > 150 mg ont été inclus dans les analyses. De plus, la sécurité a été évaluée dans une étude post-autorisation incluant 1215 patients atteints d’un CBC avancé, évaluables pour la sécurité et traités à la dose de 150 mg. D’une manière générale, le profil de tolérance observé était similaire chez les patients atteints d’un CBC métastatique et chez les patients atteints d’un CBC localement avancé dans les études cliniques comme décrit ci-dessous.
Tableau 1 : Effets indésirables survenus chez des patients traités par Erivedge
Système Organe Classe | Très fréquent | Fréquent | Fréquence indéterminée |
Affections endocriniennes |
|
| puberté précoce**** |
Troubles du métabolisme et de la nutrition | perte d’appétit | déshydratation |
|
Affections du système nerveux | dysgueusie | hypogueusie |
|
Affections gastro-intestinales | nausées | douleur abdominale haute |
|
Troubles hépatobiliaires |
| enzymes hépatiques augmentées** | atteintes hépatiques induites par un médicament***** |
Affections de la peau et du tissu sous-cutané | alopécie | madarose | syndrome de Stevens-Johnson (SSJ)/nécrolyse épidermique toxique (NET), syndrome d’hypersensibilité médicamenteuse systémique avec éosinophilie (syndrome DRESS) et pustulose exanthématique aiguë généralisée (PEAG)****** |
Affections musculo-squelettiques et systémiques | spasmes musculaires | dorsalgie | fusion prématurée des épiphyses**** |
Affections des organes de reproduction et du sein | aménorrhée* |
|
|
Troubles généraux et anomalies au site d’administration | perte de poids | asthénie |
|
Les notifications des EI de tous grades ont été faites selon le système NCI-CTC v3.0 par le National Cancer Institute - Critère de Terminologie Commun des événements indésirables v3.0, sauf indication contraire. | |||
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration (voir ci-dessous).
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Avenue Galilée 5/03 | Boîte Postale 97 |
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy
Bâtiment de Biologie Moléculaire et de Biopathologie (BBB)
CHRU de Nancy – Hôpitaux de Brabois
Rue du Morvan
F-54 511 VANDOEUVRE LES NANCY CEDEX
Tél : (+33) 3 83 65 60 85 / 87
E-mail : crpv@chru-nancy.fr
ou
Direction de la Santé
Division de la Pharmacie et des Médicaments
20, rue de Bitbourg
L-1273 Luxembourg-Hamm
Tél. : (+352) 2478 5592
E-mail : pharmacovigilance@ms.etat.lu
Lien pour le formulaire : https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
EU/1/13/848/001
10. DATE DE MISE A JOUR DU TEXTE
1 juillet 2021
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments http://www.ema.europa.eu.
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 3025376 | ERIVEDGE CAPS 28 X 150 MG | L01XJ01 | - | € 4161,87 | Oui | - | - |