Notice : Information du patient
Vabysmo 120 mg/mL, solution injectable
faricimab
![]() Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de la rubrique 4 comment signaler les effets indésirables.
Ce médicament fait l’objet d’une surveillance supplémentaire qui permettra l’identification rapide de nouvelles informations relatives à la sécurité. Vous pouvez y contribuer en signalant tout effet indésirable que vous observez. Voir en fin de la rubrique 4 comment signaler les effets indésirables.
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
- Gardez cette notice. Vous pourriez avoir besoin de la relire.
- Si vous avez d’autres questions, interrogez votre médecin.
- Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
En complément de la notice, votre médecin vous remettra un guide patient qui fournit des informations de sécurité importantes pour vous aider à comprendre les bénéfices et les risques associés à Vabysmo, ainsi que les mesures à prendre si vous présentez certains symptômes.
1. Qu’est-ce que Vabysmo et dans quels cas est-il utilisé |
Qu’est-ce que Vabysmo et dans quel cas est-il utilisé
Vabysmo contient la substance active faricimab, qui appartient à un groupe de médicaments appelé agents anti-angiogéniques.
Vabysmo est injecté dans l’œil par votre médecin pour traiter des troubles oculaires chez les adultes appelés :
• dégénérescence maculaire liée à l’âge néovasculaire (humide) (DMLAn),
• baisse d’acuité visuelle due à un œdème maculaire diabétique (OMD),
• baisse d’acuité visuelle due à un œdème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR).
Ces troubles affectent la macula, qui est la partie centrale de la rétine (la couche sensible à la lumière à l’arrière de l’œil) responsable de la vision fine et centrale. La DMLAn est causée par la croissance de vaisseaux sanguins anormaux qui laissent passer du sang et du liquide dans la macula, et l’OMD est causé par des fuites au niveau des vaisseaux sanguins, ce qui provoque le gonflement de la macula. L’OVR centrale est l’obstruction du vaisseau sanguin principal (veine) qui achemine le sang hors de la rétine, et l’OVR de branche, est l’obstruction d’une des plus petites branches de la veine principale. En raison de l’augmentation de la pression dans ces vaisseaux sanguins, il y a une fuite de liquide dans la rétine, provoquant un gonflement de la macula (œdème maculaire).
Comment agit Vabysmo
Vabysmo reconnaît et bloque spécifiquement l’activité des protéines connues sous le nom d’angiopoïétine-2 et de facteur de croissance de l’endothélium vasculaire A. Lorsque ces protéines sont présentes à des taux plus élevés que la normale, elles peuvent provoquer la croissance de vaisseaux sanguins anormaux et/ou endommager les vaisseaux normaux, avec des fuites dans la macula, provoquant un gonflement ou des lésions qui peuvent affecter la vision. En se fixant à ces protéines, Vabysmo peut bloquer leurs actions et prévenir la croissance anormale des vaisseaux, des fuites et du gonflement. Vabysmo peut améliorer la maladie et/ou ralentir son aggravation et ainsi maintenir, voire améliorer, votre vision.
2. Quelles sont les informations à connaître avant de recevoir Vabysmo |
Vous ne devez pas recevoir Vabysmo :
• si vous êtes allergique au faricimab ou à l’un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6).
• si vous avez une infection active ou suspectée dans ou autour de l’œil.
• si vous avez des douleurs ou une rougeur dans l’œil (inflammation oculaire).
Si l’un de ces cas vous concerne, informez-en votre médecin. Vous ne devez pas recevoir Vabysmo.
Avertissements et précautions
Discutez avec votre médecin avant de recevoir Vabysmo :
• si vous souffrez d’un glaucome (une affection oculaire généralement causée par une pression élevée dans l’œil).
• si vous avez des antécédents de vision de flashs lumineux ou de corps flottants (points flottants sombres) et si vous présentez une augmentation soudaine de la taille et du nombre de corps flottants.
• si vous avez subi une chirurgie oculaire au cours des quatre dernières semaines ou si une chirurgie oculaire est prévue au cours des quatre prochaines semaines.
• si vous avez déjà eu des maladies oculaires ou des traitements oculaires.
Informez immédiatement votre médecin si vous :
• présentez une perte de vision soudaine.
• développez des signes d’une possible infection ou inflammation oculaire, comme une augmentation de la rougeur de l’œil, une douleur oculaire, une augmentation de la gêne oculaire, une vision trouble ou diminuée, une augmentation du nombre de petites particules dans votre champ de vision, une sensibilité accrue à la lumière.
De plus, il est important que vous sachiez que :
• la sécurité et l’efficacité de Vabysmo lorsqu’il est administré dans les deux yeux en même temps n’ont pas été étudiées, et que son utilisation de cette manière peut entraîner l’augmentation des risques d’effets indésirables.
• les injections de Vabysmo peuvent causer une augmentation temporaire de la pression oculaire (pression intraoculaire) chez certains patients dans les 60 minutes suivant l’injection. Votre médecin surveillera cela après chaque injection.
• votre médecin vérifiera si vous présentez d’autres facteurs de risque susceptibles d’augmenter le risque de déchirure ou de décollement de l’une des couches situées à l’arrière de l’œil (décollement de la rétine ou déchirure, et décollement ou déchirure de l’épithélium pigmentaire rétinien), auquel cas Vabysmo doit être administré avec précaution.
Lorsque certains médicaments qui agissent de manière similaire à Vabysmo sont administrés, il existe un risque connu de formation de caillots sanguins bloquant les vaisseaux sanguins (événements thromboemboliques artériels), ce qui peut entraîner une crise cardiaque ou un accident vasculaire cérébral. Comme de petites quantités de médicaments entrent dans le sang, il existe un risque théorique de tels événements après l’injection de Vabysmo dans l’œil.
L’expérience est limitée concernant le traitement :
- Des patients présentant des infections actives.
- Des patients atteints de DMLAn, d’OBVR et d’OVCR âgés de 85 ans ou plus.
- Des patients atteints d’OMD lié à un diabète de type I.
- Des patients diabétiques avec des taux de sucre dans le sang élevés (Hb1Ac de plus de 10 %).
- Des patients diabétiques atteints d’une maladie de l’œil appelée « rétinopathie diabétique proliférante » causée par le diabète.
- Des patients diabétiques avec une hypertension artérielle supérieure à 140/90 mmHg et présentant une maladie des vaisseaux sanguins.
- Des patients atteints d’OMD recevant des injections à une fréquence inférieure à toutes les 8 semaines sur une longue durée.
L’expérience est limitée concernant le traitement des patients recevant des injections à une fréquence inférieure à toutes les 8 semaines sur une longue durée, et ces patients peuvent être plus à risque de présenter des effets indésirables.
Il n’y a pas d’expérience concernant le traitement :
- Des patients diabétiques ou atteints d’OBVR ou d’OVCR présentant une hypertension artérielle non contrôlée.
Si vous vous trouvez dans l’un des cas cités ci-dessus, votre médecin prendra en considération ce manque d’information quand il vous traitera avec Vabysmo.
Enfants et adolescents
L’utilisation de Vabysmo chez les enfants et les adolescents n’a pas été étudiée car la DMLAn, l’OMD, l’OBVR et l’OVCR surviennent principalement chez les adultes.
Autres médicaments et Vabysmo
Informez votre médecin si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Grossesse et allaitement
Vabysmo n’a pas été étudié chez la femme enceinte. Vabysmo ne doit pas être utilisé pendant la grossesse à moins que les bénéfices potentiels pour la patiente ne l’emportent sur les risques potentiels pour l’enfant à naître.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant que ce médicament ne vous soit administré.
L’allaitement n’est pas recommandé pendant le traitement par Vabysmo, car on ne sait pas si Vabysmo passe dans le lait maternel humain.
Les femmes qui pourraient devenir enceintes doivent utiliser une méthode de contraception efficace pendant le traitement et pendant au moins trois mois après l’arrêt du traitement par Vabysmo. Si vous débutez une grossesse ou pensez être enceinte pendant le traitement, informez-en immédiatement votre médecin.
Conduite de véhicules et utilisation de machines
Après votre injection de Vabysmo, vous pourriez avoir des problèmes de vision temporaires (par exemple une vision trouble). Ne conduisez pas de véhicules et n’utilisez pas de machines tant que ces troubles persistent.
Vabysmo contient du sodium
Le médicament contient moins de 1 mmol de sodium (23 mg) par dose, c’est-à-dire qu’il est essentiellement « sans sodium ».
Vabysmo contient du polysorbate
Ce médicament contient 0,02 mg de polysorbate par dose de 0,05 mL. Les polysorbates peuvent provoquer des réactions allergiques. Informez votre médecin si vous avez déjà présenté une allergie.
3. Comment utiliser Vabysmo |
Comment Vabysmo est-il administré
La dose recommandée est de 6 mg de faricimab.
Dégénérescence maculaire liée à l’âge néovasculaire (humide) (DMLAn)
• Vous recevrez une injection tous les mois pendant les 3 premiers mois.
• Puis, vous pourrez recevoir des injections jusqu’à tous les 4 mois. Votre médecin décidera de la fréquence des injections en fonction de l’état de votre œil.
Baisse d’acuité visuelle due à un œdème maculaire diabétique (OMD) ou à un œdème maculaire secondaire à une occlusion de branche veineuse rétinienne (OBVR) ou de la veine centrale de la rétine (OVCR)
• Vous recevrez une injection tous les mois pendant au moins 3 mois.
• Puis, vous pourrez recevoir des injections moins fréquemment. Votre médecin décidera de la fréquence des injections en fonction de l’état de votre œil.
Mode d’administration
Vabysmo est injecté dans votre œil (injection intravitréenne) par un médecin expérimenté dans l’administration d’injections oculaires.
Avant l’injection, votre médecin utilisera un produit désinfectant pour les yeux pour nettoyer soigneusement votre œil afin d’éviter toute infection. Votre médecin vous administrera un collyre (anesthésique local) pour insensibiliser l’œil afin de réduire ou d’éviter la douleur causée par l’injection.
Combien de temps le traitement par Vabysmo dure-t-il
Il s’agit d’un traitement à long terme, pouvant durer des mois ou des années. Votre médecin surveillera régulièrement votre état pour vérifier que le traitement fonctionne. En fonction de la manière dont vous répondez au traitement par Vabysmo, votre médecin pourra vous demander d’augmenter ou de réduire la fréquence des doses.
Si vous oubliez une dose de Vabysmo
Si vous oubliez une dose, programmez un nouveau rendez-vous avec votre médecin dès que possible.
Si vous arrêtez d’utiliser Vabysmo
Consultez votre médecin avant d’arrêter le traitement. L’arrêt du traitement peut augmenter le risque de perte de votre vision, et votre vision peut s’aggraver.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin.
4. Quels sont les effets indésirables éventuels ? |
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Les effets indésirables associés à l’administration de Vabysmo sont soit dus au médicament lui-même, soit à la procédure d’injection, et touchent principalement l’œil.
Certains effets indésirables pourraient être graves
Contactez immédiatement votre médecin si vous présentez l’un des signes suivants, qui sont des signes de réactions allergiques, d’inflammation ou d’infections :
• des douleurs oculaires, une gêne accrue, une augmentation de la rougeur des yeux, une vision trouble ou diminuée, une augmentation du nombre de petites particules dans votre champ de vision ou une sensibilité accrue à la lumière – ce sont des signes d’une possible infection, d’une inflammation oculaire, ou d’une réaction allergique.
• une diminution ou un changement soudain de la vision.
Quels sont les autres effets indésirables éventuels ?
Les autres effets indésirables qui peuvent survenir après le traitement par Vabysmo sont présentés ci-dessous.
La plupart des effets indésirables sont légers à modérés et disparaissent généralement dans la semaine suivant chaque injection.
Contactez votre médecin si l’un des effets indésirables suivants devient sévère.
Très fréquent (pouvant affecter plus d’une personne sur 10)
- Aucun
Fréquent (pouvant affecter jusqu’à 1 personne sur 10) :
• Opacification du cristallin de l’œil (cataracte)
• Déchirure de l’une des couches situées à l’arrière de l’œil (déchirure de l’épithélium pigmentaire rétinien - DMLAn uniquement)
• Décollement de la substance gélifiée à l’intérieur de l’œil (décollement du vitré)
• Augmentation de la pression à l’intérieur de l’œil (pression intraoculaire augmentée)
• Saignement des petits vaisseaux sanguins de la couche externe de l’œil (hémorragie conjonctivale)
• Taches mobiles ou formes sombres dans votre champ de vision (corps flottants vitréen)
• Douleur oculaire
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
• Inflammation ou infection grave à l’intérieur de l’œil (endophtalmie)
• Inflammation de la substance gélatineuse à l’intérieur de l’œil/œil rouge (hyalite)
• Inflammation de l’iris et de son tissu adjacent dans l’œil (iritis, iridocyclite, uvéite)
• Saignement à l’intérieur de l’œil (hémorragie vitréenne)
• Gêne oculaire
• Démangeaisons (prurit oculaire)
• Déchirure de la rétine (fond de l’œil qui détecte la lumière)
• Yeux rouges (hyperhémie oculaire/conjonctivale)
• Sensation d’avoir quelque chose dans l’œil
• Vision trouble
• Diminution de la netteté de la vision (diminution de l’acuité visuelle)
• Douleur pendant l’intervention (douleur liée à la procédure d’injection)
• Décollement de la rétine
• Augmentation de la production de larmes (augmentation de la sécrétion lacrymale)
• Égratignure de la cornée, lésion de la couche transparente du globe oculaire qui recouvre l’iris (abrasion cornéenne)
• Irritation oculaire
Rare (pouvant affecter jusqu’à 1 personne sur 1 000) :
• Diminution temporaire de la netteté de la vision (diminution transitoire de l’acuité visuelle)
• Opacification du cristallin due à une blessure (cataracte traumatique)
Indéterminée
- Vascularite rétinienne (inflammation des vaisseaux sanguins à l’arrière de l’œil)
- Vascularite rétinienne occlusive (obstruction des vaisseaux sanguins à l’arrière de l’œil, généralement en présence d’une inflammation)
Lorsque certains médicaments qui agissent de manière similaire à Vabysmo sont administrés, il existe un risque connu de formation de caillots sanguins bloquant les vaisseaux sanguins (événements thromboemboliques artériels), ce qui peut entraîner une crise cardiaque ou un accident vasculaire cérébral. Comme de petites quantités de médicaments entrent dans le sang, il existe un risque théorique de tels événements après l’injection de Vabysmo dans l’œil.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration (ci-dessous). En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Pour la Belgique
Agence fédérale des médicaments et des produits de santé
www.afmps.be
Division Vigilance:
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@fagg-afmps.be
Pour la France
Agence nationale de sécurité du médicament et des produits de santé (ANSM)
et réseau des Centres Régionaux de Pharmacovigilance
Site internet: https://signalement.social-sante.gouv.fr/
Pour le Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
5. Comment conserver Vabysmo |
Votre médecin, votre pharmacien ou votre infirmier/ère est responsable de la conservation de ce médicament et d’éliminer correctement tout produit non utilisé. Les informations suivantes sont destinées aux professionnels de santé.
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage et l’étiquette après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
À conserver au réfrigérateur (2 °C – 8 °C).
Ne pas congeler.
Conserver le flacon dans l’emballage extérieur d’origine à l’abri de la lumière.
Avant utilisation, le flacon non ouvert peut être conservé à température ambiante, entre 20 °C et 25 °C, pendant une durée maximale de 24 heures.
6. Contenu de l’emballage et autres informations |
Ce que contient Vabysmo
• La substance active est le faricimab. Un mL de solution injectable contient 120 mg de faricimab. Chaque flacon contient 28,8 mg de faricimab dans une solution de 0,24 mL. Cette quantité est suffisante pour permettre de délivrer une dose unique de 0,05 mL de solution contenant 6 mg de faricimab.
• Les autres composants sont : L-histidine, acide acétique 30 % (E 260), L-méthionine, chlorure de sodium, saccharose, polysorbate 20 (E 432), eau pour préparations injectables (voir Rubrique 2 « Vabysmo contient du sodium et du polysorbate »).
Comment se présente Vabysmo et contenu de l’emballage extérieur
Vabysmo est une solution limpide à opalescente, incolore à jaune brunâtre.
Boîte de 1 flacon en verre et de 1 aiguille de transfert avec filtre, stérile et émoussée (18 gauge x 1½ pouce, 1,2 mm x 40 mm, 5 µm) à usage unique.
Titulaire de l’autorisation de mise sur le marché
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
Fabricant
Roche Pharma AG
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Allemagne
Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l’autorisation de mise sur le marché :
| België/Belgique/Belgien, | France |
|
|
| ||
La dernière date à laquelle cette notice a été révisée est mai 2025.
Autres sources d’informations
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l’Agence européenne des médicaments : https://www.ema.europa.eu/en.
------------------------------------------------------------------------------------------------------------------------
Les informations suivantes sont destinées uniquement aux professionnels de santé :
Instructions d’utilisation du flacon :
Avant de commencer : | |
| |
| |
Rassembler le matériel | |
| |
Rassembler le matériel suivant : | |
Pour s’assurer que tout le liquide se dépose au fond du flacon, placer le flacon en position verticale sur une surface plane (pendant environ 1 minute) après le retrait de l’emballage (voir Figure B). Tapoter doucement le flacon avec votre doigt (voir Figure C), car le liquide peut coller au sommet du flacon. | |||
|
|
| |
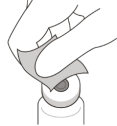
Retirer le capuchon amovible du flacon (voir Figure D) et essuyer le septum du flacon avec un tampon imbibé d’alcool (voir Figure E). | |||
|
|
| |
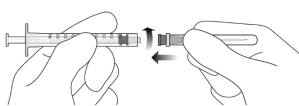
Raccorder fermement de manière aseptique l’aiguille de transfert avec filtre de 18 gauge x 1½ pouce incluse à une seringue Luer Lock de 1 mL (voir Figure F). | |||
|
| ||
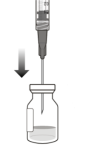
En utilisant une technique aseptique, pousser l’aiguille de transfert avec filtre au centre du septum du flacon (voir Figure G), enfoncer l’aiguille jusqu’au bout, puis incliner légèrement le flacon de sorte que l’aiguille touche le bord inférieur du flacon (voir Figure H). | |||
| |
| |
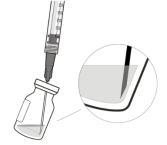
Tenir le flacon légèrement incliné et prélever lentement tout le liquide du flacon (voir Figure I). Maintenir le biseau de l’aiguille de transfert avec filtre immergé dans le liquide pour éviter l’introduction d’air. | |||
|
| ||
Veiller à ce que la tige du piston soit suffisamment tirée en arrière lors de l’extraction du flacon, afin de vider complètement l’aiguille de transfert avec filtre (voir Figure I). | |||
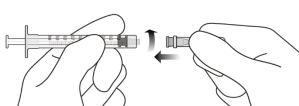
Déconnecter l’aiguille de transfert avec filtre de la seringue et l’éliminer conformément à la réglementation en vigueur. | |||
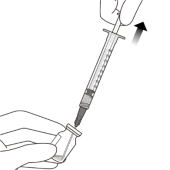
Raccorder fermement de manière aseptique l’aiguille d’injection de 30 gauge x ½ pouce à la seringue Luer Lock (voir Figure J). | |||
|
| ||
Retirer avec précaution le protège aiguille en plastique de l’aiguille en le tirant tout droit. | |||
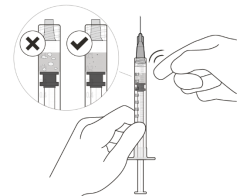
Pour détecter la présence de bulles d’air, tenir la seringue avec l’aiguille pointant vers le haut. S’il y a des bulles d’air, tapoter doucement la seringue avec votre doigt jusqu’à ce que les bulles remontent vers le haut (voir Figure K). | |||
|
| ||
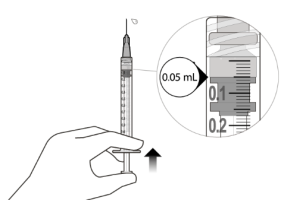
Expulser délicatement l’air de la seringue et de l’aiguille, et appuyer lentement sur le piston pour aligner l’extrémité de la butée en caoutchouc avec le repère de dose de 0,05 mL. La seringue est prête pour l’injection (voir Figure L). S’assurer que l’injection soit administrée immédiatement après la préparation de la dose. | |
|
|
13. | Injecter lentement jusqu’à ce que la butée en caoutchouc atteigne le fond de la seringue pour administrer le volume de 0,05 mL. Confirmer l’administration de la dose complète en vérifiant que la butée en caoutchouc a atteint le fond du cylindre de la seringue. |
PRIX
| Code CNK | Emballage | Prix | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|
| 4624631 | Vabysmo 120 mg/ml solution injectable | € 953,6 | Oui | - | - |