- Overzicht bijsluiters
- Bijsluiter
Bijsluiter: informatie voor de patiënt
Lucentis® 10 mg/ml oplossing voor injectie in een voorgevulde spuit
ranibizumab
Lees goed de hele bijsluiter voordat u dit geneesmiddel krijgt want er staat belangrijke informatie in voor u.
- Bewaar deze bijsluiter. Misschien heeft u hem later weer nodig.
- Heeft u nog vragen? Neem dan contact op met uw arts.
- Krijgt u last van een van de bijwerkingen die in rubriek 4 staan? Of krijgt u een bijwerking die niet in deze bijsluiter staat? Neem dan contact op met uw arts.
Inhoud van deze bijsluiter
1. WAT IS LUCENTIS EN WAARVOOR WORDT DIT MIDDEL GEBRUIKT?
Wat is Lucentis?
Lucentis is een oplossing die in het oog wordt geïnjecteerd. Lucentis behoort tot een groep geneesmiddelen, antineovasculariserende middelen genaamd. Het bevat de werkzame stof ranibizumab.
Waarvoor wordt Lucentis gebruikt?
Lucentis wordt gebruikt bij volwassenen om verschillende oogaandoeningen te behandelen die een verslechterd zicht veroorzaken.
Deze aandoeningen zijn het gevolg van een beschadiging van het netvlies (lichtgevoelige laag aan de achterkant van het oog) die veroorzaakt wordt door:
- Groei van lekkende, abnormale bloedvaten. Dit wordt waargenomen bij aandoeningen zoals leeftijdsgebonden maculadegeneratie (LMD) en proliferatieve diabetische retinopathie (PDR, een ziekte veroorzaakt door diabetes). Het kan ook geassocieerd zijn met choroïdale neovascularisatie (CNV) als gevolg van pathologische myopie (PM), angioïde strepen, centrale sereuze chorioretinopathie of inflammatoire CNV.
- Macula-oedeem (zwelling van het centrale deel van het netvlies). Deze zwelling kan veroorzaakt worden door diabetes (een ziekte genaamd diabetisch macula-oedeem, DME) of door een afsluiting van de retinale bloedvaten in het netvlies (een ziekte genaamd retinale veneuze occlusie, RVO).
Hoe werkt Lucentis?
Lucentis herkent en bindt specifiek aan een eiwit genaamd humane vasculaire endotheliale groeifactor A (VEGF-A) dat aanwezig is in het oog. Als er te veel van is, veroorzaakt VEGF-A abnormale groei van bloedvaten en zwelling in het oog, wat kan leiden tot verminderd zicht bij aandoeningen als LMD, DME, PDR, RVO, PM en CNV. Door te binden aan VEGF-A kan Lucentis de activiteit van het eiwit blokkeren en deze abnormale groei en zwelling voorkomen.
Bij deze aandoeningen kan Lucentis helpen uw zicht te stabiliseren, en in veel gevallen te verbeteren.
2. WANNEER MAG U DIT MIDDEL NIET TOEGEDIEND KRIJGEN OF MOET U ER EXTRA VOORZICHTIG MEE ZIJN?
Wanneer mag u dit middel niet toegediend krijgen?
- U bent allergisch voor een van de stoffen in dit geneesmiddel. Deze stoffen kunt u vinden in rubriek 6.
- U hebt een infectie in of rond het oog.
- U hebt pijn of roodheid (ernstige intraoculaire ontsteking) in uw oog.
Wanneer moet u extra voorzichtig zijn met dit middel?
Neem contact op met uw arts voordat u dit middel toegediend krijgt.
- Lucentis wordt gegeven als injectie in het oog. Af en toe kunnen een infectie aan het binnenste deel van het oog, pijn of roodheid (ontsteking), loslating of scheur in één van de lagen aan de achterkant van het oog (netvliesloslating of netvliesscheur en loslating of scheur van het pigmentepitheel van het netvlies) of troebel worden van de lens (cataract) optreden na de toediening van Lucentis. Het is belangrijk om zo’n infectie of netvliesloslating zo snel mogelijk op te sporen en te behandelen. Vertel daarom uw arts onmiddellijk als u de volgende klachten krijgt: oogpijn of toegenomen ongemak, verergering van de roodheid van het oog, wazig zien of verminderd gezichtsvermogen, een toegenomen aantal kleine deeltjes in uw zicht of toegenomen gevoeligheid voor licht.
- Bij sommige patiënten kan de oogdruk toenemen voor een korte periode direct na de injectie. Dit is iets wat u misschien niet opmerkt, en daarom zal uw arts dit controleren na elke injectie.
- Informeer uw arts als u een voorgeschiedenis heeft van oogaandoeningen of oogbehandelingen of als u een beroerte heeft gehad of voorbijgaande verschijnselen van een beroerte (zwakte of verlamming van ledematen of gezicht, moeite met praten of begrijpen) heeft ervaren. Er zal rekening worden gehouden met deze informatie bij het beoordelen of Lucentis een geschikte behandeling voor u is.
Raadpleeg rubriek 4 (“Mogelijke bijwerkingen”) voor meer gedetailleerde informatie over de bijwerkingen die kunnen optreden tijdens de behandeling met Lucentis.
Kinderen en jongeren tot 18 jaar
Het gebruik van Lucentis bij kinderen en jongeren is niet vastgesteld en wordt daarom niet aanbevolen.
Gebruikt u nog andere geneesmiddelen?
Gebruikt u naast Lucentis nog andere geneesmiddelen, heeft u dat kort geleden gedaan of bestaat de mogelijkheid dat u binnenkort andere geneesmiddelen gaat gebruiken? Vertel dat dan uw arts.
Zwangerschap en borstvoeding
- Vrouwen die zwanger kunnen worden, moeten een doeltreffende anticonceptiemethode gebruiken tijdens de behandeling en gedurende ten minste nog drie maanden na de laatste injectie met Lucentis.
- Er is geen ervaring met het gebruik van Lucentis bij zwangere vrouwen. Lucentis moet daarom niet gebruikt worden tijdens de zwangerschap tenzij de mogelijke voordelen opwegen tegen het potentiële risico voor het ongeboren kind. Bent u zwanger, denkt u zwanger te zijn of wilt u zwanger worden? Neem dan contact op met uw arts voordat u dit geneesmiddel toegediend krijgt.
- Kleine hoeveelheden Lucentis kunnen in de moedermelk terechtkomen. Borstvoeding geven tijdens het gebruik van Lucentis wordt daarom niet aanbevolen. Neem contact op met uw arts of apotheker voordat u dit geneesmiddel toegediend krijgt.
Rijvaardigheid en het gebruik van machines
Na de behandeling met Lucentis kunt u tijdelijk last hebben van wazig zicht. Als dit gebeurt, mag u niet autorijden en geen machines gebruiken totdat dit voorbij is.
3. HOE WORDT DIT MIDDEL TOEGEDIEND?
Lucentis wordt door uw oogarts toegediend als een enkele injectie in uw oog onder plaatselijke verdoving. De gebruikelijke dosis van een injectie is 0,05 ml (die 0,5 mg werkzame stof bevat). De voorgevulde spuit bevat meer dan de aanbevolen dosis van 0,5 mg. Het extraheerbare volume mag niet in zijn geheel worden gebruikt. Het overtollige volume moet worden verwijderd vóór injectie. Het injecteren van het gehele volume van de voorgevulde spuit kan leiden tot overdosering.
De periode tussen twee doseringen geïnjecteerd in hetzelfde oog, moet ten minste 4 weken zijn. Alle injecties worden toegediend door uw oogarts.
Vóór de injectie zal uw arts uw oog zorgvuldig wassen om infectie te voorkomen. Uw arts zal u ook een lokale verdoving geven om eventuele pijn van de injectie te verminderen of te voorkomen.
De behandeling wordt gestart met één injectie met Lucentis per maand. Uw arts zal uw oogaandoening controleren en, afhankelijk van hoe u op de behandeling reageert, besluiten of en wanneer u verdere behandeling nodig hebt.
Gedetailleerde instructies voor gebruik worden aan het einde van deze bijsluiter gegeven in de rubriek “Hoe moet Lucentis worden bereid en toegediend”.
Ouderen (65 jaar en ouder)
Lucentis kan bij mensen van 65 jaar en ouder zonder dosisaanpassingen worden gebruikt.
Als u stopt met de behandeling met dit middel
Als u overweegt om te stoppen met de behandeling met Lucentis, ga dan naar uw eerstvolgende afspraak en bespreek dit met uw arts. Uw arts zal u adviseren en beslissen hoelang u moet worden behandeld met Lucentis.
Heeft u nog andere vragen over het gebruik van dit geneesmiddel? Neem dan contact op met uw arts.
4. MOGELIJKE BIJWERKINGEN
Zoals elk geneesmiddel kan ook dit geneesmiddel bijwerkingen hebben, al krijgt niet iedereen daarmee te maken.
De bijwerkingen geassocieerd met de toediening van Lucentis zijn het gevolg van ofwel het geneesmiddel zelf of van de injectieprocedure en hebben meestal betrekking op het oog.
De meest ernstige bijwerkingen zijn onderstaand beschreven:
Vaak voorkomende ernstige bijwerkingen (komen voor bij minder dan 1 op de 10 gebruikers): loslating of scheur in de laag aan de achterkant van het oog (netvliesloslating of netvliesscheur), met als gevolg het zien van lichtflitsen met puntjes en vlekken voor de ogen, dat resulteert in tijdelijk verlies van het gezichtsvermogen, of het troebel worden van de lens (cataract).
Soms voorkomende ernstige bijwerkingen (komen voor bij minder dan 1 op de 100 gebruikers): blindheid, infectie van de oogbol (endoftalmitis) met ontsteking van het binnenste van het oog.
De klachten die u kunt krijgen zijn oogpijn of toegenomen ongemak aan uw oog, verergering van de roodheid van het oog, wazig of verminderd zicht, een toegenomen aantal kleine deeltjes in uw zicht of verhoogde gevoeligheid voor licht. Neem direct contact op met uw arts als u last krijgt van een van deze bijwerkingen.
De meest frequent gemelde bijwerkingen staan hieronder beschreven:
Zeer vaak voorkomende bijwerkingen (komen voor bij meer dan 1 op de 10 gebruikers):
Bijwerkingen aan de ogen omvatten: ontsteking van het oog, bloeding aan de achterkant van het oog (retinabloeding), verstoord gezichtsvermogen, oogpijn, het zien bewegen van puntjes en vlekken voor de ogen (mouches volantes), bloeddoorlopen oog, oogirritatie, het gevoel iets in het oog te hebben, verhoogde aanmaak van traanvocht, ontsteking of infectie van de ooglidranden, droog oog, roodheid van of jeuk aan het oog en verhoogde oogdruk.
Overige bijwerkingen omvatten: keelpijn, verstopte neus, loopneus, hoofdpijn en gewrichtspijn.
Andere bijwerkingen die kunnen voorkomen na Lucentis behandeling staan hieronder beschreven:
Vaak voorkomende bijwerkingen
Bijwerkingen aan de ogen omvatten: afgenomen scherpte van het zicht, zwelling van een deel van het oog (uvea, hoornvlies), ontsteking van het hoornvlies (het voorste deel van het oog), kleine vlekken op het oogoppervlak, wazig zicht, bloeding op de plaats van de injectie, bloeding in het oog, oogafscheiding met jeuk, roodheid en zwelling (conjunctivitis), gevoeligheid voor licht, onaangenaam gevoel in het oog, zwelling van het ooglid, ooglidpijn.
Overige bijwerkingen omvatten: urineweginfectie, laag aantal rode bloedcellen (met klachten als vermoeidheid, kortademigheid, duizeligheid, bleke huid), angst, hoest, misselijkheid, allergische reacties zoals huiduitslag, netelroos, jeuk en een rode huid.
Soms voorkomende bijwerkingen
Bijwerkingen aan de ogen omvatten: ontsteking en bloeding in de voorkant van het oog, ophoping van etter op het oog, veranderingen van het centrale deel van het oogoppervlak, pijn of irritatie op de injectieplaats, raar gevoel in het oog, irritatie van het ooglid.
Het melden van bijwerkingen
Krijgt u last van bijwerkingen, neem dan contact op met uw arts. Dit geldt ook voor mogelijke bijwerkingen die niet in deze bijsluiter staan. U kunt bijwerkingen ook rechtstreeks melden (zie details hieronder). Door bijwerkingen te melden, kunt u ons helpen meer informatie te verkrijgen over de veiligheid van dit geneesmiddel.
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
5. HOE BEWAART U DIT MIDDEL?
- Buiten het zicht en bereik van kinderen houden.
- Gebruik dit geneesmiddel niet meer na de uiterste houdbaarheidsdatum. Die vindt u op de doos en het etiket van de voorgevulde spuit na EXP. Daar staat een maand en een jaar. De laatste dag van die maand is de uiterste houdbaarheidsdatum.
- Bewaren in de koelkast (2°C – 8°C). Niet in de vriezer bewaren.
- Vóór gebruik mag het verzegelde bakje gedurende maximaal 24 uur op kamertemperatuur (25°C) worden bewaard.
- De voorgevulde spuit in het ongeopende bakje in de verpakking bewaren ter bescherming tegen licht.
- Gebruik geen verpakking die beschadigd is.
6. INHOUD VAN DE VERPAKKING EN OVERIGE INFORMATIE
Welke stoffen zitten er in dit middel?
- De werkzame stof in dit middel is ranibizumab. Elke ml bevat 10 mg ranibizumab. Eén voorgevulde spuit bevat 0,165 ml, equivalent aan 1,65 mg ranibizumab. Dit levert een bruikbare hoeveelheid om een enkele dosis toe te dienen van 0,05 ml die 0,5 mg ranibizumab bevat.
- De andere stoffen in dit middel zijn ,-trehalose dihydraat; histidine hydrochloride, monohydraat; histidine; polysorbaat 20; water voor injecties.
Hoe ziet Lucentis eruit en hoeveel zit er in een verpakking?
Lucentis is een oplossing voor injectie in een voorgevulde spuit. De voorgevulde spuit bevat 0,165 ml van een steriele, heldere, kleurloze tot lichtbruingele, waterige oplossing. De voorgevulde spuit bevat meer dan de aanbevolen dosis van 0,5 mg. Het extraheerbare volume van één voorgevulde spuit mag niet in zijn geheel worden gebruikt. Het overtollige volume moet worden verwijderd vóór injectie. Het injecteren van het gehele volume van de voorgevulde spuit kan leiden tot overdosering.
Verpakkingsgrootte van één voorgevulde spuit, verpakt in een verzegeld bakje. De voorgevulde spuit is uitsluitend voor eenmalig gebruik.
Houder van de vergunning voor het in de handel brengen
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Ierland
Fabrikant
Novartis Manufacturing NV
Rijksweg 14
2870 Puurs-Sint-Amands
België
Novartis Pharma GmbH
Sophie-Germain-Strasse 10
90443 Neurenberg
Duitsland
Neem voor alle informatie over dit geneesmiddel contact op met de lokale vertegenwoordiger van de houder van de vergunning voor het in de handel brengen:
België/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Deze bijsluiter is voor het laatst goedgekeurd in 12/2025
Andere informatiebronnen
Meer informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
De volgende informatie is alleen bestemd voor beroepsbeoefenaren in de gezondheidszorg:
Zie ook rubriek 3 “Hoe wordt dit middel toegediend?”.
Hoe moet Lucentis worden bereid en toegediend
Voorgevulde spuit voor eenmalig gebruik alleen voor intravitreaal gebruik.
Lucentis moet worden toegediend door een bevoegde oogarts die ervaring heeft met intravitreale injecties.
Bij natte LMD, bij CNV, bij PDR en bij visusverslechtering als gevolg van DME of van macula-oedeem secundair aan RVO is de aanbevolen dosis van Lucentis 0,5 mg, toegediend als een enkelvoudige intravitreale injectie. Dit komt overeen met een injectievolume van 0,05 ml. Het interval tussen twee doses geïnjecteerd in hetzelfde oog dient ten minste vier weken te zijn.
De behandeling wordt gestart met één injectie per maand totdat maximale gezichtsscherpte is bereikt en/of er geen verschijnselen van ziekteactiviteit zijn, dat wil zeggen geen verandering in de gezichtsscherpte en in andere verschijnselen en klachten van de aandoening bij voortgezette behandeling. Bij patiënten met natte LMD, DME, PDR en RVO kunnen initieel drie of meer opeenvolgende, maandelijkse injecties nodig zijn.
Daarna moeten de intervallen voor controle en behandeling worden bepaald door de arts op basis van de ziekteactiviteit, zoals bepaald door gezichtsscherpte en/of anatomische parameters.
Als volgens de arts uit visuele en anatomische parameters blijkt dat de patiënt geen voordeel heeft van voortgezette behandeling, dan moet Lucentis gestaakt worden.
Controle op ziekteactiviteit kan bestaan uit klinisch onderzoek, functionele testen of beeldvormingstechnieken (bijvoorbeeld optische coherentietomografie of fluorescentieangiografie).
Indien patiënten volgens een “treat-and-extend” regime worden behandeld, kunnen de behandelingsintervallen stapsgewijs worden verlengd, op het moment dat maximale gezichtsscherpte is bereikt en/of er geen verschijnselen van ziekteactiviteit zijn, totdat verschijnselen van ziekteactiviteit of visusverslechtering zich weer voordoen. Het behandelingsinterval dient met niet meer dan twee weken per keer te worden verlengd bij natte LMD en kan met maximaal één maand per keer worden verlengd bij DME. Bij PDR en RVO kunnen behandelingsintervallen ook geleidelijk aan worden verlengd. Er zijn echter onvoldoende gegevens om conclusies te trekken over de duur van deze intervallen. Als de ziekteactiviteit terugkeert, dient het behandelingsinterval overeenkomstig te worden ingekort.
De behandeling van visusverslechtering als gevolg van CNV moet individueel per patiënt bepaald worden gebaseerd op de ziekteactiviteit. Sommige patiënten hebben slechts één injectie nodig gedurende de eerste 12 maanden; andere patiënten kunnen frequentere behandeling nodig hebben, waaronder een maandelijkse injectie. Bij CNV secundair aan pathologische myopie (PM) hebben veel patiënten mogelijk slechts één of twee injecties nodig tijdens het eerste jaar.
Lucentis en laserfotocoagulatie bij DME en macula-oedeem secundair aan BRVO
Er is enige ervaring met de gelijktijdige toediening van Lucentis met laserfotocoagulatie. Wanneer ze op dezelfde dag worden gegeven, dient Lucentis ten minste 30 minuten na laserfotocoagulatie te worden toegediend. Lucentis kan worden toegediend aan patiënten die eerder laserfotocoagulatie hebben gekregen.
Lucentis en fotodynamische therapie met verteporfine bij CNV secundair aan PM
Er is geen ervaring met gelijktijdige toediening van Lucentis en verteporfine.
Lucentis moet vóór toediening worden gecontroleerd op stofdeeltjes en verkleuring.
De injectieprocedure moet worden uitgevoerd onder aseptische omstandigheden: dit impliceert een chirurgische desinfectie van de handen, het gebruik van steriele handschoenen, een steriel laken en een steriel ooglid-speculum (of equivalent) en de beschikbaarheid van steriele paracentese (indien nodig). De medische voorgeschiedenis van de patiënt voor overgevoeligheidsreacties moet zorgvuldig worden geëvalueerd voordat de intravitreale procedure wordt uitgevoerd. In overeenstemming met de lokale praktijk moeten geschikte anesthesie en een topisch breed-spectrum microbicide, om de perioculaire huid, het ooglid en het oculaire oppervlak te desinfecteren, worden toegediend voorafgaand aan de injectie.
De voorgevulde spuit is uitsluitend voor eenmalig gebruik. De voorgevulde spuit is steriel. Gebruik het product niet als de verpakking beschadigd is. De steriliteit van de voorgevulde spuit kan niet worden gegarandeerd tenzij het bakje verzegeld blijft. Gebruik de voorgevulde spuit niet als de oplossing verkleurd of troebel is of deeltjes bevat.
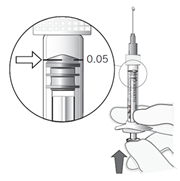
De voorgevulde spuit bevat meer dan de aanbevolen dosis van 0,5 mg. Het extraheerbare volume van één voorgevulde spuit (0,1 ml) mag niet in zijn geheel worden gebruikt. Het overtollige volume moet worden verwijderd vóór injectie. Het injecteren van het gehele volume van de voorgevulde spuit zou kunnen leiden tot overdosering. Druk de zuiger langzaam in totdat de rand onder de top van de rubber stop zich op één lijn bevindt met de zwarte doseringsstreep op de spuit (equivalent aan 0,05 ml, d.w.z. 0,5 mg ranibizumab) om de luchtbel samen met het teveel aan geneesmiddel te verwijderen.
Voor de intravitreale injectie moet een 30G x ½″ steriele injectienaald worden gebruikt.
Voor de bereiding van Lucentis voor intravitreale toediening, volg de instructies voor gebruik:
Introductie | Lees alle instructies zorgvuldig vóór het gebruik van de voorgevulde spuit. | |
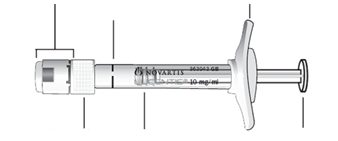
Beschrijving voorgevulde spuit |
| |
Voorbereiden | 1. Controleer of de verpakking het volgende bevat:
| |
Spuit controleren | 3. Controleer of:
|
|
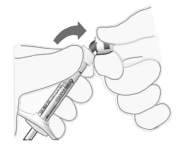
Spuitdop verwijderen | 5. Breek de spuitdop eraf (niet draaien of trekken; zie Figuur 2). |
|
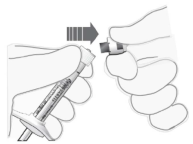
Naald bevestigen | 7. Bevestig een 30G x ½″ steriele injectienaald stevig op de spuit door deze strak op de Luer-Lock te draaien (zie Figuur 4). |
|
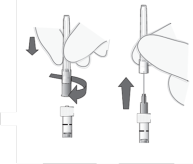
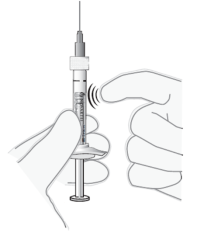
Luchtbellen verwijderen | 9. Houd de spuit rechtop. |
|
Dosis instellen | 11. Houd de spuit op ooghoogte en druk de zuiger voorzichtig in totdat de rand onder de top van de rubber stop zich op één lijn bevindt met de doseringsstreep (zie Figuur 7). Hierdoor zal de lucht en het teveel aan oplossing verwijderd worden en de dosis op 0,05 ml worden ingesteld. |
|
Injecteren | De injectieprocedure moet worden uitgevoerd onder aseptische omstandigheden. | |
PRIJZEN
| CNK code | Verpakking | Prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|
| 3120482 | LUCENTIS 1 VOORGEV SPUIT 0,165ML OPL INJ 10MG/ML | - | Ja | - | - |