SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Nustendi 180 mg/10 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke filmomhulde tablet bevat 180 mg bempedoïnezuur en 10 mg ezetimibe.
Hulpstof(fen) met bekend effect
Elke 180 mg/10 mg filmomhulde tablet bevat 71,6 mg lactose.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet.
Blauwe, ovale, filmomhulde tablet van ongeveer 15,00 × 7,00 × 5,00 mm, met de inscriptie “818” aan één kant en “ESP” aan de andere kant.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Hypercholesterolemie en gemengde dyslipidemie
Nustendi is geïndiceerd voor gebruik bij volwassenen met primaire hypercholesterolemie (heterozygoot familiair en niet-familiair) of gemengde dyslipidemie als aanvulling op een dieet:
- in combinatie met een statine bij patiënten die niet in staat zijn hun doelen voor ‘low-density lipoprotein’-cholesterol (LDL-C) te bereiken met de maximaal tolereerbare dosis van een statine in aanvulling op ezetimibe (zie rubriek 4.2, 4.3 en 4.4),
- alleen bij patiënten die statine-intolerant zijn of voor wie een statine gecontra-indiceerd is, en die niet in staat zijn de LDL-C-doelen met alleen ezetimibe te bereiken,
- bij patiënten die al worden behandeld met de combinatie van bempedoïnezuur en ezetimibe als afzonderlijke tabletten met of zonder statine.
Cardiovasculaire aandoeningen
Nustendi is geïndiceerd voor gebruik bij volwassenen met vastgestelde atherosclerotische cardiovasculaire aandoeningen of een hoog risico hierop, om het cardiovasculaire risico te verminderen door het LDL-C-gehalte te verlagen, als aanvulling op de correctie van andere risicofactoren:
- bij patiënten met een maximaal verdraagbare dosis van een statine bij wie geen adequate controle wordt verkregen met een aanvullende behandeling met ezetimibe of,
- bij patiënten die statine-intolerant zijn of voor wie een statine gecontra-indiceerd is, en bij wie geen adequate controle wordt verkregen met een behandeling met ezetimibe of,
- bij patiënten die al worden behandeld met de combinatie van bempedoïnezuur en ezetimibe als afzonderlijke tabletten.
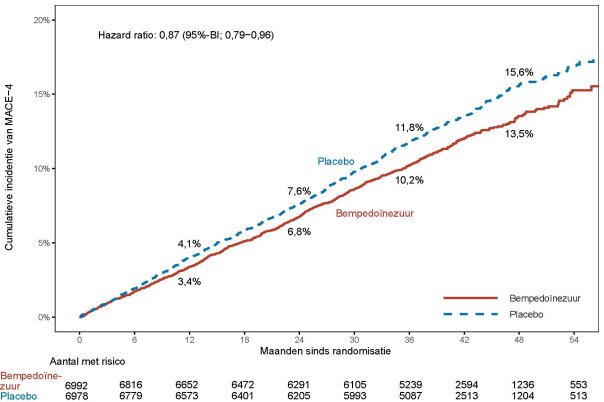
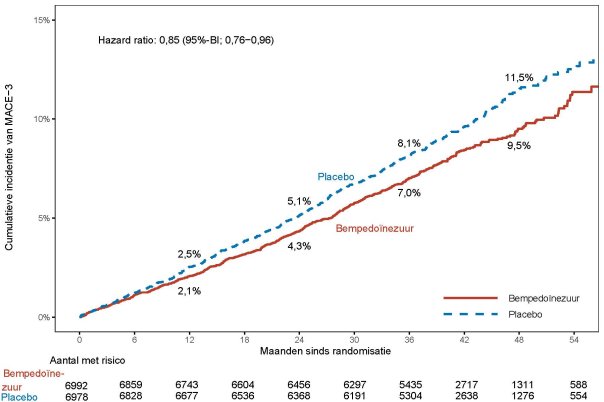
Zie rubriek 5.1 voor onderzoeksresultaten met betrekking tot de effecten op LDL-C, cardiovasculaire voorvallen en de onderzochte populaties.
4.2 Dosering en wijze van toediening
Dosering
De aanbevolen dosering van Nustendi is eenmaal daags één filmomhulde tablet van 180 mg/10 mg.
Gelijktijdige toediening van galzuurbindende middelen
Nustendi moet ten minste 2 uur vóór of ten minste 4 uur na toediening van een galzuurbindend middel worden toegediend.
Gelijktijdige simvastatinetherapie
Wanneer Nustendi samen met simvastatine wordt toegediend, moet de dosis simvastatine worden beperkt tot 20 mg per dag (of 40 mg per dag voor patiënten met ernstige hypercholesterolemie en een hoog risico op cardiovasculaire complicaties, die hun behandeldoel met een lagere dosis niet hebben bereikt en wanneer de voordelen naar verwachting opwegen tegen de potentiële risico’s) (zie rubriek 4.4 en 4.5).
Bijzondere populaties
Oudere patiënten
Bij oudere patiënten is geen dosisaanpassing nodig (zie rubriek 5.2).
Patiënten met een nierfunctiestoornis
Bij patiënten met een lichte of matige nierfunctiestoornis is geen dosisaanpassing nodig. Er zijn beperkte gegevens beschikbaar bij patiënten met een ernstige nierfunctiestoornis (gedefinieerd als geschatte glomerulaire filtratiesnelheid [eGFR] < 30 ml/min/1,73 m2), en patiënten met nieraandoeningen in het eindstadium (end-stage renal disease, ESRD) die dialyse ondergaan (zie rubriek 5.2). Extra monitoring van bijwerkingen kan bij deze patiënten gerechtvaardigd zijn wanneer Nustendi wordt toegediend (zie rubriek 4.4).
Patiënten met een leverfunctiestoornis
Bij patiënten met een lichte leverfunctiestoornis (Child-Pugh A) is geen dosisaanpassing nodig. Behandeling met Nustendi wordt niet aanbevolen bij patiënten met een matige (Child-Pugh B) of een ernstige (Child-Pugh C) leverfunctiestoornis wegens de onbekende effecten van de verhoogde blootstelling aan ezetimibe (zie rubriek 4.4).
Pediatrische patiënten
De veiligheid en werkzaamheid van Nustendi bij kinderen jonger dan 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Elke filmomhulde tablet moet oraal worden ingenomen met of zonder voedsel. De tablet moet in zijn geheel worden ingeslikt.
4.3 Contra-indicaties
- Overgevoeligheid voor de werkzame stoffen of voor een van de in rubriek 6.1 vermelde hulpstoffen.
- Zwangerschap (zie rubriek 4.6).
- Borstvoeding (zie rubriek 4.6).
- Gelijktijdig gebruik met simvastatine > 40 mg per dag (zie rubriek 4.2, 4.4 en 4.5).
- Gelijktijdige toediening van Nustendi met een statine is gecontra-indiceerd bij patiënten met een actieve leveraandoening of onverklaarde aanhoudende verhogingen in serumtransaminasewaarden.
- Wanneer Nustendi samen met een statine wordt toegediend, zie de samenvatting van de productkenmerken (SPC) voor die specifieke statinetherapie.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De vaakst gemelde bijwerkingen van Nustendi waren hyperurikemie (4,7%) en constipatie (4,7%).
In placebogecontroleerde fase III-onderzoeken naar primaire hyperlipidemie met bempedoïnezuur stopten meer patiënten met de behandeling met bempedoïnezuur vergeleken met placebo als gevolg van spierspasmen (0,7% versus 0,3%), diarree (0,5% versus < 0,1%), pijn in de extremiteiten (0,4% versus 0) en nausea (0,3% versus 0,2%), hoewel de verschillen tussen bempedoïnezuur en placebo niet significant waren.
Ernstige bijwerkingen die gemeld zijn bij ezetimibe waren myopathie, rabdomyolyse, hepatitis, overgevoeligheid, anafylaxie, angio-oedeem, erythema multiforme, cholelithiase, cholecystitis, pancreatitis en trombocytopenie.
Tabel met de lijst van bijwerkingen
De bijwerkingen die met Nustendi zijn gemeld, worden weergegeven volgens systeem/orgaanklasse en frequentie in tabel 1. Eventuele extra bijwerkingen die zijn gemeld met bempedoïnezuur (en die gebaseerd zijn op de incidentiecijfers van de fase III-onderzoeken naar primaire hyperlipidemie en de voor blootstelling gecorrigeerde incidentiecijfers van het onderzoek CLEAR Outcomes), of ezetimibe zijn ook weergegeven om een uitgebreider bijwerkingenprofiel voor Nustendi te kunnen bieden.
De frequenties worden gedefinieerd als: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1: Bijwerkingen (klinische studies en postmarketingervaring)
Systeem/orgaanklasse (SOC) | Bijwerkingen | Frequentiecategorieën |
Bijwerkingen met Nustendi | ||
Bloed- en lymfestelselaandoeningen | Anemie | Vaak |
Voedings- en stofwisselingsstoornissen | Hyperurikemiea | Vaak |
Verminderde eetlust | Vaak | |
Zenuwstelselaandoeningen | Duizeligheid | Vaak |
Bloedvataandoeningen | Hypertensie | Vaak |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Hoesten | Vaak |
Maagdarmstelselaandoeningen | Constipatie | Vaak |
Lever- en galaandoeningen | Leverfunctietest verhoogdb | Vaak |
Skeletspierstelsel- en bindweefselaandoeningen | Rugpijn | Vaak |
Nier- en urinewegaandoeningen | Bloed creatinine verhoogd | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Vermoeidheid | Vaak |
Extra bijwerkingen met bempedoïnezuur | ||
Voedings- en stofwisselingsstoornissen | Jicht | Vaak |
Gewicht verlaagdd | Soms | |
Lever- en galaandoeningen | Aspartaataminotransferase verhoogd | Vaak |
Alanineaminotransferase verhoogd | Soms | |
Nier- en urinewegaandoeningen | Glomerulaire filtratiesnelheid verlaagd | Vaak |
Bloedureum verhoogd | Soms | |
Extra bijwerkingen met ezetimibe | ||
Bloed- en lymfestelselaandoeningen | Trombocytopenie | Niet bekend |
Immuunsysteemaandoeningen | Overgevoeligheid, met inbegrip van rash, urticaria, anafylaxie en angio-oedeem | Niet bekend |
Psychische stoornissen | Depressie | Niet bekend |
Zenuwstelselaandoeningen | Paresthesiec | Niet bekend |
Bloedvataandoeningen | Opvlieger | Soms |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Dyspneu | Niet bekend |
Maagdarmstelselaandoeningen | Dyspepsie | Soms |
Pancreatitis | Niet bekend | |
Lever- en galaandoeningen | Aspartaataminotransferase verhoogd | Soms |
Hepatitis | Niet bekend | |
Huid- en onderhuidaandoeningen | Pruritusc | Soms |
Erythema multiforme | Niet bekend | |
Skeletspierstelsel- en bindweefselaandoeningen | Bloed creatinefosfokinase verhoogd | Vaak |
Nekpijn | Soms | |
Myopathie/rabdomyolyse | Niet bekend | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Pijn op de borst | Soms |
- Hyperurikemie omvat hyperurikemie en een verhoging van het urinezuur in het bloed
- Leverfunctietest verhoogd omvat leverfunctietest verhoogd en leverfunctietest abnormaal
- Bijwerkingen met ezetimibe toegediend met een statine
- (Onderzoek CLEAR Outcomes) Gewichtsafname werd alleen waargenomen bij patiënten met een body mass index (BMI) bij baseline ≥ 30 kg/m2, met een gemiddelde afname van het lichaamsgewicht van -2,28 kg gemeten in maand 36. De gemiddelde afname van het lichaamsgewicht was ≤ 0,5 kg bij patiënten met een baseline-BMI van 25 tot < 30 kg/m2. Bempedoïnezuur ging niet gepaard met een gemiddelde verandering in lichaamsgewicht bij patiënten met een baseline-BMI < 25 kg/m2
Beschrijving van geselecteerde bijwerkingen
Verhoogde concentratie urinezuur in het serum
Nustendi verhoogt het urinezuur in het serum, mogelijk als gevolg van remming van OAT2 in de niertubuli door bempedoïnezuur (zie rubriek 4.5). Een gemiddelde toename van 35,7 micromol/l (0,6 mg/dl) in urinezuur ten opzichte van baseline werd waargenomen met Nustendi in week 12. De verhogingen in serumurinezuur traden gewoonlijk binnen de eerste 4 weken van de behandeling op en keerden na stopzetting van de behandeling weer terug naar baseline. Er waren geen meldingen van jicht met Nustendi. In de fase III-onderzoeken naar primaire hyperlipidemie met bempedoïnezuur werd jicht gemeld bij 1,4% van de patiënten die werden behandeld met bempedoïnezuur en bij 0,4% van de patiënten die met placebo werden behandeld. In het onderzoek CLEAR Outcomes werd in maand 3 een gemiddelde toename van 47,6 micromol/l (0,8 mg/dl) in urinezuur waargenomen ten opzichte van baseline bij patiënten behandeld met bempedoïnezuur, en jicht werd ook vaker gemeld bij patiënten behandeld met bempedoïnezuur (3,1%) dan bij patiënten behandeld met placebo (2,1%). In beide behandelingsgroepen was de kans groter dat de patiënten die jicht meldden een medische voorgeschiedenis van jicht en/of een urinezuurgehalte boven de ULN bij baseline hadden (zie rubriek 4.4).
Effecten op serumcreatinine en bloedureumstikstof
Nustendi verhoogt het serumcreatinine en bloedureumstikstof (BUN). Een gemiddelde toename van 1,8 micromol/l (0,02 mg/dl) in serumcreatinine en een gemiddelde toename van 1,0 mmol/l (2,7 mg/dl) in BUN ten opzichte van baseline werden waargenomen met Nustendi in week 12. De verhogingen in serumcreatinine en BUN vonden gewoonlijk plaats in de eerste 4 weken van de behandeling, bleven stabiel en keerden na stopzetting van de behandeling weer terug naar baseline. Vergelijkbare gemiddelde toenames in serumcreatinine (5,8 micromol/l (0,066 mg/dl)) en in BUN (0,82 mmol/l (2,3 mg/dl)) werden waargenomen met bempedoïnezuur in het onderzoek CLEAR Outcomes.
De waargenomen verhogingen in serumcreatinine kunnen in verband worden gebracht met de door bempedoïnezuur veroorzaakte remming van de OAT2-afhankelijke creatininesecretie in de niertubuli (zie rubriek 4.5), een interactie tussen het geneesmiddel en een endogeen substraat, wat niet lijkt te wijzen op een verslechtering van de nierfunctie. Dit effect moet in aanmerking worden genomen bij het interpreteren van veranderingen in de geschatte creatinineklaring bij patiënten die behandeld worden met Nustendi, met name bij patiënten met medische aandoeningen of die geneesmiddelen ontvangen waarvoor controle van de geschatte creatinineklaring vereist is.
Verhoogde leverenzymwaarden
Bij 2,4% van de patiënten die met Nustendi werden behandeld, werden levertransaminase (ASAT en/of ALAT)-verhogingen van ≥ 3 × ULN gemeld in vergelijking met geen patiënten die placebo kregen. In vier fase III-onderzoeken naar primaire hyperlipidemie met bempedoïnezuur was de incidentie van verhogingen (≥ 3 × ULN) in levertransaminasespiegels (ASAT en/of ALAT) 0,7% voor patiënten die werden behandeld met bempedoïnezuur en 0,3% voor placebo. In gecontroleerde klinische combinatieonderzoeken met ezetimibe dat gelijktijdig met een statine werd geïnitieerd, was de incidentie van opeenvolgende verhogingen (≥ 3 × ULN) in levertransaminasespiegels 1,3% voor patiënten die met ezetimibe toegediend met statines werden behandeld, en 0,4% voor patiënten die alleen met statines werden behandeld. In het onderzoek CLEAR Outcomes kwam de incidentie van verhogingen > 3 × ULN in levertransaminasewaarden vaker voor bij patiënten behandeld met bempedoïnezuur (1,6%) dan bij patiënten behandeld met placebo (1,0%). De verhoogde transaminasewaarden met bempedoïnezuur of ezetimibe hielden geen verband met andere aanwijzingen voor leverfunctiestoornis (zie rubriek 4.4).
Verlaagde hemoglobineconcentratie
In de fase III-onderzoeken naar primaire hyperlipidemie met bempedoïnezuur werd een daling van de hemoglobineconcentratie ten opzichte van baseline van ≥ 20 g/l en < ondergrens van normaal (LLN) waargenomen bij 4,6% van de patiënten in de bempedoïnezuurgroep, vergeleken met 1,9% van de patiënten die placebo kregen toegediend. Dalingen in de hemoglobineconcentratie van meer dan 50 g/l en < LLN werden in vergelijkbare percentages gemeld in de bempedoïnezuur- en placebogroepen (respectievelijk 0,2% versus 0,2%). De dalingen in de hemoglobineconcentratie traden gewoonlijk op in de eerste 4 weken van de behandeling en keerden na stopzetting van de behandeling weer terug naar baseline. Van de patiënten met normale hemoglobinewaarden bij baseline kreeg 1,4% in de bempedoïnezuurgroep en 0,4% in de placebogroep hemoglobinewaarden lager dan LLN tijdens de behandeling. In de fase III-onderzoeken naar primaire hyperlipidemie werd bij 2,5% van de met bempedoïnezuur behandelde patiënten en 1,6% van de met placebo behandelde patiënten anemie gemeld. In het onderzoek CLEAR Outcomes werden vergelijkbare dalingen van de hemoglobineconcentratie waargenomen en werd anemie ook vaker gemeld bij patiënten behandeld met bempedoïnezuur (4,7%) ten opzichte van patiënten behandeld met placebo (3,9%).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via :
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
Luxemburg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Daiichi Sankyo Europe GmbH
Zielstattstrasse 48
81379 München
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/20/1424/001 - 011
10. DATUM VAN HERZIENING VAN DE TEKST
05/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4265120 | NUSTENDI 180MG/10MG FILMOMH TABL 28 | C10BA10 | € 76,75 | - | Ja | € 12,5 | € 8,3 |
| 4265138 | NUSTENDI 180MG/10MG FILMOMH TABL 98 | C10BA10 | € 241,86 | - | Ja | € 15,5 | € 10,2 |
| 4265146 | NUSTENDI 180MG/10MG FILMOMH TABL 50 X 1 | C10BA10 | € 136,97 | € 119,6 | Ja | - | - |