![]() Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
1. NAAM VAN HET GENEESMIDDEL
VYDURA 75 mg lyofilisaat voor oraal gebruik
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elk lyofilisaat voor oraal gebruik bevat rimegepantsulfaat, overeenkomend met 75 mg rimegepant.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Lyofilisaat voor oraal gebruik
Het lyofilisaat voor oraal gebruik is wit tot gebroken wit en rond, met een diameter van 14 mm en gegraveerd met het symbool ![]() .
.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
VYDURA is geïndiceerd voor de
- acute behandeling van migraine met of zonder aura bij volwassenen;
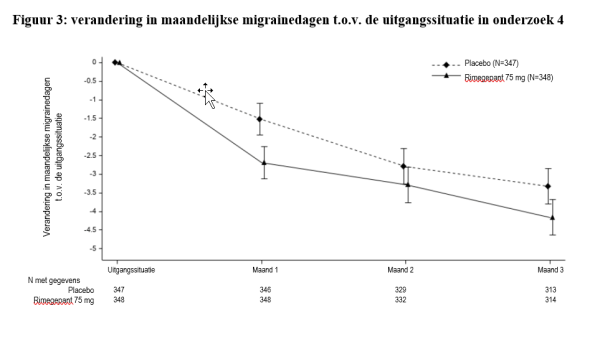
- preventieve behandeling van episodische migraine bij volwassenen die ten minste 4 migraineaanvallen per maand hebben.
4.2 Dosering en wijze van toediening
Dosering
Acute behandeling van migraine
De aanbevolen dosering is 75 mg rimegepant naar behoefte, eenmaal daags.
Profylaxe van migraine
De aanbevolen dosering is 75 mg rimegepant om de dag.
De maximale dagelijkse dosis is 75 mg rimegepant.
VYDURA kan met of zonder voedsel worden ingenomen.
Gelijktijdig gebruik van geneesmiddelen
Bij gelijktijdige toediening van matige remmers van CYP3A4 of van sterke remmers van P glycoproteïne moet de inname van een volgende dosis rimegepant binnen 48 uur worden vermeden (zie rubriek 4.5).
Speciale populaties
Ouderen (65 jaar en ouder)
Er is beperkte ervaring met rimegepant bij patiënten van 65 jaar of ouder. Er is geen dosisaanpassing vereist, aangezien de farmacokinetiek van rimegepant niet beïnvloed wordt door de leeftijd (zie rubriek 5.2).
Nierfunctiestoornis
Er is geen dosisaanpassing vereist bij patiënten met een lichte, matige of ernstige nierfunctiestoornis. Een ernstige nierfunctiestoornis resulteerde in een meer dan tweevoudige toename van de ongebonden AUC, maar een toename van minder dan 50% van de totale AUC (zie rubriek 5.2). Bij patiënten met een ernstige nierfunctiestoornis is voorzichtigheid geboden bij frequent gebruik. Rimegepant is niet onderzocht bij patiënten met eindstadium nierfalen en bij dialysepatiënten. Het gebruik van rimegepant moet worden vermeden bij patiënten met eindstadium nierfalen (CLcr < 15 ml/min).
Leverfunctiestoornis
Er is geen dosisaanpassing vereist bij patiënten met een lichte (Child‑Pugh A) of matige (Child‑Pugh B) leverfunctiestoornis. De plasmaconcentratie (ongebonden AUC) van rimegepant was significant hoger bij proefpersonen met een ernstige (Child‑Pugh C) leverfunctiestoornis (zie rubriek 5.2). Het gebruik van rimegepant moet worden vermeden bij patiënten met een ernstige leverfunctiestoornis.
Pediatrische patiënten
De veiligheid en werkzaamheid van VYDURA bij kinderen en adolescenten in de leeftijd tot 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
VYDURA is voor oraal gebruik.
Het lyofilisaat voor oraal gebruik moet op de tong of onder de tong worden geplaatst. Het valt uiteen in de mond en kan zonder vloeistof worden ingenomen.
Patiënten moet worden geadviseerd de blisterverpakking met droge handen te openen en moeten worden verwezen naar de bijsluiter voor volledige instructies.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
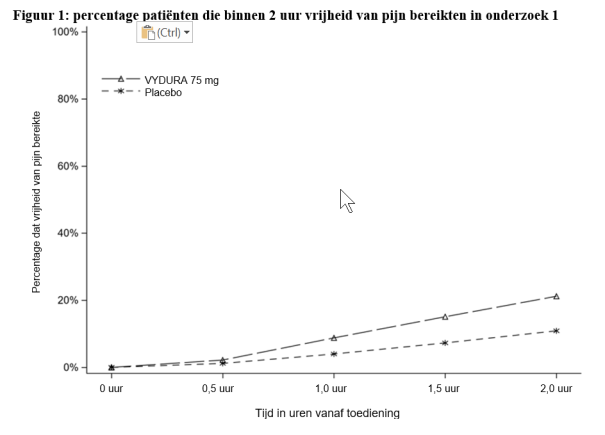
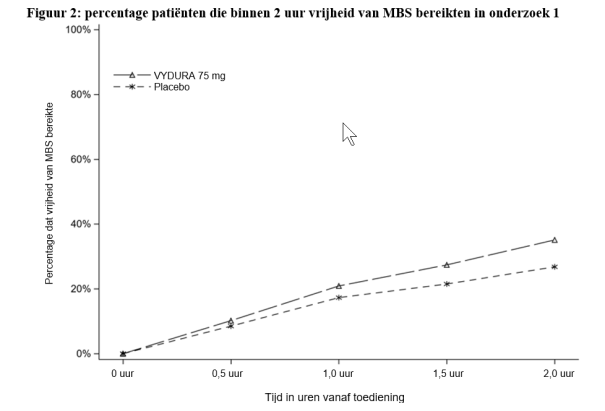
De vaakst voorkomende bijwerking was misselijkheid voor acute behandeling (1,2%) en voor profylaxe van migraine (1,4%). De meeste reacties waren licht of matig van ernst. Overgevoeligheid, waaronder dyspneu en ernstige rash, kwamen voor bij minder dan 1% van de behandelde patiënten.
Lijst van bijwerkingen in tabelvorm
De bijwerkingen zijn gerangschikt naar systeem/orgaanklasse volgens MedDRA in tabel 1. De overeenkomstige frequentiecategorie voor elke geneesmiddelreactie is gebaseerd op de volgende conventie (CIOMS III): zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1 000, < 1/100), zelden (≥ 1/10 000, < 1/1 000); zeer zelden (< 1/10 000).
Tabel 1 Lijst van bijwerkingen
Systeem/orgaanklasse | Bijwerking | Frequentie |
Acute behandeling | ||
Immuunsysteemaandoeningen | Overgevoeligheid, waaronder dyspneu en ernstige rash | Soms |
Maagdarmstelselaandoeningen | Misselijkheid | Vaak |
Profylaxe | ||
Maagdarmstelselaandoeningen | Misselijkheid | Vaak |
Veiligheid op lange termijn
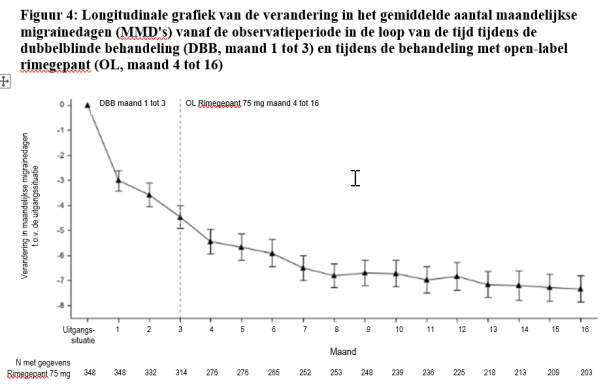
De veiligheid van rimegepant op lange termijn is beoordeeld in twee open‑label extensies van 1 jaar; 1 662 patiënten kregen rimegepant gedurende ten minste 6 maanden en 740 kregen rimegepant gedurende 12 maanden voor een acute of profylactische behandeling.
Beschrijving van geselecteerde bijwerkingen
Overgevoeligheidsreacties
Overgevoeligheid, waaronder dyspneu en ernstige rash, kwam voor bij minder dan 1% van de behandelde patiënten in klinische onderzoeken. Overgevoeligheidsreacties kunnen dagen na toediening optreden en vertraagde ernstige overgevoeligheid is opgetreden.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg worden verzocht alle vermoedelijke bijwerkingen te melden via het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be - Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Brussel
België
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/22/1645/001
EU/1/22/1645/002
EU/1/22/1645/003
10. DATUM VAN HERZIENING VAN DE TEKST
04/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
25D11
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4567848 | VYDURA 75 mg lyofilisaat voor oraal gebruik Verpakkingsgrootte: 2 x 1 geperforeerde eenheidsblisterverpakking met lyofilisaat voor oraal gebruik in een gevouwen kartonnen mapje. | € 65,32 | - | Ja | - | - | |
| 4567855 | VYDURA 75 mg lyofilisaat voor oraal gebruik Verpakkingsgrootte: 8 x 1 geperforeerde eenheidsblisterverpakking met lyofilisaat voor oraal gebruik | € 230,68 | - | Ja | - | - | |
| 4567863 | VYDURA 75 mg lyofilisaat voor oraal gebruik Verpakkingsgrootte: 16 x 1 geperforeerde eenheidsblisterverpakking met lyofilisaat voor oraal gebruik | € 451,16 | - | Ja | - | - |