1. NAAM VAN HET GENEESMIDDEL
Cosentyx 150 mg oplossing voor injectie in een voorgevulde spuit
Cosentyx 300 mg oplossing voor injectie in een voorgevulde spuit
Cosentyx 150 mg oplossing voor injectie in een voorgevulde pen
Cosentyx 300 mg oplossing voor injectie in een voorgevulde pen
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Cosentyx 150 mg oplossing voor injectie in een voorgevulde spuit
Elke voorgevulde spuit bevat 150 mg secukinumab in 1 ml.
Cosentyx 300 mg oplossing voor injectie in een voorgevulde spuit
Elke voorgevulde spuit bevat 300 mg secukinumab in 2 ml.
Cosentyx 150 mg oplossing voor injectie in een voorgevulde pen
Elke voorgevulde pen bevat 150 mg secukinumab in 1 ml.
Cosentyx 300 mg oplossing voor injectie in een voorgevulde pen
Elke voorgevulde pen bevat 300 mg secukinumab in 2 ml.
Secukinumab is een recombinant, volledig humaan, monoklonaal antilichaam geproduceerd in ovariumcellen van de Chinese hamster (Chinese Hamster Ovary, CHO).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie (injectievloeistof)
De oplossing is helder en kleurloos tot enigszins geel.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Plaque psoriasis bij volwassen patiënten
Cosentyx is geïndiceerd voor de behandeling van matige tot ernstige plaque psoriasis bij volwassenen die in aanmerking komen voor systemische therapie.
Plaque psoriasis bij pediatrische patiënten
Cosentyx is geïndiceerd voor de behandeling van matige tot ernstige plaque psoriasis bij kinderen en adolescenten vanaf 6 jaar die in aanmerking komen voor systemische therapie.
Hidradenitis suppurativa (HS)
Cosentyx is geïndiceerd voor de behandeling van actieve matige tot ernstige hidradenitis suppurativa (acne inversa) bij volwassenen met een inadequate respons op conventionele systemische HS-therapie (zie rubriek 5.1)
Arthritis psoriatica
Cosentyx, alleen of in combinatie met methotrexaat (MTX), is geïndiceerd voor de behandeling van actieve arthritis psoriatica bij volwassen patiënten die een inadequate respons vertoonden op eerdere behandeling met ‘disease‑modifying antirheumatic drugs’ (DMARD’s) (zie rubriek 5.1).
Axiale spondyloartritis (axSpA)
Spondylitis ankylopoetica (AS, röntgenologische axiale spondyloartritis)
Cosentyx is geïndiceerd voor de behandeling van actieve spondylitis ankylopoetica bij volwassenen bij wie de respons op conventionele behandeling inadequaat was.
Niet-röntgenologische axiale spondyloartritis (nr-axSpA)
Cosentyx is geïndiceerd voor de behandeling van actieve niet-röntgenologische axiale spondyloartritis met objectieve tekenen van ontsteking in de vorm van verhoogd C-reactief proteïne (CRP) en/of bewijs op Magnetic Resonance Imaging (MRI) bij volwassenen bij wie de respons op niet-steroïde anti-inflammatoire geneesmiddelen (NSAID’s) inadequaat was.
Juveniele idiopathische artritis (JIA)
Enthesitis‑gerelateerde artritis (ERA)
Cosentyx, alleen of in combinatie met methotrexaat (MTX), is geïndiceerd voor de behandeling van actieve enthesitis‑gerelateerde artritis bij patiënten van 6 jaar en ouder bij wie de ziekte onvoldoende heeft gereageerd op conventionele therapie of die de conventionele therapie niet kunnen verdragen (zie rubriek 5.1).
Juveniele arthritis psoriatica (JPsA)
Cosentyx, alleen of in combinatie met methotrexaat (MTX), is geïndiceerd voor de behandeling van actieve juveniele arthritis psoriatica bij patiënten van 6 jaar en ouder bij wie de ziekte onvoldoende heeft gereageerd op conventionele therapie of die de conventionele therapie niet kunnen verdragen (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Cosentyx is bedoeld voor gebruik onder begeleiding en toezicht van een arts met ervaring op het gebied van diagnostiek en behandeling van de aandoeningen waarvoor Cosentyx is geïndiceerd.
Dosering
Plaque psoriasis bij volwassen patiënten
De aanbevolen dosis is 300 mg secukinumab door middel van subcutane injectie met initiële toediening in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering. Op basis van klinische respons kan een onderhoudsdosering van 300 mg elke 2 weken mogelijk bijkomend voordeel bieden voor patiënten met een lichaamsgewicht van 90 kg of meer. Elke dosis van 300 mg wordt gegeven als één subcutane injectie van 300 mg of twee subcutane injecties van 150 mg.
Plaque psoriasis bij pediatrische patiënten (adolescenten en kinderen vanaf 6 jaar)
De aanbevolen dosis is gebaseerd op lichaamsgewicht (tabel 1) en wordt toegediend door middel van subcutane injectie met initiële toediening in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering. Elke dosis van 75 mg wordt gegeven als één subcutane injectie van 75 mg. Elke dosis van 150 mg wordt gegeven als één subcutane injectie van 150 mg. Elke dosis van 300 mg wordt gegeven als één subcutane injectie van 300 mg of twee subcutane injecties van 150 mg.
Tabel 1 Aanbevolen dosis voor plaque psoriasis bij pediatrische patiënten
Lichaamsgewicht op het moment van toediening | Aanbevolen dosis |
<25 kg | 75 mg |
25 tot <50 kg | 75 mg |
≥50 kg | 150 mg (*mag verhoogd worden tot 300 mg) |
*Sommige patiënten kunnen bijkomend voordeel hebben van de hogere dosis.
De 150 mg en 300 mg oplossing voor injectie in een voorgevulde spuit en een voorgevulde pen zijn niet geïndiceerd voor toediening aan pediatrische patiënten met een gewicht <50 kg. Cosentyx is mogelijk beschikbaar in andere sterktes en/of presentaties afhankelijk van de individuele behandelingsbehoeften.
Hidradenitis suppurativa (HS)
De aanbevolen dosis is 300 mg secukinumab door middel van subcutane injectie met initiële toediening in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering. Op basis van de klinische respons kan de onderhoudsdosering verhoogd worden naar 300 mg elke 2 weken. Elke dosis van 300 mg wordt gegeven als één subcutane injectie van 300 mg of twee subcutane injecties van 150 mg.
Arthritis psoriatica
Bij patiënten die tevens matige tot ernstige plaque psoriasis hebben, wordt verwezen naar de aanbeveling voor plaque psoriasis bij volwassen patiënten.
Bij patiënten die een inadequate respons vertonen op behandeling met anti-TNFα, is de aanbevolen dosis 300 mg door middel van subcutane injectie met initiële toediening in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering. Elke dosis van 300 mg wordt gegeven als één subcutane injectie van 300 mg of twee subcutane injecties van 150 mg.
Bij andere patiënten is de aanbevolen dosis 150 mg door middel van subcutane injectie met initiële toediening in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering. Op basis van klinische respons kan de dosering worden verhoogd naar 300 mg.
Axiale spondyloartritis (axSpA)
Spondylitis ankylopoetica (AS, röntgenologische axiale spondyloartritis)
De aanbevolen dosis is 150 mg door middel van subcutane injectie met initiële toediening in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering. Op basis van klinische respons kan de dosering worden verhoogd naar 300 mg. Elke dosis van 300 mg wordt gegeven als één subcutane injectie van 300 mg of twee subcutane injecties van 150 mg.
Niet-röntgenologische axiale spondyloartritis (nr-axSpA)
De aanbevolen dosis is 150 mg door middel van subcutane injectie met initiële toediening in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering.
Juveniele idiopathische artritis (JIA)
Enthesitis‑gerelateerde artritis (ERA) en juveniele arthritis psoriatica (JPsA)
De aanbevolen dosis is gebaseerd op het lichaamsgewicht (tabel 2) en wordt via subcutane injectie toegediend in week 0, 1, 2, 3 en 4, gevolgd door maandelijkse onderhoudsdosering. Elke dosis van 75 mg wordt gegeven als één subcutane injectie van 75 mg. Elke dosis van 150 mg wordt gegeven als één subcutane injectie van 150 mg.
Tabel 2 Aanbevolen dosis voor juveniele idiopathische artritis
Lichaamsgewicht op het moment van toediening | Aanbevolen dosis |
<50 kg | 75 mg |
≥50 kg | 150 mg |
De oplossingen voor injectie met 150 mg of 300 mg in een voorgevulde spuit of voorgevulde pen zijn niet geïndiceerd voor toediening aan pediatrische patiënten met een gewicht <50 kg. Cosentyx is mogelijk beschikbaar in andere sterktes en/of presentaties afhankelijk van de individuele behandelingsbehoeften.
Uit beschikbare gegevens blijkt dat een klinische respons bij alle bovenstaande indicaties doorgaans wordt bereikt binnen 16 weken behandeling. Men dient te overwegen de behandeling te staken bij patiënten die na 16 weken behandeling geen respons vertonen. Bij sommige patiënten met een aanvankelijk partiële respons kan vervolgens een verbetering optreden wanneer de behandeling langer dan 16 weken wordt voortgezet.
Speciale populaties
Oudere patiënten (65 jaar en ouder)
Er is geen dosisaanpassing vereist (zie rubriek 5.2).
Nierfunctiestoornis / leverfunctiestoornis
Cosentyx is niet in deze patiëntenpopulaties onderzocht. Er kan geen dosering worden aanbevolen.
Pediatrische patiënten
De veiligheid en werkzaamheid van Cosentyx bij kinderen jonger dan 6 jaar met plaque psoriasis en in twee categorieën van juveniele idiopathische artritis (JIA), ERA en JPsA, zijn niet vastgesteld.
De veiligheid en werkzaamheid van Cosentyx bij kinderen jonger dan 18 jaar voor andere indicaties zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Cosentyx moet worden toegediend door middel van subcutane injectie. Indien mogelijk moeten delen van de huid met psoriasis als injectieplaats worden vermeden. De spuit of de pen niet schudden.
Na voldoende training van de subcutane injectietechniek kunnen patiënten Cosentyx zelf injecteren of geïnjecteerd worden door een verzorger als een arts vaststelt dat de patiënt hiervoor in aanmerking komt. De arts moet echter zorgen voor een adequate follow-up van de patiënten. Patiënten of verzorgers moeten worden geïnstrueerd om de volledige hoeveelheid Cosentyx te injecteren volgens de instructies in de bijsluiter. De bijsluiter bevat uitgebreide instructies voor toediening.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Actieve infectie van klinische betekenis, bijv. actieve tuberculose (zie rubriek 4.4).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest gemelde bijwerkingen zijn bovensteluchtweginfecties (17,1%) (het meest nasofaryngitis, rinitis).
Bijwerkingen weergegeven in tabelvorm
Bijwerkingen uit klinische onderzoeken en tevens uit postmarketingmeldingen (tabel 3) staan vermeld volgens MedDRA systeem/orgaanklasse. Binnen elke systeem/orgaanklasse zijn de bijwerkingen gerangschikt aan de hand van de frequentie, met de meest voorkomende eerst. Binnen elke frequentiecategorie zijn de bijwerkingen weergegeven in volgorde van afnemende ernst. Daarnaast is de bijbehorende frequentiecategorie voor elke bijwerking gebaseerd op de volgende afspraak: zeer vaak (≥1/10); vaak (≥1/100, <1/10); soms (≥1/1.000, <1/100); zelden (≥1/10.000, <1/1.000); zeer zelden (<1/10.000); en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
In klinische geblindeerde en open-label onderzoeken met betrekking tot diverse indicaties (plaque psoriasis, arthritis psoriatica, axiale spondyloartritis, hidradenitis suppurativa en andere auto-immuunaandoeningen) zijn meer dan 20.000 patiënten behandeld met secukinumab; dit vertegenwoordigt 34.908 patiëntjaren aan blootstelling. Van deze patiënten werden er meer dan 14.000 ten minste één jaar aan secukinumab blootgesteld. Het veiligheidsprofiel van secukinumab is consistent binnen alle indicaties.
Tabel 3 Overzicht van bijwerkingen in klinische onderzoeken1) en postmarketingervaring
Systeem/orgaanklasse | Frequentie | Bijwerking |
Infecties en parasitaire aandoeningen | Zeer vaak | Bovensteluchtweginfecties |
Vaak | Orale herpes | |
Soms | Orale candidiasis | |
Otitis externa | ||
Ondersteluchtweginfecties | ||
Tinea pedis | ||
Niet bekend | Mucosale en cutane candidiasis (waaronder oesofageale candidiasis) | |
Bloed- en lymfestelselaandoeningen | Soms | Neutropenie |
Immuunsysteemaandoeningen | Zelden | Anafylactische reacties |
Angio-oedeem | ||
Zenuwstelselaandoeningen | Vaak | Hoofdpijn |
Oogaandoeningen | Soms | Conjunctivitis |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Vaak | Rinorroe |
Maagdarmstelselaandoeningen | Vaak | Diarree |
Misselijkheid | ||
Soms | Inflammatoire darmziekte | |
Huid- en onderhuidaandoeningen | Vaak | Eczeem |
Soms | Urticaria | |
Dyshidrotisch eczeem | ||
Zelden | Exfoliatieve dermatitis 2) | |
Overgevoeligheidsvasculitis | ||
Niet bekend | Pyoderma gangrenosum | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Vaak | Vermoeidheid |
1) Placebogecontroleerde klinische onderzoeken (fase III) bij patiënten met plaque psoriasis, PsA, AS, nr-axSpA en HS die werden blootgesteld aan 300 mg, 150 mg, 75 mg of placebo gedurende maximaal 12 weken (psoriasis) of 16 weken (PsA, AS, nr-axSpA en HS) behandeling. | ||
Beschrijving van geselecteerde bijwerkingen
Infecties
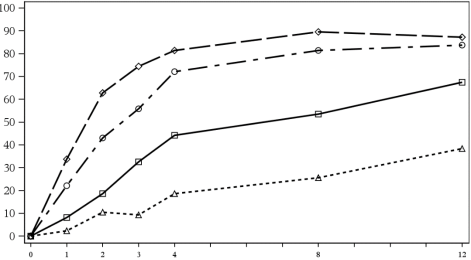
In de placebogecontroleerde periode van klinische onderzoeken naar plaque psoriasis (in totaal werden 1.382 patiënten behandeld met secukinumab en 694 patiënten behandeld met placebo gedurende maximaal 12 weken) werden bij 28,7% van de met secukinumab behandelde patiënten infecties gemeld, vergeleken met 18,9% van de met placebo behandelde patiënten. De meeste infecties waren niet-ernstige bovensteluchtweginfecties en licht tot matig van aard, zoals nasofaryngitis, waardoor het staken van de behandeling niet noodzakelijk was. Er was een toename van mucosale of cutane candidiasis, overeenkomend met het werkingsmechanisme, maar de gevallen waren licht of matig van aard, niet-ernstig, reageerden op standaardbehandeling en vereisten geen stopzetting van de behandeling. Ernstige infecties deden zich voor bij 0,14% van de met secukinumab behandelde patiënten en bij 0,3% van de met placebo behandelde patiënten (zie rubriek 4.4).
Gedurende de gehele behandelperiode (in totaal werden 3.430 patiënten behandeld met secukinumab gedurende maximaal 52 weken voor de meeste patiënten) werden infecties gemeld bij 47,5% van de met secukinumab behandelde patiënten (0,9 per patiëntjaar van follow-up). Ernstige infecties werden gemeld bij 1,2% van de met secukinumab behandelde patiënten (0,015 per patiëntjaar van follow-up).
De infectiepercentages die werden waargenomen in klinische onderzoeken naar arthritis psoriatica en axiale spondyloartritis (spondylitis ankylopoetica en niet-röntgenologische axiale spondyloartritis) waren vergelijkbaar met die waargenomen in de onderzoeken naar psoriasis.
Patiënten met hidradenitis suppurativa zijn gevoeliger voor infecties. In de placebogecontroleerde periode van klinische onderzoeken bij hidradenitis suppurativa (in totaal 721 patiënten behandeld met secukinumab en 363 patiënten behandeld met placebo gedurende maximaal 16 weken) waren de infecties numeriek hoger dan de infecties die werden waargenomen in de psoriasisonderzoeken (30,7% van de patiënten behandeld met secukinumab in vergelijking met 31,7% bij patiënten behandeld met placebo). De meeste gevallen waren niet ernstig, licht of matig ernstig en vereisten geen onderbreking of stopzetting van de behandeling.
Neutropenie
In klinische fase III-onderzoeken naar psoriasis werd neutropenie met secukinumab vaker waargenomen dan met placebo, maar de meeste gevallen waren licht, tijdelijk en reversibel van aard. Neutropenie <1,0‑0,5x109/l (CTCAE graad 3) werd gemeld bij 18 van de 3.430 patiënten (0,5%) die werden behandeld met secukinumab, waarbij in 15 van de 18 gevallen geen sprake was van dosisafhankelijkheid en een tijdsgebonden verband met infecties. Er zijn geen gevallen van ernstiger neutropenie gemeld. In de overige 3 gevallen werden niet‑ernstige infecties gemeld, met een normale respons op standaardzorg, die geen stopzetting van de behandeling met secukinumab vereisten.
De frequentie van neutropenie bij arthritis psoriatica, axiale spondyloartritis (spondylitis ankylopoetica en niet-röntgenologische axiale spondyloartritis) en hidradenitis suppurativa was vergelijkbaar met die bij psoriasis.
Zeldzame gevallen van neutropenie <0,5x109/l (CTCAE graad 4) werden gemeld.
Immunogeniciteit
In klinische onderzoeken naar psoriasis, arthritis psoriatica, axiale spondyloartritis (spondylitis ankylopoetica en niet-röntgenologische axiale spondyloartritis) en hidradenitis suppurativa ontwikkelde minder dan 1% van de met secukinumab behandelde patiënten antilichamen tegen secukinumab bij maximaal 52 weken behandeling. Ongeveer de helft van de tijdens de behandeling gevormde antilichamen tegen het geneesmiddel waren neutraliserende antilichamen, maar dit ging niet gepaard met verlies van werkzaamheid of met farmacokinetische afwijkingen.
Pediatrische patiënten
Bijwerkingen bij pediatrische patiënten met plaque psoriasis vanaf 6 jaar
De veiligheid van secukinumab werd beoordeeld in twee fase III-onderzoeken bij pediatrische patiënten met plaque psoriasis. Het eerste onderzoek (pediatrisch onderzoek 1) was een dubbelblind, placebo-gecontroleerd onderzoek met 162 patiënten van 6 jaar tot 18 jaar met ernstige plaque psoriasis. Het tweede onderzoek (pediatrisch onderzoek 2) was een open-label onderzoek met 84 patiënten van 6 jaar tot 18 jaar met matige tot ernstige plaque psoriasis. Het veiligheidsprofiel in beide onderzoeken was consistent met het veiligheidsprofiel gemeld bij volwassen patiënten met plaque psoriasis.
Bijwerkingen bij pediatrische patiënten met JIA
De veiligheid van secukinumab werd ook beoordeeld in een fase III-onderzoek bij 86 JIA-patiënten met ERA en JPsA van 2 tot <18 jaar oud. Het veiligheidsprofiel dat in dit onderzoek werd gerapporteerd, kwam overeen met het veiligheidsprofiel dat bij volwassen patiënten werd gerapporteerd.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Ierland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Cosentyx 150 mg oplossing voor injectie in een voorgevulde spuit
EU/1/14/980/002
EU/1/14/980/003
EU/1/14/980/006
Cosentyx 300 mg oplossing voor injectie in een voorgevulde spuit
EU/1/14/980/008-009
Cosentyx 150 mg oplossing voor injectie in een voorgevulde pen
EU/1/14/980/004
EU/1/14/980/005
EU/1/14/980/007
Cosentyx 300 mg oplossing voor injectie in een voorgevulde pen
EU/1/14/980/010-011
10. DATUM VAN HERZIENING VAN DE TEKST
13.02.2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4285482 | COSENTYX 300MG/2ML OPL INJ VOORGEV.PEN 1 150MG/ML | L04AC10 | € 998,36 | - | Ja | € 12,5 | € 8,3 |