SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
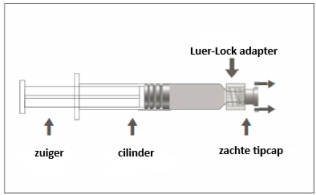
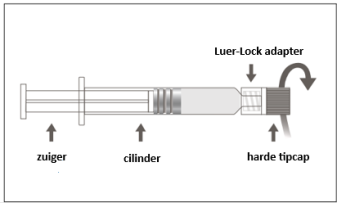
Triaxis, suspensie voor injectie in een voorgevulde spuit.
Difterie, tetanus, kinkhoest (acellulaire component) Vaccin (geadsorbeerde, gereduceerde antigen(en)inhoud)
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
1 dosis (0,5 ml) bevat:
Difterieanatoxine minimum 2 IE* (2 Lf)
Tetanusanatoxine minimum 20 IE* (5 Lf)
Kinkhoestantigenen:
Kinkhoestanatoxine 2,5 microgram
Filamenteus hemagglutinine 5 microgram
Pertactine 3 microgram
Fimbriale agglutinogenen Types 2 en 3 5 microgram
Geadsorbeerd op aluminiumfosfaat 1,5 mg (0,33 mg Al3+)
* Als onderste betrouwbaarheidsgrens (p = 0,95) van de activiteit, gemeten volgens de methode beschreven in de Europese Farmacopee.
Dit vaccin kan sporen van formaldehyde en glutaraldehyde bevatten die worden gebruikt tijdens het productieproces (zie rubrieken 4.3 en 4.4).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Suspensie voor injectie in een voorgevulde spuit.
Triaxis ziet eruit als een troebele witte vloeistof.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Triaxis (Tdap) is aangewezen voor:
Actieve immunisatie tegen tetanus, difterie en kinkhoest bij personen vanaf de leeftijd van 4 jaar als booster na een primaire immunisatie.
Passieve bescherming tegen klinkhoest bij de jonge zuigelingen na immunisatie van de moeder tijdens de zwangerschap (zie rubrieken 4.2, 4.6 en 5.1).
Het gebruik van Triaxis dient te gebeuren op basis van officiële aanbevelingen.
4.2 Dosering en wijze van toediening
Dosering
Een eenmalige injectie van één (0,5 ml) dosis is aanbevolen bij alle geïndiceerde leeftijdsgroepen.
Bij adolescenten en volwassenen met een onbekende of onvolledige difterie- of tetanusvaccinatiestatus kan een enkele dosis Triaxis worden toegediend als onderdeel van een vaccinatiereeks die tot doel heeft bescherming te bieden tegen pertussis en in de meeste gevallen ook tegen tetanus en difterie. Een extra dosis van een difterie- en tetanus (dT)-bevattend vaccin kan een maand later worden toegediend, gevolgd door een 3de dosis van difterie- of dT-bevattend vaccin 6 maanden na de eerste dosis om de bescherming tegen de ziekte te optimaliseren (zie rubriek 5.1). Het aantal dosissen en de toedieningsmomenten voor inhaalvaccinatie dienen te worden vastgesteld op basis van de plaatselijke aanbevelingen.
Triaxis kan worden gebruikt voor herhaaldelijke vaccinatie, voor het toenemen van de immuniteit tegen difterie, tetanus en kinkhoest met een interval van 5 tot 10 jaar (zie rubriek 5.1).
Triaxis kan worden gebruikt in de behandeling van verwondingen waarbij een risico op tetanus bestaat, met of zonder gelijktijdige toediening van tetanusimmunoglobuline, volgens de officiële aanbevelingen.
Triaxis kan tijdens het tweede of derde trimester aan zwangere vrouwen worden toegediend om een passieve bescherming van zuigelingen tegen klinkhoest aan te bieden (zie rubrieken 4.1,4.6 en 5.1).
Wijze van toediening
Een eenmalige injectie van één dosis (0,5 ml) Triaxis moet intramusculair worden toegediend. De plaats die de voorkeur wegdraagt is de deltoïde spier.
Triaxis mag niet worden toegediend in de gluteale streek; intradermale of subcutane routes mogen niet worden gebruikt (in uitzonderlijke gevallen kan de subcutane route worden overwogen, zie rubriek 4.4.).
Voorzorgen die vóór het hanteren of toedienen van het geneesmiddel dienen te worden genomen
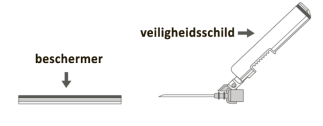
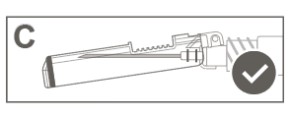
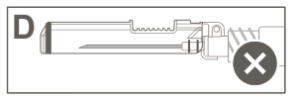
Voor instructies met betrekking tot het hanteren van het geneesmiddel voorafgaand aan de toediening, zie rubriek 6.6
4.3 Contra-indicaties
Triaxis mag niet worden toegediend aan personen met gekende overgevoeligheid
- voor vaccins tegen difterie, tetanus of kinkhoest
- voor elk ander bestanddeel van het vaccin (zie rubriek 6.1)
- voor eventuele residuele productiebestanddelen (formaldehyde en glutaraldehyde), die als niet-detecteerbare sporen kunnen aanwezig zijn.
Triaxis mag niet worden toegediend aan personen die een encefalopathie van onbekende oorsprong hebben doorgemaakt binnen de 7 dagen na een vorige vaccinatie met een kinkhoest bevattend vaccin.
Zoals bij andere vaccins moet de vaccinatie met Triaxis worden uitgesteld in geval van acute ernstige febriele ziekte. Een milde infectie is geen reden om de vaccinatie uit te stellen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
In klinische onderzoeken werd Triaxis in totaal aan 4.546 personen, onder wie 298 kinderen, (4 t/m 6 jaar), 1.313 adolescenten (11 t/m 17 jaar) en 2.935 volwassenen (18 t/m 64 jaar) toegediend. De meest voorkomende reacties na de vaccinatie gingen om plaatselijke reacties op de injectieplaats (pijn, roodheid en zwelling) die voorkwamen bij 21 – 78% van de gevaccineerde personen, hoofdpijn en vermoeidheid die voorkwamen bij 16 - 44% van de gevaccineerde personen. Deze tekenen en symptomen waren meestal beperkt qua intensiteit en traden op binnen de 48 uren na de vaccinatie. Ze verdwenen allen zonder complicaties.
De veiligheidsanalyse van gelijktijdig gebruik van Triaxis of Triaxis Polio toegediend met MenACYW (Menactra of MenQuadfi) en/of HPV (Gardasil of Gardasil 9) vaccins omvatte 5.122 gezonde mannelijke en vrouwelijke proefpersonen in de leeftijd van 10 t/m17 jaar uit 6 klinische onderzoeken.
Het algemene veiligheidsprofiel van Triaxis of Triaxis Polio was vergelijkbaar wanneer alle drie de vaccins gelijktijdig werden toegediend in vergelijking met gelijktijdig toegediende paren (Triaxis en Menactra of Triaxis/Triaxis Polio en Gardasil/Gardasil 9). Het veiligheidsprofiel van gelijktijdig toegediend Triaxis Polio en Gardasil/Gardasil 9 was vergelijkbaar met Gardasil/Gardasil 9 alleen toegediend.
In klinische onderzoeken werden reacties op de injectieplaats (pijn, erytheem, zwelling en kneuzing), evenals hoofdpijn, malaise en myalgie vaker waargenomen wanneer alle drie de vaccins samen of in paren werden toegediend, in vergelijking met wanneer ze alleen werden toegediend. Over het algemeen waren de waargenomen verschillen in reacties op de injectieplaats < 10%, terwijl de verschillen in hoofdpijn, malaise en myalgie varieerden van < 10% tot < 28%. Het verschil in koorts percentages in de klinische onderzoeken was < 2%.
De meerderheid van de bijwerkingen werd gerapporteerd als mild tot matig in intensiteit.
Tabelvormige lijst van bijwerkingen
Bijwerkingen worden ingedeeld volgens frequentie aan de hand van de volgende conventie:
Zeer vaak (≥ 1/10)
Vaak (≥ 1/100, < 1/10)
Soms (≥ 1/1.000, < 1/100)
Zelden (≥ 1/10.000, < 1/1.000)
Zeer zelden (< 1/10.000)
Niet bekend (kan met de beschikbare gegevens niet worden bepaald)
Tabel 1 presenteert de bijwerkingen die werden waargenomen in klinische onderzoeken, alsmede bijwerkingen die spontaan werden gemeld tijdens het postmarketinggebruik van Triaxis wereldwijd. Omdat de postmarketing bijwerkingen vrijwillig worden gemeld vanuit een populatie van onduidelijke omvang, is het niet altijd mogelijk om op betrouwbare wijze de frequentie hiervan te bepalen of een causaal verband met de blootstelling aan het vaccin vast te stellen. Daarom is de frequentie categorie 'Niet bekend' toegewezen aan deze bijwerkingen.
Tabel 1: Bijwerkingen uit klinische onderzoeken en postmarketinggebruik wereldwijd
Systeem/Orgaanklasse | Frequentie | Kinderen | Adolescenten | Volwassenen | ||
Immuunsysteem-aandoeningen | Niet bekend | Overgevoeligheidsreactie (anafylactisch) (angio-oedeem, oedeem, huiduitslag, hypotensie)* | ||||
Voedings- en stofwisselingsstoornissen | Zeer vaak | Anorexia (verminderde eetlust) |
| |||
Zenuwstelsel-aandoeningen | Zeer vaak | Hoofdpijn | ||||
Niet bekend | Paresthesie*, hypo-esthesie*, Guillain-Barré-syndroom*, brachiale neuritis*, facialisparalyse*, convulsies*, syncope*, myelitis* | |||||
Hartaandoeningen | Niet bekend | Myocarditis* | ||||
Maagdarmstelsel-aandoeningen | Zeer vaak | Diarree | Diarree, misselijkheid | Diarree | ||
Vaak | Misselijkheid, | Braken | Misselijkheid, braken | |||
Huid- en onderhuidaandoeningen | Vaak | Huiduitslag | ||||
Niet bekend | Pruritus*, urticaria* | |||||
Skeletspierstelsel- en bindweefselaandoeningen | Zeer vaak |
| Algemene pijn of spierzwakte, artralgie of zwelling van de gewrichten | Algemene pijn of spierzwakte | ||
Vaak | Algemene pijn of spierzwakte, artralgie of zwelling van de gewrichten |
| Artralgie of zwelling van de gewrichten | |||
Niet bekend | Myositis* | |||||
Algemene aandoeningen en toedieningsplaatsstoornissen | Zeer vaak | Vermoeidheid/asthenie | Vermoeidheid/asthenie, malaise, rillingen | Vermoeidheid/asthenie, malaise | ||
Pijn op de injectieplaats, erytheem op de injectieplaats, zwelling op de injectieplaats | ||||||
Vaak | Pyrexie, axillaire adenopathie | Pyrexie, axillaire adenopathie | Pyrexie, rillingen, axillaire adenopathie | |||
Niet bekend | Kneuzing op de injectieplaats*, steriel abces op de injectieplaats*, knobbeltje op de injectieplaats* | |||||
* Postmarketingbijwerkingen
Beschrijving van geselecteerde bijwerkingen
Algemene aandoeningen en toedieningsplaatsstoornissen
Grote reacties op de injectieplaats (>50 mm), waaronder uitgebreide zwelling van een van de ledematen vanaf de injectieplaats tot voorbij een of beide gewrichten, treden op na toediening van Triaxis bij adolescenten en volwassenen. Deze reacties beginnen gewoonlijk 24-72 uur na vaccinatie, kunnen gepaard gaan met erytheem, warmte, gevoeligheid of pijn op de injectieplaats en verdwijnen spontaan binnen 3-5 dagen.
Pediatrische patiënten
Het veiligheidsprofiel van Triaxis, zoals gepresenteerd in Tabel 1, omvat gegevens uit een klinisch onderzoek bij 298 kinderen in de leeftijd van 4 t/m 6 jaar, die eerder in totaal 4 doses hadden gekregen, waaronder primaire immunisatie, met DTaP-IPV in combinatie met Hib, op de leeftijd van circa 2, 4, 6 en 18 maanden. In dit klinische onderzoek waren de bijwerkingen die het meest werden gemeld binnen 14 dagen na vaccinatie, pijn op de injectieplaats (bij 39,6% van de personen) en vermoeidheid (bij 31,5% van de personen).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België: Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten: www.fagg.be – Afdeling Vigilantie: Website: www.eenbijwerkingmelden.be – e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Sanofi Winthrop Industrie
82 Avenue Raspail
94250 Gentilly, Frankrijk
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE502222
10. DATUM VAN HERZIENING VAN DE TEKST
Datum van goedkeuring van de tekst: 11/2025.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3707767 | TRIAXIS VOORGEV SPUIT 2 NAALD AANGEH 1DOSE=0,5 ML | J07AJ52 | € 33,77 | - | Ja | - | - |