SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
AJOVY 225 mg oplossing voor injectie in een voorgevulde spuit
AJOVY 225 mg oplossing voor injectie in een voorgevulde pen
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Voorgevulde spuit
Eén voorgevulde spuit bevat 225 mg fremanezumab.
Voorgevulde pen
Eén voorgevulde pen bevat 225 mg fremanezumab.
Fremanezumab is een gehumaniseerd monoklonaal antilichaam dat geproduceerd is in ovariumcellen van Chinese hamsters (CHO-cellen) met behulp van recombinant-DNA-technieken.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie (injectievloeistof)
Heldere tot opaalachtige, kleurloze tot enigszins gele oplossing met een pH van 5,5 en een osmolaliteit van 320‑420 mOsm/kg.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
AJOVY is geïndiceerd voor de profylaxe van migraine bij volwassenen die ten minste 4 migrainedagen per maand hebben.
4.2 Dosering en wijze van toediening
De behandeling dient te worden gestart door een arts met ervaring in de diagnosticering en behandeling van migraine.
Dosering
Er zijn twee doseringsopties beschikbaar:
- 225 mg eenmaal per maand (maandelijkse dosering) of
- 675 mg eenmaal per drie maanden (driemaandelijkse dosering)
Wanneer van doseringsschema wordt gewisseld, dient de eerste dosis van het nieuwe schema te worden toegediend op de volgende geplande toedieningsdatum van het voorgaande schema.
Wanneer de behandeling met fremanezumab wordt gestart, kan gelijktijdige preventieve behandeling tegen migraine worden voortgezet, als de voorschrijver dat nodig acht (zie rubriek 5.1).
Binnen 3 maanden na het starten van de behandeling moet worden vastgesteld of de behandeling voordeel oplevert. Alle verdere beslissingen over het voortzetten van de behandeling dienen per individuele patiënt te worden genomen. Het wordt aanbevolen daarna regelmatig te evalueren of het nodig is de behandeling voort te zetten.
Gemiste dosis
Als een injectie met fremanezumab op de geplande dag wordt gemist, dient de toediening zo snel mogelijk te worden hervat met de geïndiceerde dosis en volgens het geïndiceerde doseringsschema. Er mag geen dubbele dosis worden toegediend om een gemiste dosis in te halen.
Speciale patiëntengroepen
Ouderen
Er zijn beperkte gegevens beschikbaar over het gebruik van fremanezumab bij patiënten ≥ 65 jaar. Gebaseerd op de resultaten van farmacokinetische populatieanalyse is er geen dosisaanpassing nodig (zie rubriek 5.2).
Nier- of leverfunctiestoornissen
Er is geen dosisaanpassing nodig voor patiënten met een lichte tot matig ernstige nierfunctiestoornis of leverfunctiestoornis (zie rubriek 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van AJOVY bij kinderen en adolescenten in de leeftijd tot 18 jaar zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Subcutaan gebruik.
AJOVY is uitsluitend bedoeld voor subcutane injectie. AJOVY kan worden geïnjecteerd in gebieden van de buik, dij of bovenarm die niet gevoelig, rood of verhard zijn en waar geen bloeduitstortingen zijn. Bij meerdere injecties moeten de injectieplaatsen worden afgewisseld.
Patiënten mogen zichzelf injecteren nadat zij instructie in subcutane zelfinjectietechniek hebben gekregen van een beroepsbeoefenaar in de gezondheidszorg. Zie voor verdere instructies voor de toediening rubriek 6.6.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
In totaal werden meer dan 2.500 patiënten (meer dan 1.900 patiëntjaren) in registratieonderzoeken behandeld met AJOVY. Meer dan 1.400 patiënten werden gedurende ten minste 12 maanden behandeld.
Vaak gemelde bijwerkingen waren lokale reacties op de injectieplaats (pijn [24%], induratie 17%, erytheem 16% en pruritus 2%).
Lijst van bijwerkingen in tabelvorm
Bijwerkingen in klinische onderzoeken en postmarketingmeldingen worden weergegeven per systeem/orgaanklasse volgens gegevensbank MedDRA. Binnen iedere frequentiegroep zijn de bijwerkingen gerangschikt naar afnemende ernst. De frequentiegroepen worden als volgt gedefinieerd: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000). Binnen elke systeem/orgaanklasse zijn de bijwerkingen gerangschikt aan de hand van de frequentie, met de meest voorkomende reacties als eerste.
De volgende bijwerkingen zijn vastgesteld in het klinische ontwikkelingsprogramma voor AJOVY (tabel 1).
Tabel 1: Bijwerkingen
Systeem/orgaanklasse volgens MedDRA | Frequentie | Bijwerking |
Immuunsysteemaandoeningen | Soms | Overgevoeligheidsreacties, zoals huiduitslag, pruritus, urticaria en zwelling |
Zelden | Anafylactische reactie | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Zeer vaak | Pijn op de injectieplaats |
Induratie op de injectieplaats | ||
Erytheem op de injectieplaats | ||
Vaak | Pruritus op de injectieplaats | |
Soms | Huiduitslag op de injectieplaats |
Beschrijving van geselecteerde bijwerkingen
Reacties op de injectieplaats
De meest frequent waargenomen lokale reacties op de injectieplaats waren pijn, induratie en erytheem. Alle lokale reacties op de injectieplaats waren tijdelijk en hoofdzakelijk licht tot matig ernstig van aard. Pijn, induratie en erytheem werden meestal direct na de injectie waargenomen, terwijl pruritus en huiduitslag binnen een mediane periode van respectievelijk 24 en 48 uur verschenen. Alle reacties op de injectieplaats herstelden, meestal binnen enkele uren of dagen. Reacties op de injectieplaats waren over het algemeen geen reden om het gebruik van het geneesmiddel te staken.
Ernstige overgevoeligheidsreacties
Er zijn anafylactische reacties gemeld met de frequentie zelden. Deze reacties traden meestal op binnen 24 uur na toediening, hoewel enkele reacties vertraagd waren.
Immunogeniciteit
In placebogecontroleerde onderzoeken ontwikkelde 0,4% van de patiënten (6 van de 1.701) die werden behandeld met fremanezumab antistoffen tegen het geneesmiddel (ADA, anti-drug antibodies). De antistofresponsen hadden een lage titer. Eén van deze 6 patiënten ontwikkelde neutraliserende antistoffen. Na 12 maanden behandeling werden bij 2,3% van de patiënten (43 van de 1.888) ADA gevonden, waarbij 0,95% van de patiënten neutraliserende antistoffen ontwikkelde. De ontwikkeling van ADA had geen invloed op de veiligheid en werkzaamheid van fremanezumab.
Melding van vermoedelijk bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten - www.fagg.be - Afdeling Vigilantie - Website: www.eenbijwerkingmelden.be - e-mail: adr@fagg-afmps.be.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
TEVA GmbH
Graf-Arco-Str. 3
89079 Ulm
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Voorgevulde spuit
EU/1/19/1358/001 – 1 voorgevulde spuit
EU/1/19/1358/002 – 3 voorgevulde spuiten
Voorgevulde pen
EU/1/19/1358/003 – 1 voorgevulde pen
EU/1/19/1358/004 – 3 voorgevulde pennen
10. DATUM VAN HERZIENING VAN DE TEKST
03/2025.
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3960788 | AJOVY 225MG OPL INJ VOORGEVULDE SPUIT 1 | N02CD03 | € 496,6 | - | Ja | € 12,5 | € 8,3 |
| 3960796 | AJOVY 225MG OPL INJ VOORGEVULDE SPUIT 3 | N02CD03 | € 1468,33 | - | Ja | € 12,5 | € 8,3 |
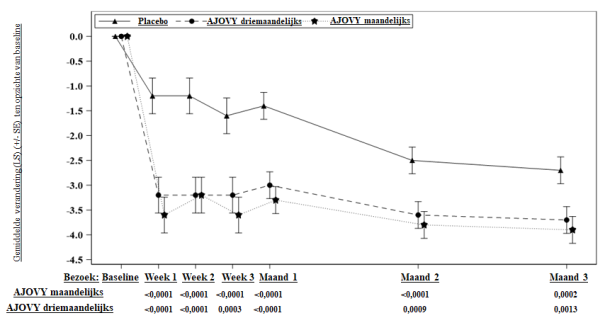
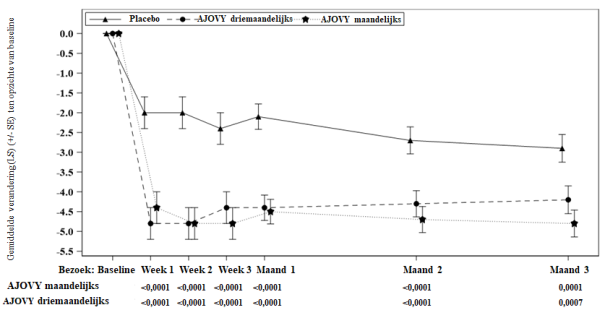
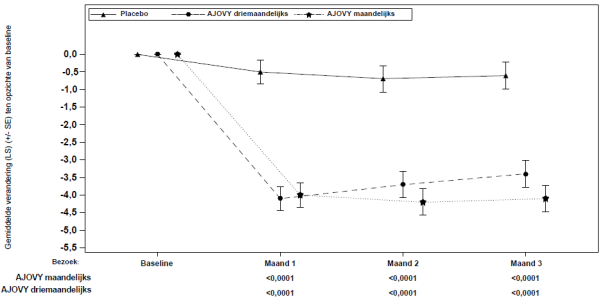 Gemiddelde bij baseline (maandelijkse gemiddelde aantal migrainedagen): placebo: 14,4; AJOVY driemaandelijks: 14,1; AJOVY maandelijks: 14,1.
Gemiddelde bij baseline (maandelijkse gemiddelde aantal migrainedagen): placebo: 14,4; AJOVY driemaandelijks: 14,1; AJOVY maandelijks: 14,1.