SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Bydureon 2 mg suspensie met verlengde afgifte voor injectie in voorgevulde pen.
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke voorgevulde pen bevat een dosis van 2 mg exenatide in 0,85 ml.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Suspensie met verlengde afgifte voor injectie in voorgevulde pen (BCise).
Witte tot gebroken witte ondoorzichtige suspensie.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Bydureon is geïndiceerd voor gebruik bij volwassenen, adolescenten en kinderen van 10 jaar en ouder met diabetes mellitus type 2 ter verbetering van glykemische controle in combinatie met andere glucoseverlagende geneesmiddelen, basale insuline inbegrepen, wanneer de huidige behandeling, samen met dieet en lichaamsbeweging, geen adequate glykemische controle geeft.
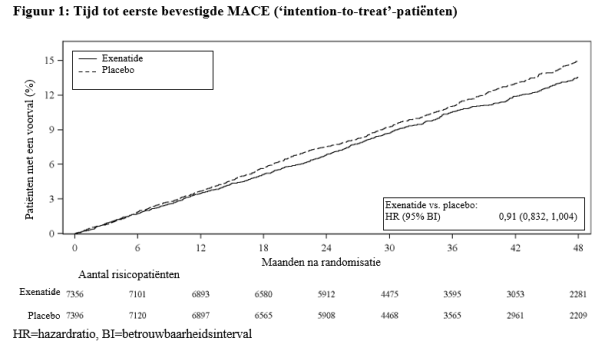
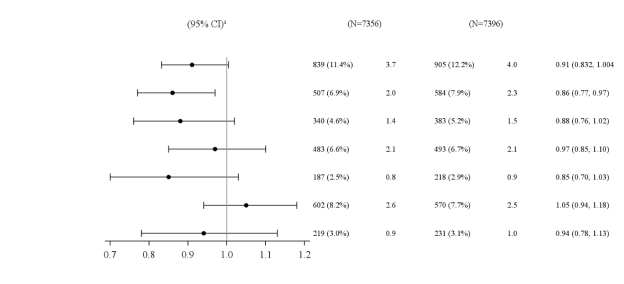
Voor studieresultaten met betrekking tot combinaties, effecten op de glykemische controle en cardiovasculaire voorvallen, en de onderzochte populaties, zie rubriek 4.4, 4.5 en 5.1.
4.2 Dosering en wijze van toediening
Dosering
De aanbevolen dosering is 2 mg exenatide eenmaal per week.
Patiënten die van exenatide met onmiddellijke afgifte (Byetta) omschakelen op exenatide met verlengde afgifte (Bydureon of Bydureon BCise) kunnen voorbijgaande verhogingen in bloedglucoseconcentraties ervaren, die gewoonlijk verbeteren binnen de eerste vier weken na aanvang van de therapie. Patiënten die wisselen tussen de exenatide producten met verlengde afgifte (Bydureon of Bydureon BCise), kunnen dit doen zonder dat relevante effecten op de bloedglucoseconcentraties te verwachten zijn.
Als exenatide met verlengde afgifte wordt toegevoegd aan een lopende behandeling met metformine en/of een thiazolidinedion, kan de bestaande dosering metformine en/of thiazolidinedion worden voortgezet. Wanneer het wordt toegevoegd aan een behandeling met een sulfonylureumderivaat, moet een verlaging van de dosis sulfonylureumderivaat worden overwogen om het risico van hypoglykemie te verlagen (zie rubriek 4.4). Combinatietherapie met thiazolidinedion werd alleen onderzocht bij volwassenen patiënten.
Exenatide met verlengde afgifte moet eenmaal per week op dezelfde dag van de week worden toegediend. De dag van de wekelijkse toediening kan indien nodig worden gewijzigd zolang de laatste dosis tenminste drie dagen eerder werd toegediend. Exenatide met verlengde afgifte kan op ieder moment van de dag worden toegediend, met of zonder maaltijden.
Als er een dosis wordt gemist, moet die worden toegediend zodra dit praktisch mogelijk is, op voorwaarde dat de volgende reguliere dosis over 3 dagen of later is gepland. Daarna kunnen de patiënten hun gebruikelijk doseringsschema van één keer per week hervatten.
Als er een dosis wordt gemist en de volgende reguliere dosis 1 of 2 dagen later is gepland, dan mag de patiënt de gemiste dosis niet toedienen, maar dient exenatide met verlengde afgifte op de volgende reguliere doseringsdag te worden hervat.
Het gebruik van dit geneesmiddel vereist geen extra zelfcontrole. Zelfcontrole van de bloedglucose is nodig om de dosis van het sulfonylureumderivaat en van de insuline aan te passen, met name wanneer de behandeling met exenatide met verlengde afgifte is gestart en de dosis insuline is verlaagd. Een stapsgewijze benadering van de verlaging van de insulinedosis wordt aanbevolen.
Als na discontinuering van exenatide met verlengde afgifte wordt begonnen met een andere glucoseverlagende behandeling, moet met de verlengde werking van het geneesmiddel rekening gehouden worden (zie rubriek 5.2).
Bijzondere patiëntengroepen
Ouderen
Er is geen dosisaanpassing nodig gebaseerd op leeftijd. Omdat de nierfunctie echter in het algemeen afneemt met de leeftijd, dient met de nierfunctie van de patiënt rekening gehouden te worden (zie Nierinsufficiëntie). (zie rubriek 5.2).
Nierinsufficiëntie
Voor patiënten met milde of matige nierinsufficiëntie is geen dosisaanpassing nodig.
Exenatide met verlengde afgifte wordt niet aanbevolen voor gebruik bij patiënten met terminale nierziekte of ernstige nierinsufficiëntie (glomerulaire filtratiesnelheid [GFR] < 30 ml/min) (zie rubriek 4.4).
Leverinsufficiëntie
Bij patiënten met leverinsufficiëntie is geen dosisaanpassing nodig (zie rubriek 5.2).
Pediatrische patiënten
Er is geen dosisaanpassing nodig voor adolescenten en kinderen van 10 jaar en ouder. Er zijn geen gegevens beschikbaar voor kinderen jonger dan 10 jaar (zie rubriek 5.1 en 5.2).
Wijze van toediening
Subcutaan gebruik
Exenatide met verlengde afgifte is bedoeld voor toediening door de patiënt zelf. Elke pen mag maar door één persoon gebruikt worden en is voor eenmalig gebruik.
Het wordt sterk aanbevolen dat patiënten voor therapieaanvang met exenatide met verlengde afgifte worden getraind door een beroepsbeoefenaar in de gezondheidszorg. De “Instructies voor de gebruiker” in de verpakking moeten nauwkeurig worden gevolgd.
Elke dosis moet direct nadat het geneesmiddel volledig is gemengd, in de buik, dij of de achterkant van de bovenarm worden toegediend als een subcutane injectie.
Bij gebruik met insuline moeten exenatide met verlengde afgifte en insuline als twee afzonderlijke injecties worden toegediend.
Voor instructies over reconstitutie van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6 en de “instructies voor de gebruiker”.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest frequent voorkomende bijwerkingen bij volwassenen in klinische studies waren gastro-intestinaal gerelateerd (voornamelijk misselijkheid (8%) die de neiging hadden te verdwijnen gedurende voortzetting van de behandeling), hoofdpijn (4%) en reacties op de injectieplaats, zoals jeuk op de injectieplaats (3%) en erytheem op de injectieplaats (2%). Bovendien trad hypoglykemie met een sulfonylureumderivaat zeer vaak op (zie Beschrijving van een geselecteerd aantal bijwerkingen, hieronder). De meeste bijwerkingen waren licht tot matig in intensiteit.
Lijst van bijwerkingen in tabelvorm
De frequentie van bijwerkingen van Bydureon BCise bij volwassenen gevonden in klinische studies, zijn in tabel 1 hieronder samengevat.
De gepoolde gegevens uit klinische studies met Bydureon BCise bij volwassenen omvatten twee fase-3 met vergelijkingsmiddel gecontroleerde studies met een duur van 6 tot 12 maanden. De follow-up- en verlengingsfasen van de studies zijn opgenomen in de pool. Achtergrondbehandelingen omvatten dieet en lichaamsbeweging alleen of met metformine, een sulfonylureumderivaat, een thiazolidinedion of een combinatie van orale glucoseverlagende geneesmiddelen. Bijwerkingen die zijn waargenomen met exenatide met verlengde afgifte maar niet in klinische studies met Bydureon BCise, zijn ook opgenomen in tabel 1.
Achtergrondbehandelingen in de klinische onderzoeken met exenatide met verlengde afgifte omvatten dieet en lichaamsbeweging, metformine, een sulfonylureumderivaat, een thiazolidinedion, een combinatie van orale glucoseverlagende middelen of een basale insuline.
De reacties zijn hieronder weergegeven als MedDRA-voorkeursterm per systeem/orgaanklasse en absolute frequentie. De frequenties zijn gedefinieerd als: zeer vaak (≥ 1/10), vaak (≥ 1/100, 1/10), soms (≥ 1/1.000, 1/100), zelden (≥ 1/10.000, 1/1.000), zeer zelden (< 1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1: Bijwerkingen van Bydureon BCise, waargenomen tijdens klinische studies en spontane meldingen bij volwassenen
Systeem/orgaanklasse / bijwerking | Frequentie van voorkomen1 | |||||
| Zeer vaak | Vaak | Soms | Zelden | Zeer zelden | Niet bekend |
Bloed- en lymfestelsel aandoeningen |
|
|
|
|
|
|
Door geneesmiddelen geïnduceerde trombocytopenie9 |
|
|
|
|
| X |
Lever- en galaandoeningen |
|
|
|
|
|
|
Cholecystitis11 |
|
| X |
|
|
|
Cholelithiase |
|
| X |
|
|
|
Immuunsysteem-aandoeningen |
|
|
|
|
|
|
Anafylactische reactie2 |
|
|
| X |
|
|
Voedings- en stofwisselingsstoornissen |
|
|
|
|
|
|
Hypoglykemie (met een sulfonylureumderivaat)5,6,7 | X |
|
|
|
|
|
Hypoglykemie (zonder een sulfonylureumderivaat)5,6,7 |
|
| X |
|
|
|
Hypoglykemie (met insuline)3,4,5 |
| X |
|
|
|
|
Verminderde eetlust |
|
| X |
|
|
|
Dehydratie |
|
| X |
|
|
|
Zenuwstelsel-aandoeningen |
|
|
|
|
|
|
Hoofdpijn |
| X |
|
|
|
|
Duizeligheid |
| X |
|
|
|
|
Dysgeusie |
|
| X |
|
|
|
Somnolentie2 |
|
| X |
|
|
|
Maagdarmstelsel-aandoeningen |
|
|
|
|
|
|
Misselijkheid5 |
| X |
|
|
|
|
Diarree |
| X |
|
|
|
|
Braken |
| X |
|
|
|
|
Obstipatie |
| X |
|
|
|
|
Dyspepsie |
| X |
|
|
|
|
Gastro-oesofageale refluxziekte |
| X |
|
|
|
|
Abdominale distensie |
| X |
|
|
|
|
Abdominale pijn |
| X |
|
|
|
|
Flatulentie |
|
| X |
|
|
|
Acute pancreatitis (zie rubriek 4.4) |
|
| X |
|
|
|
Eructatie2 |
|
| X |
|
|
|
Intestinale obstructie2 |
|
| X |
|
|
|
Vertraagde maaglediging10 |
|
| X |
|
|
|
Systeem/orgaanklasse / bijwerking | Frequentie van voorkomen1 | |||||
Huid- en onderhuid-aandoeningen |
|
|
|
|
|
|
Urticarie |
|
| X |
|
|
|
Hyperhidrosis |
|
| X |
|
|
|
Maculaire en papulaire uitslag |
|
| X |
|
|
|
Pruritus |
|
| X |
|
|
|
Alopecia2 |
|
| X |
|
|
|
Angio-oedeem9 |
|
|
|
|
| X |
Abcessen en cellulitis op de injectieplaats9 |
|
|
|
|
| X |
Nier- en urinewegaandoeningen |
|
|
|
|
|
|
Veranderde nierfunctie8 |
|
| X |
|
|
|
Algemene aandoeningen en toedieningsplaats-stoornissen |
|
|
|
|
|
|
Injectieplaats pruritus5 |
| X |
|
|
|
|
Injectieplaats erytheem5 |
| X |
|
|
|
|
Vermoeidheid |
| X |
|
|
|
|
Injectieplaats reactie5 |
|
| X |
|
|
|
Asthenie |
|
| X |
|
|
|
Injectieplaats uitslag5 |
|
| X |
|
|
|
Zich zenuwachtig voelen |
|
|
| X |
|
|
Onderzoeken |
|
|
|
|
|
|
Internationale genormaliseerde ratio verhoogd9 (zie rubriek 4.4) |
|
|
|
|
| X |
1 Mate van voorkomen gebaseerd op afgeronde langetermijnstudies naar werkzaamheid en veiligheid (n=526), tenzij anders aangegeven.
Inclusief follow-up binnen zeventig dagen na de laatst ontvangen dosis en de verlengingsperiode.
2 Mate van voorkomen gebaseerd op twaalf afgeronde langetermijnstudies naar werkzaamheid en veiligheid van exenatide met verlengde afgifte met totaal n=2868.
3 Gebaseerd op hypoglykemische gebeurtenissen die 1. resulteren in verlies van bewustzijn, epileptische aanval of coma, die na toediening van glucagon of glucose zijn opgelost OF 2. waarbij hulp van een derde partij nodig is om het op te lossen vanwege verslechtering van bewustzijn of gedrag en een glucosewaarde van < 54 mg/dl (3 mmol/l) OF 3. resulteren in symptomen vergelijkbaar met hypoglykemie met gelijktijdig een glucose < 54 mg/dl (3 mmol/l) voor behandeling.
4 Frequentie gemeld in de 28 weken durende gecontroleerde behandelperiode met exenatide met verlengde afgifte toegevoegd aan insuline glargine (n=231).
5 Zie de beschrijving van een geselecteerd aantal bijwerkingen hieronder.
6 Frequentie gemeld in de samengevoegde gegevens van de gecontroleerde perioden van de twee fase-3 klinische studies (n=410).
7 Gebaseerd op hypoglykemische gebeurtenissen met symptomen vergelijkbaar met hypoglykemie met gelijktijdig een glucosewaarde van < 54 mg/dl (3 mmol/l) voorafgaand aan de behandeling.
8 Omvat acuut nierfalen, verslechtering van chronisch nierfalen, verminderde nierfunctie, verhoogd serumcreatinine. Zie rubriek 4.4.
9 Mate van voorkomen gebaseerd op spontane meldingen met exenatide met verlengde afgifte (onbekende noemer).
10 Mate van voorkomen gebaseerd op zestien afgeronde langetermijnstudies naar werkzaamheid en veiligheid van exenatide met verlengde afgifte met totaal n = 4086.
11 Mate van voorkomen gebaseerd op afgeronde BYDUREON-studies naar werkzaamheid en veiligheid (totaal n=3560); inclusief DURATION 7- en DURATION 8-studies.
Beschrijving van een geselecteerd aantal bijwerkingen
Door geneesmiddelen geïnduceerde trombocytopenie
Door geneesmiddelen geïnduceerde trombocytopenie (DITP) met exenatide-afhankelijke anti-bloedplaatjesantilichamen zijn gerapporteerd bij volwassenen in de periode nadat het geneesmiddel op de markt is gebracht. DITP is een immuun-gemedieerde reactie die veroorzaakt wordt door geneesmiddelafhankelijke bloedplaatjes-reactieve antilichamen. Deze antilichamen vernietigen de bloedplaatjes in aanwezigheid van het sensibiliserend geneesmiddel.
Hypoglykemie
Er waren geen gevallen van ernstige hypoglykemie met Bydureon BCise in klinische studies bij volwassenen. De totale incidentie van milde hypoglykemie was 6,3%. Deze incidentie was verhoogd wanneer het werd gebruikt in combinatie met een sulfonylureumderivaat (26,1%) in vergelijking met geen sulfonylureumderivaat (0,9%) (zie rubriek 4.4). Om het risico van hypoglykemie geassocieerd met het gebruik van een sulfonylureumderivaat te reduceren, kan een verlaging van de dosering sulfonylureumderivaat in overweging genomen worden (zie rubrieken 4.2 en 4.4).
Indien exenatide met verlengde afgifte toegevoegd werd aan basale insuline, was er geen initiële aanpassing van de insulinedosis nodig. Er waren geen klinisch significante verschillen in de incidentie van hypoglykemische episoden met exenatide met verlengde afgifte in combinatie met basale insuline vergeleken met insuline. Er waren geen ernstige hypoglykemische episodes in de groep die exenatide met verlengde afgifte en insuline kreeg.
Misselijkheid
De meest gemelde gastro-intestinale bijwerking bij volwassenen was misselijkheid. Tijdens de gecontroleerde periode van de klinische studie met Bydureon BCise versus exenatide met onmiddellijke afgifte, werd misselijkheid gemeld bij 9,6% en 20,5% van de patiënten in elke groep. In totaal meldde 9,3% van de patiënten die behandeld werden met Bydureon BCise misselijkheid gedurende de gecontroleerde periode van beide klinische studies. De meeste episoden van misselijkheid waren mild tot matig, hielden verband met start van de behandeling en namen na verloop van tijd af.
Reacties op de injectieplaats
Gedurende de gecontroleerde fase van de klinische studies bij volwassenen werden reacties op de injectieplaats vaker gemeld bij patiënten die werden behandeld met Bydureon BCise dan bij patiënten die werden behandeld met het vergelijkingsgeneesmiddel (24% versus 4% met exenatide met onmiddellijke afgifte). Deze reacties op de injectieplaats waren doorgaans mild van aard en leidden gewoonlijk niet tot stopzetting van studiemedicatie. Patiënten kunnen bij continuering van de therapie behandeld worden om de symptomen te verlichten. Volgende injecties moeten iedere week op een andere injectieplaats gezet worden. In de periode sinds exenatide met verlengde afgifte op de markt is gebracht, zijn er gevallen van abcessen en cellulitis op de injectieplaats gerapporteerd.
Kleine subcutane knobbeltjes op de injectieplaats werden in klinische studies frequent waargenomen, in overeenstemming met de bekende eigenschappen van preparaten met poly-(D,L-lactide-co-glycolide)-polymere microsferen. De meeste individuele knobbeltjes interfereerden niet met deelname aan de studie en verdwenen met de tijd.
Immunogeniciteit
Geneesmiddelen op basis van eiwitten en peptiden hebben potentieel immunogene eigenschappen; in overeenstemming hiermee kunnen patiënten na behandeling met exenatide met verlengde afgifte antilichamen tegen exenatide ontwikkelen.
Ongeveer 42% van de patiënten ontwikkelde antilichamen met lage titer tegen exenatide en 32% van de patiënten ontwikkelde op enig moment tijdens de studies bij volwassenen antilichamen met hoge titer. Het percentage van deze personen met positieve antilichaamtiters, in het bijzonder hoge titers, bereikte een piek bij ongeveer 8 tot 16 weken dosering en nam vervolgens met de tijd af. Bij het eindpunt van de studie had ongeveer 43% van de patiënten een lage antilichaamtiter tegen exenatide en had 14% van de patiënten een hoge antilichaamtiter. Over het geheel genomen was de mate van glykemische controle (HbA1c) bij patiënten behandeld met Bydureon BCise met lage antilichaamtiter bij het laatste bezoek (-1,1% tot -1,5%) vergelijkbaar met die waargenomen bij degenen zonder antilichaamtiters (-1,1% tot -1,4) %). Hoewel patiënten met hoge antilichaamtiters bij het laatste bezoek een verzwakte HbA1c-respons hadden, waren de HbA1c-afnames bij deze patiënten klinisch relevant (-0,6% tot -0,7%).
Bij de volwassen patiënten behandeld met Bydureon BCise evalueerbaar voor antilichamen (n=393), was de incidentie van mogelijk immunogene reacties op de injectieplaats (meestal knobbeltje op de injectieplaats) tijdens de twee studies ongeveer 20%. Deze reacties werden minder vaak waargenomen bij antilichaamnegatieve patiënten (16%) en patiënten met lage antilichaamtiter (16%) in vergelijking met degene met hoge antilichaamtiter (27%).
Snel gewichtsverlies
In een studie van 30 weken bij volwassenen ondervond ongeveer 3% (n=4/148) van de met exenatide met verlengde afgifte behandelde patiënten ten minste één tijdsperiode van snel gewichtsverlies (gedocumenteerd gewichtsverlies van meer dan 1,5 kg per week tussen twee opeenvolgende bezoeken in het kader van de studie).
Versnelde hartslag
In de gecontroleerde periode van de Bydureon BCise klinische studies bij volwassenen werd een gemiddelde hartslagverhoging van 2,4 slagen per minuut (bpm) waargenomen ten opzichte van de baseline (74 bpm). Vijftien procent van de met exenatide met verlengde afgifte behandelde patiënten had een gemiddelde hartslagverhoging van ≥ 10 bpm; circa 5% tot 10% van de proefpersonen in de andere behandelgroepen had een gemiddelde hartslagverhoging van ≥ 10 bpm.
Pediatrische patiënten
Het veiligheidsprofiel van exenatide in een klinische studie met adolescenten en kinderen van 10 jaar of ouder (zie rubriek 5.1) was vergelijkbaar met dat waargenomen in de studies bij volwassenen.
In het pediatrische onderzoek waren er geen ernstige hypoglykemievoorvallen.
In de dubbelblinde studie van 24 weken had één patiënt (1,7%) in de groep met exenatide met verlengde afgifte en één patiënt (4,3%) in de placebogroep milde hypoglykemie (gedefinieerd als een niet-ernstige hypoglykemie-gebeurtenis met symptomen die overeenkwamen met hypoglykemie en een glucosewaarde minder dan 3 mmol/l [54 mg/dl) voorafgaand aan de behandeling van de episode). Beide patiënten kregen insuline als achtergrondbehandeling.
Andere hypoglykemische gebeurtenissen, episoden die niet voldeden aan belangrijke of minder belangrijke criteria, werden door de onderzoeker gemeld bij respectievelijk 8 patiënten (13,6%) en 1 patiënt (4,3%) in de groep die exenatide met verlengde afgifte ontving en de placebogroep. Hiervan kregen 6 patiënten in de groep die exenatide met verlengde afgifte ontving en 1 patiënt in de placebogroep insuline als achtergrondbehandeling.
In het pediatrisch onderzoek was de maximale antilichaamtiter die op enig moment tijdens het onderzoek werd verkregen bij ongeveer 29,3% van de patiënten laag (< 625) en bij ongeveer 63,8% van de patiënten hoog (≥ 625). Het percentage patiënten met positieve antilichaamtiters bereikte een piek rond week 12. Naarmate het onderzoek voortduurde tot week 52 was het percentage patiënten met hoge titers gedaald (30,4%) en het percentage patiënten met lage titers (41,3%) gestegen. Patiënten met antilichamen met een hogere titer kunnen een verzwakte HbA1c-respons hebben (zie rubriek 4.4).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
AstraZeneca AB
SE-151 85 Södertälje
Zweden
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/11/696/005-006
10. DATUM VAN HERZIENING VAN DE TEKST
11/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3907169 | BYDUREON 2MG BCISE SUSP INJ VERL.AFG.VOORGEV.PEN 4 | A10BJ01 | € 91,54 | - | Ja | - | - |