1. NAAM VAN HET GENEESMIDDEL
Desorelle 20, 150/20 microgram filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke filmomhulde tablet bevat:
150 microgram desogestrel
20 microgram ethinylestradiol.
Hulpstof met bekend effect: 64,3 mg lactose (als lactosemonohydraat).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet
Lichtgele of bijna witte, ronde, dubbelbolle, filmomhulde tabletten met een diameter van ongeveer 6 mm, met merkteken P9 aan de ene kant en merkteken RG aan de andere kant.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Orale anticonceptie.
Bij de beslissing om Desorelle 20 voor te schrijven moet rekening worden gehouden met de huidige risicofactoren van de individuele vrouw, in het bijzonder met de risicofactoren voor veneuze trombo-embolie (VTE) en hoe het risico op VTE met Desorelle 20 zich verhoudt tot het risico met andere gecombineerde hormonale anticonceptiva (CHC) (zie rubrieken 4.3 en 4.4).
4.2 Dosering en wijze van toediening
Dosering
Hoe gebruikt u dit middel
De tabletten moeten elke dag op ongeveer hetzelfde tijdstip worden ingenomen in de volgorde die op de verpakking staat aangegeven. Gedurende 21 opeenvolgende dagen moet dagelijks een tablet worden ingenomen. Elke volgende strip begint na een interval van 7 dagen zonder tabletten. Tijdens dit interval treedt gewoonlijk een dervingsbloeding op. Deze bloeding begint meestal op de tweede of derde dag na de laatste tablet en is niet altijd beeindigd op de dag waarop met de volgende strip wordt begonnen.
Hoe wordt begonnen met Desorelle 20
Geen voorafgaand hormonaal anticonceptivum (in de vorige maand)
Men moet op dag 1 van de normale menstruatiecyclus (d.w.z. op de eerste dag waarop de vrouw een menstruele bloeding heeft) te beginnen met het innemen van de tabletten. Beginnen met innemen van de tabletten is ook toegestaan op dag 2-5, maar het is raadzaam gedurende de eerste cyclus gedurende de eerste 7 dagen van het innemen van tabletten gelijktijdig een barrièremethode toe te passen.
Overstappen van een hormonaal combinatie-anticonceptivum (oraal combinatie-anticonceptivum (COC), gecombineerde vaginale anticonceptiering of transdermale pleister)
De vrouw dient op de dag na de laatste werkzame tablet (de laatste tablet die het werkzame bestanddeel bevat) van haar vorige COC te beginnen met het innemen van Desorelle 20, maar uiterlijk op de dag na de gebruikelijke tabletvrije pauze of na de laatste placebotablet (tablet zonder werkzaam bestanddeel) van haar vorige COC.
Wanneer een vaginale ring of een transdermale pleister is gebruikt, dient de vrouw bij voorkeur op de dag van verwijdering te beginnen met het gebruik van Desorelle 20. De vrouw kan Desorelle 20 ook beginnen te gebruiken op de dag dat de nieuwe vaginale ring of een transdermale pleister zou moeten worden geplaatst, maar niet later dan die dag.
Wanneer de vrouw haar eerdere anticonceptiemethode regelmatig en correct heeft gebruikt, en wanneer de vrouw niet zwanger is, kan ze ook op ongeacht welke dag van de cyclus van haar vorige combinatie hormonaal anticonceptivum overschakelen.
In geen geval mag de hormoon-vrije periode van haar vorige methode verlengd worden tot voorbij de aanbevolen duur.
Het is mogelijk dat niet alle anticonceptiemethoden (vaginale ring, transdermale pleister) gecommercialiseerd worden in alle EU-landen.
Overstappen van producten met uitsluitend progestageen (pillen, injectie, implantaat die/dat alleen progestageen bevat(ten) of een progestageen-afgevend intra-uterien systeem (IUS))
De vrouw kan op ongeacht welke dag overstappen van pillen met alleen progestageen (overstappen van implantaat of IUS op de dag dat dit wordt verwijderd; overstappen van injectie wanneer de volgende injectie had moeten worden gegeven) maar dient in al deze gevallen te worden geadviseerd gedurende de eerste 7 dagen waarop tabletten worden ingenomen een aanvullende barrièremethode toe te passen.
Na abortus in het 1e trimester
Men dient onmiddellijk te beginnen met het innemen van de tabletten. In dit geval zijn geen verdere anticonceptiemaatregelen nodig.
Na bevalling of abortus in het 2e trimester
Voor vrouwen die borstvoeding geven - zie rubriek 4.6.
Men dient de vrouw te adviseren te beginnen op dag 21-28 na een bevalling of abortus in het 2e trimester. Wanneer zij later begint met de pil dient men haar te adviseren gedurende de eerste 7 dagen van het innemen van tabletten gelijktijdig een barrièremethode toe te passen. Wanneer zij al gemeenschap heeft gehad, dient zwangerschap te worden uitgesloten of dient zij te wachten tot haar eerste menstruele bloeding vóór zij begint met het innemen van Desorelle 20.
Gemiste tabletten
Wanneer de gebruikster gedurende minder dan 12 uur is vergeten een tablet in te nemen, is de anticonceptiebescherming niet verminderd. De vrouw dient de vergeten tablet in te nemen zodra zij eraan denkt en de resterende tabletten worden zoals gewoonlijk ingenomen.
Wanneer de gebruikster gedurende meer dan 12 uur is vergeten een tablet in te nemen, kan de anticonceptiebescherming zijn verminderd. Bij vergeten tabletten dient men de volgende twee basisregels te overwegen: .
1. De continue inname van tabletten mag niet langer dan een periode van 7 dagen worden onderbroken.
2. Er zijn 7 dagen van ononderbroken inname van tabletten noodzakelijk om voldoende onderdrukking van de hypothalamus-hypofyse-ovarium-as te bereiken.
Daarom kan het volgende advies worden gegeven voor de dagelijkse praktijk:
Week 1
De vrouw dient de laatste vergeten tablet in te nemen zodra ze eraan denkt, ook als dit betekent dat zij 2 tabletten tegelijk moet innemen. Vervolgens dient zij de tabletten op de gebruikelijke tijd van de dag in te nemen. Gedurende de volgende 7 dagen dient zij tegelijkertijd een barrièremethode toe te passen, bijv. een condoom. Wanneer gedurende de voorgaande 7 dagen gemeenschap heeft plaatsgevonden, moet rekening worden gehouden met de mogelijkheid van een zwangerschap. Hoe meer tabletten zijn vergeten en hoe dichter zij tegen de gebruikelijke tabletvrije periode zitten, hoe hoger het risico van zwangerschap is.
Week 2
De vrouw dient de laatste vergeten tablet in te nemen zodra ze eraan denkt, ook als dit betekent dat zij 2 tabletten tegelijk moet innemen. Vervolgens dient zij de tabletten op de gebruikelijke tijd van de dag in te nemen. Op voorwaarde dat de tabletten op correcte wijze gedurende de 7 dagen vóór de vergeten tablet zijn ingenomen, is het niet noodzakelijk verdere anticonceptiemaatregelen te nemen. Wanneer dit echter niet het geval is, of wanneer meer dan 1 tablet is vergeten, dient men de vrouw te adviseren gedurende 7 dagen een andere anticonceptiemethode toe te passen.
Week 3
Het risico van verminderde anticonceptiebescherming is aanwezig als gevolg van de komende tabletvrije periode van 7 dagen. Dit risico kan echter worden voorkomen door de tabletinname aan te passen. Op die manier is het niet noodzakelijk verdere anticonceptiemaatregelen te nemen wanneer één van de twee hieronder staande alternatieven wordt gevolgd, op voorwaarde dat alle tabletten gedurende de 7 dagen voorafgaand aan de vergeten tablet op correcte wijze zijn ingenomen. Wanneer dit niet het geval is, dient men de vrouw te adviseren de eerste van de twee alternatieven te volgen en tegelijkertijd gedurende de volgende 7 dagen een andere anticonceptiemethode toe te passen.
1. De vrouw dient de laatste vergeten tablet in te nemen zodra ze eraan denkt, ook als dit betekent dat zij 2 tabletten tegelijk moet innemen. Vervolgens dient zij de tabletten op de gebruikelijke tijd van de dag in te nemen. Zij zal onmiddellijk na het innemen van de laatste tablet in de huidige verpakking beginnen met het innemen van de volgende verpakking, d.w.z. dat er geen pauze is tussen de verpakkingen. Het is niet erg waarschijnlijk dat de vrouw haar menstruele bloeding vóór het einde van de tweede verpakking zal krijgen, maar zij kan spotting of doorbraakbloeding ondervinden op de dagen waarop zij tabletten inneemt.
2. Men kan de vrouw ook adviseren te stoppen met het innemen van tabletten uit de huidige verpakking. In dat geval dient ze een tabletvrije periode van maximaal 7 dagen aan te houden inclusief de dagen waarop ze vergat tabletten in te nemen en vervolgens door te gaan met de volgende verpakking.
Wanneer de vrouw tabletten is vergeten en daarna geen menstruele bloeding krijgt gedurende de eerste normale tabletvrije periode, dient men de mogelijkheid van zwangerschap te overwegen.
Wat te doen bij maag-darmstoornissen
In geval van ernstige maag-darmstoornissen is er kans op onvolledige absorptie, en moeten aanvullende anticonceptieve maatregelen getroffen worden.
Als braken optreedt binnen 3-4 uur na de inname van een tablet geldt hetzelfde advies als bij het vergeten van tabletten dat hierboven is gegeven. Als de vrouw haar normale schema van tabletinname niet wil veranderen, moet ze de extra tablet(ten) uit een andere strip nemen.
Hoe wordt een onttrekkingsbloeding uitgesteld of verschoven
Uitstellen van de maandelijkse onttrekkingsbloeding is geen indicatie van dit product. Indien de
maandelijkse bloeding in uitzonderlijke gevallen toch dient uitgesteld te worden, dient de vrouw zonder een tabletvrije pauze door te gaan met een andere blisterverpakking van Desorelle 20. Men kan verlengen zolang men wil tot het einde van de tweede verpakking. Gedurende de verlenging kan de vrouw doorbraakbloeding of spotting ondervinden. Regelmatig innemen van Desorelle 20 wordt na de gebruikelijke pauze van 7 tabletvrije dagen hervat.
Om haar menstruatie te verschuiven naar een andere dag van de week dan waaraan de vrouw gewend is met haar huidige schema, kan men haar adviseren haar komende tabletvrije pauze met zoveel dagen in te korten als zij wil. Hoe korter de pauze, hoe groter het risico dat zij geen onttrekkingsbloeding zal hebben en tijdens de volgende verpakking doorbraakbloeding en spotting zal ondervinden (net als bij het uitstellen van een menstruatie).
Pediatrische patiënten
De veiligheid en werkzaamheid van Desorelle 20 bij jongeren onder de 18 jaar zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Voor oraal gebruik.
4.3 Contra-indicaties
Gecombineerde hormonale anticonceptiva mogen in de volgende situaties niet worden gebruikt.
Wanneer een van de condities zich voor het eerst voordoet tijdens het gebruik van orale anticonceptiva, dient onmiddellijk te worden gestopt met het gebruik van orale anticonceptiva.
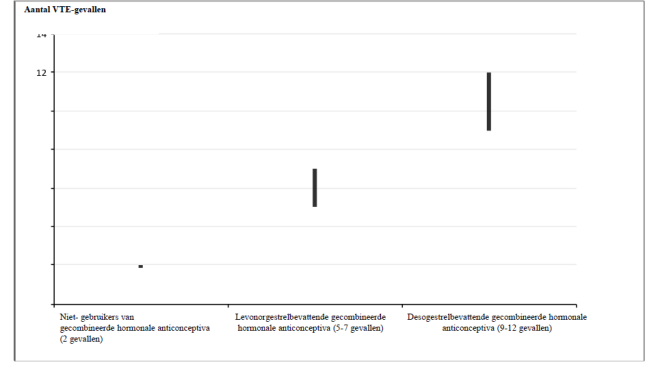
- Aanwezigheid van of risico op veneuze trombo-embolie (VTE)
- Veneuze trombo-embolie – bestaande VTE (bij antistollingsmiddelen) of eerder doorgemaakte VTE (bijv. diepe veneuze trombose [DVT] of longembolie [PE])
- Bekende erfelijke of verworven predispositie voor veneuze trombo-embolie, bijvoorbeeld APC-resistentie, (waaronder factor V-Leiden), antitrombine‑III-deficiëntie, proteïne C-deficiëntie, proteïne S-deficiëntie
- Zware operatie met langdurige immobilisatie (zie rubriek 4.4)
- Een hoog risico op veneuze trombo-embolie door de aanwezigheid van meerdere risicofactoren (zie rubriek 4.4)
- Aanwezigheid van of risico op arteriële trombo-embolie (ATE)
- Arteriële trombo-embolie – bestaande arteriële trombo-embolie, eerder doorgemaakte arteriële trombo-embolie (bijv. myocardinfarct) of prodromale aandoening (bijv. angina pectoris)
- Cerebrovasculaire ziekte – bestaande beroerte, eerder doorgemaakte beroerte of prodromale aandoening (bijv. transient ischaemic attack (TIA))
- Bekende erfelijke of verworven predispositie voor arteriële trombo-embolie, bijvoorbeeld hyperhomocysteïnemie en antifosfolipiden-antistoffen (anticardiolipine-antistoffen, lupusanticoagulans)
- Voorgeschiedenis van migraine met focale neurologische symptomen (zie rubriek 4.4)
- Een hoog risico op arteriële trombo-embolie als gevolg van meerdere risicofactoren (zie rubriek 4.4) of door de aanwezigheid van een ernstige risicofactor, zoals:
- diabetes mellitus met vasculaire symptomen
- ernstige hypertensie
- ernstige dislipoproteïnemie
- Aanwezigheid of voorgeschiedenis van ernstige hepatische ziekte zolang leverfunctiewaarden niet zijn teruggekeerd tot normaal
- Aanwezigheid of voorgeschiedenis van levertumoren (benigne of maligne)
- Bekende of vermoedelijke door geslachtssteroïden beïnvloede kwaadaardige tumoren (bijv. van de geslachtsorganen of de borsten)
- Endometriale hyperplasie
- Ongediagnosticeerde vaginale bloeding
- Bekende of vermoedelijke zwangerschap
- Pancreatitis of een voorgeschiedenis daarvan indien in verband met hypertriglyceridemie
- Overgevoeligheid voor de werkzame stoffen of voor één van de in rubriek 6.1 vermelde hulpstoffen.
Desorelle 20 is gecontra-indiceerd voor gelijktijdig gebruik met geneesmiddelen die ombitasvir/paritaprevir/ritonavir en dasabuvir bevatten, of geneesmiddelen die glecaprevir/pibrentasvir of sofosbuvir/velpatasvir/voxilaprevir bevatten (zie rubriek 4.5).
4.8 Bijwerkingen
Tijdens het eerste deel van de behandelingsperiode kan een groot deel (10-30%) van de vrouwen bijwerkingen zoals gevoelige borsten, zich onwel voelen en een bloeding verwachten. Deze bijwerkingen zijn echter gewoonlijk tijdelijk en verdwijnen na 2-4 maanden.
Beschrijving van geselecteerde bijwerkingen
Er is een verhoogd risico waargenomen op arteriele en veneuze trombotische en trombo-embolische voorvallen, waaronder myocardinfarct, beroerte, transiente ischemische aanvallen, veneuze trombose en longembolie bij vrouwen die gecombineerde hormonale anticonceptiva gebruikten. Hier wordt in rubriek 4.4 dieper op ingegaan.
Een aantal andere bijwerkingen zijn gemeld bij vrouwen die CHC’s gebruiken. Ze worden meer in detail uitgelegd in rubriek 4.4.
Zoals met alle gecombineerde orale anticonceptiva kunnen er veranderingen optreden in het menstruatiepatroon, vooral tijdens de eerste maanden van het gebruik. Dit kunnen veranderingen zijn in de frequentie (geen, minder frequent, meer frequent of aanhoudend), de intensiteit (zwakker of heviger) of de duur van de bloeding.
Mogelijk gerelateerde bijwerkingen die zijn gerapporteerd bij gebruikers van Desorelle 20 of bij gecombineerde hormonale anticonceptiva gebruikers over het algemeen worden vermeld in de onderstaande tabel3. Alle ADR's worden per systeem/orgaanklasse en frequentie vermeld; zeer vaak (≥1/10), vaak (≥1/100 tot <1/10), soms (≥1/1.000 tot <1/100), zelden (≥1/10.000 en <1/1.000) en niet bekend (frequentie kan met de beschikbare gegevens niet worden bepaald).
Systeem/ | | Vaak | Soms | Zelden | Niet bekend |
Immuunsysteem-aandoeningen |
|
|
| overgevoeligheidsreacties | Verergering van de symptomen van erfelijk en verworven angio-oedeem |
Voedings- en stofwisselingsstoornissen |
|
| Vloeistofretentie |
|
|
Psychische stoornissen |
| Depressieve stemming | Verminderd libido | Verhoogd libido |
|
Zenuwstelselaandoeningen |
| Hoofdpijn | Migraine |
|
|
Oogaandoeningen |
|
|
| Contactlens-intolerantie |
|
Evenwichtsorgaan- en ooraandoeningen |
|
| Otosclerose |
|
|
Bloedvataandoeningen |
|
| Hypertensie | Veneuze trombo-embolie (VTE), Arteriële trombo-embolie (ATE) |
|
Maagdarmstelselaandoeningen |
| Misselijkheid | Braken |
|
|
Huid- en onderhuidaandoeningen |
| Acne | Uitslag | Erythema nodosum |
|
Voortplantingsstelsel- en borstaandoeningen | Onregelmatige bloeding | Pijn in de borsten | Borstvergroting | Vaginale afscheiding |
|
Onderzoeken |
| Gewichtstoename |
| Gewichtsafname |
|
3 De meest geschikte MedDRA-term voor het beschrijven van een bepaalde bijwerking wordt vermeld.
Synoniemen of gerelateerde aandoeningen worden niet vermeld, maar er dient wel rekening mee te
worden gehouden.
Interacties
Doorbraakbloeding en/of falen van de anticonceptie kan het gevolg zijn van interacties tussen andere geneesmiddelen (enzyminductoren) met orale anticonceptiva (zie rubriek 4.5).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico's van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Gedeon Richter Plc.
Gyömrői út 19-21
1103 Boedapest
Hongarije
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE 339412
10. DATUM VAN HERZIENING VAN DE TEKST
Datum van de goedkeuring van de samenvatting van de productkenmerken: 01/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2612349 | DESORELLE 20 COMP 13 X 21 | G03AA09 | € 29,04 | - | Ja | - | - |
| 2612406 | DESORELLE 20 COMP 3 X 21 | G03AA09 | € 9,22 | - | Ja | € 0,22 | € 0,22 |
| 2612414 | DESORELLE 20 COMP 6 X 21 | G03AA09 | € 18,9 | - | Ja | € 0,9 | € 0,9 |