1. NAAM VAN HET GENEESMIDDEL
Ozempic 0,25 mg oplossing voor injectie in een voorgevulde pen
Ozempic 0,5 mg oplossing voor injectie in een voorgevulde pen
Ozempic 1 mg oplossing voor injectie in een voorgevulde pen
Ozempic 2 mg oplossing voor injectie in een voorgevulde pen
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Ozempic 0,25 mg oplossing voor injectie
Eén ml oplossing bevat 1,34 mg semaglutide*. Een voorgevulde pen bevat 2 mg semaglutide* in 1,5 ml oplossing. Elke dosis bevat 0,25 mg semaglutide in 0,19 ml oplossing.
Ozempic 0,5 mg oplossing voor injectie
1,5 ml: Eén ml oplossing bevat 1,34 mg semaglutide*. Een voorgevulde pen bevat 2 mg semaglutide* in 1,5 ml oplossing. Elke dosis bevat 0,5 mg semaglutide in 0,37 ml oplossing.
3 ml: Eén ml oplossing bevat 0,68 mg semaglutide*. Een voorgevulde pen bevat 2 mg semaglutide* in 3 ml oplossing. Elke dosis bevat 0,5 mg semaglutide in 0,74 ml oplossing.
3 ml: Eén ml oplossing bevat 1,34 mg semaglutide*. Een voorgevulde pen bevat 4 mg semaglutide* in 3 ml oplossing. Elke dosis bevat 0,5 mg semaglutide in 0,37 ml oplossing.
Ozempic 1 mg oplossing voor injectie
Eén ml oplossing bevat 1,34 mg semaglutide*. Een voorgevulde pen bevat 4 mg semaglutide* in 3 ml oplossing. Elke dosis bevat 1 mg semaglutide in 0,74 ml oplossing.
Eén ml oplossing bevat 2,68 mg semaglutide*. Een voorgevulde pen bevat 8 mg semaglutide* in 3 ml oplossing. Elke dosis bevat 1 mg semaglutide in 0,37 ml oplossing.
Ozempic 2 mg oplossing voor injectie
Eén ml oplossing bevat 2,68 mg semaglutide*. Een voorgevulde pen bevat 8 mg semaglutide* in 3 ml oplossing. Elke dosis bevat 2 mg semaglutide in 0,74 ml oplossing.
* Humaan glucagon-achtig peptide-1 (GLP‑1)-analoog, geproduceerd met behulp van recombinant-DNA-techniek in Saccharomyces cerevisiae-cellen.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie (injectie).
Heldere en kleurloze of nagenoeg kleurloze, isotone oplossing; pH=7,4.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Ozempic is geïndiceerd voor de behandeling van volwassenen met onvoldoende gereguleerde diabetes mellitus type 2 als toevoeging aan dieet en lichaamsbeweging
• als monotherapie wanneer metformine ongeschikt wordt geacht als gevolg van intolerantie of contra-indicaties
• in aanvulling op andere geneesmiddelen voor de behandeling van diabetes
Voor onderzoeksresultaten met betrekking tot combinaties, werkzaamheid op glykemische controle, cardiovasculaire ziekte en renale events en de onderzochte populaties, zie rubrieken 4.4, 4.5 en 5.1.
4.2 Dosering en wijze van toediening
Dosering
De startdosis is 0,25 mg semaglutide eenmaal per week. Na 4 weken moet de dosering worden verhoogd naar 0,5 mg eenmaal per week. Na ten minste 4 weken met een dosering van 0,5 mg eenmaal per week, kan de dosering worden verhoogd naar 1 mg eenmaal per week om de glykemische controle verder te verbeteren. Na ten minste 4 weken met een dosering van 1 mg eenmaal per week, kan de dosering worden verhoogd naar 2 mg eenmaal per week om de glykemische controle verder te verbeteren.
Semaglutide 0,25 mg is geen onderhoudsdosering. Doseringen hoger dan 2 mg per week worden niet aanbevolen.
Wanneer Ozempic wordt toegevoegd aan een bestaande behandeling met metformine en/of thiazolidinedion of aan een natrium-glucose-cotransporter 2-remmer (sodium-glucose co-transporter-2 inhibitor, SGLT2-remmer), kan de huidige dosis metformine en/of thiazolidinedion of SGLT2-remmer ongewijzigd worden voortgezet.
Wanneer Ozempic wordt toegevoegd aan een bestaande behandeling met sulfonylureumderivaat of insuline, moet een verlaging van de dosis sulfonylureumderivaat of insuline worden overwogen om het risico op hypoglykemie te verlagen (zie rubrieken 4.4 en 4.8).
Zelfcontrole van bloedglucosewaarden is niet nodig om de dosering van Ozempic aan te passen. Zelfcontrole van de bloedglucosewaarden is noodzakelijk om de dosis sulfonylureumderivaat en insuline aan te passen, in het bijzonder wanneer Ozempic wordt gestart en insuline wordt verlaagd. Een stapsgewijze aanpak wordt aanbevolen bij het afbouwen van insuline.
Gemiste dosis
Als een dosis is gemist, dient deze zo snel mogelijk en binnen 5 dagen na de gemiste dosis alsnog te worden toegediend. Als er meer dan 5 dagen verstreken zijn, moet de gemiste dosis worden overgeslagen en moet de volgende dosis op de gebruikelijke geplande dag worden toegediend. In beide gevallen kunnen patiënten vervolgens hun gebruikelijke wekelijkse doseringsschema hervatten.
De doseringsdag wijzigen
De dag van de wekelijkse toediening kan indien nodig worden gewijzigd zolang de tijd tussen twee doses ten minste 3 dagen (> 72 uur) bedraagt. Na selectie van een nieuwe doseringsdag moet de dosering eenmaal per week worden voortgezet.
Specifieke patiëntgroepen
Ouderen
Er is geen dosisaanpassing nodig op basis van leeftijd.
Nierinsufficiëntie
Er is geen dosisaanpassing vereist bij patiënten met milde, matig ernstige of ernstige nierinsufficiëntie. Er is beperkt ervaring met het gebruik van semaglutide bij patiënten met nierfalen (end-stage renal disease).
Leverinsufficiëntie
Er is geen dosisaanpassing vereist bij patiënten met leverinsufficiëntie. Er is beperkte ervaring met het gebruik van semaglutide bij patiënten met ernstige leverinsufficiëntie. Voorzichtigheid is geboden bij de behandeling van deze patiënten met semaglutide (zie rubriek 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van semaglutide bij kinderen en jongeren tot 18 jaar zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Subcutaan gebruik.
Ozempic wordt subcutaan geïnjecteerd in de buik, in de dij of in de bovenarm. De injectieplaats kan zonder aanpassing van de dosis worden gewijzigd. Ozempic mag niet intraveneus of intramusculair worden toegediend.
Ozempic moet eenmaal per week worden toegediend op elk gewenst moment van de dag, onafhankelijk van de maaltijden.
Zie rubriek 6.6 voor verdere informatie over de toediening.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
In 8 fase 3a-studies werden 4.792 patiënten blootgesteld aan maximaal 1 mg semaglutide. De meest frequent gemelde bijwerkingen tijdens klinisch onderzoek waren aandoeningen van het maag-darmstelsel, waaronder misselijkheid (zeer vaak), diarree (zeer vaak) en braken (vaak). In het algemeen waren deze bijwerkingen mild tot matig van aard en van korte duur.
Tabel met een lijst van de bijwerkingen
In tabel 1 staan de bijwerkingen die zijn gemeld tijdens alle fase 3-studies (met inbegrip van de langetermijnstudie naar cardiovasculaire uitkomsten) en postmarketing rapporten met betrekking tot patiënten met diabetes mellitus type 2 (verder beschreven in rubriek 5.1). De frequenties van de bijwerkingen (behalve complicaties inzake diabetische retinopathie, zie voetnoot in tabel 1) zijn gebaseerd op een verzameling van de fase 3a-studies, met uitzondering van de cardiovasculaire uitkomstenstudie (zie tekst onder de tabel voor meer informatie).
De bijwerkingen zijn hieronder gerangschikt naar systeem/orgaanklasse en absolute frequentie. Frequenties zijn gedefinieerd als: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000) en niet bekend: kan met de beschikbare gegevens niet worden bepaald. Binnen iedere frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Tabel 1 Frequentie van bijwerkingen van semaglutide
MedDRA systeem/ | Zeer vaak | Vaak | Soms | Zelden | Zeer zelden | Niet bekend |
Immuunsysteemaandoeningen |
|
| Hyper-sensitiviteitc | Anafylac-tische reactie |
|
|
Voedings- en stofwisselingsstoornissen | Hypo-glykemiea indien gebruikt met insuline of sulfonyl-ureumderivaat | Hypo-glykemiea indien gebruikt met andere orale antidiabetica (OAD) |
|
|
|
|
Zenuwstelselaandoeningen |
| Duizeligheid | Dysgeusie |
|
|
|
Oogaandoeningen |
| Complicaties van diabetische retinopathieb |
|
| Niet-arteritische anterieure ischemische opticusneuropathie (NAION) |
|
Hartaandoeningen |
|
| Verhoogde hartslag |
|
|
|
Maagdarmstelselaandoeningen | Misselijk-heid | Braken | Acute pancreatitis |
|
| Ingewanden-obstructied |
Lever- en galaandoeningen |
| Cholelithiase |
|
|
|
|
Huid- en onderhuid-aandoeningen |
|
|
|
|
| Angio-oedeemd |
Algemene aandoeningen en toedieningsplaatsstoornissen |
| Vermoeid-heid | Reacties op de injectieplaats |
|
|
|
Onderzoeken |
| Verhoogde lipase |
|
|
|
|
a) Hypoglykemie gedefinieerd als ernstig (episode waarbij de patiënt hulp van derden nodig had) of symptomatisch in combinatie met een bloedglucose < 3,1 mmol/l.
b) Complicaties van diabetische retinopathie zijn een combinatie van: retinale fotocoagulatie, behandeling met intravitreale middelen, glasvochtbloeding, diabetes-gerelateerde blindheid (soms). Frequentie op basis van cardiovasculaire uitkomstenstudie.
c) Groepsterm voor bijwerkingen gerelateerd aan hypersensitiviteit, zoals rash en urticaria.
d) Uit postmarketing meldingen.
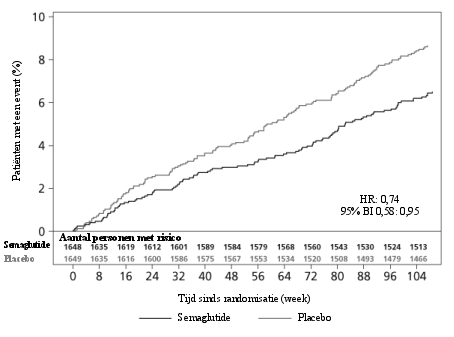
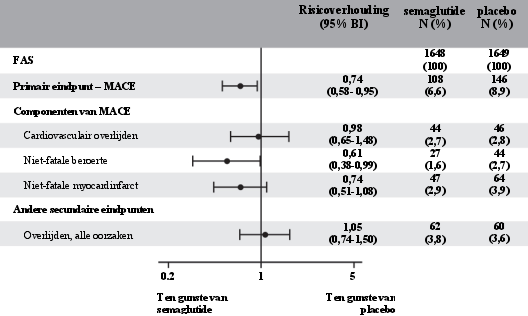
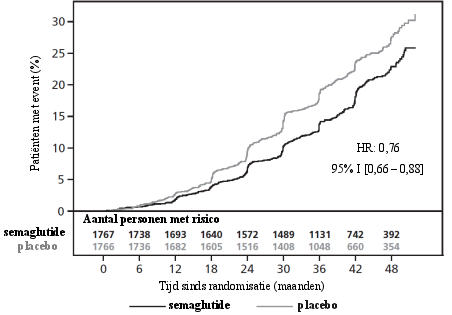
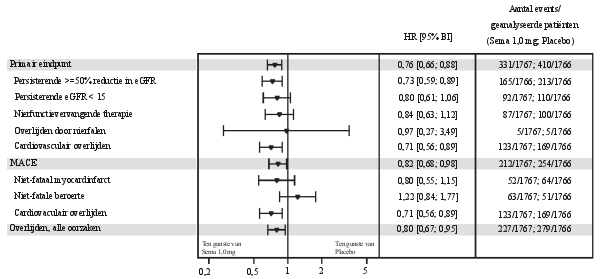
2 jaar durende cardiovasculaire uitkomsten- en veiligheidsstudie
In de populatie met hoog risico op cardiovasculaire events was het bijwerkingenprofiel vergelijkbaar met dat van de andere fase 3a-studies (beschreven in rubriek 5.1).
Beschrijving van een geselecteerd aantal bijwerkingen
Hypoglykemie
Er werden geen episoden van ernstige hypoglykemie waargenomen bij semaglutide gebruikt als monotherapie. Ernstige hypoglykemie werd voornamelijk waargenomen als semaglutide werd gebruikt met een sulfonylureumderivaat (1,2% van de patiënten, 0,03 voorvallen/patiëntjaar) of insuline (1,5% van de patiënten, 0,02 voorvallen/patiëntjaar). Er werden weinig episoden (0,1% van patiënten, 0,001 voorvallen/patiëntjaar) waargenomen bij semaglutide in combinatie met orale bloedglucoseverlagende geneesmiddelen anders dan sulfonylureumderivaten.
Hypoglykemie, geclassificeerd door de ADA (American Diabetes Association), trad op bij 11,3% (0,3 voorvallen/patiëntjaar) van de patiënten wanneer semaglutide 1 mg werd toegevoegd aan de SGLT2-remmer in SUSTAIN 9 vergeleken met 2,0% (0,04 voorvallen/patiëntjaar) van de met placebo behandelde patiënten. Ernstige hypoglykemie werd gemeld bij respectievelijk 0,7% (0,01 voorvallen/patiëntjaar) en 0% van de patiënten.
In een 40-weken durende fase 3b-studie bij patiënten die semaglutide 1 mg en 2 mg kregen, trad het merendeel van de hypoglykemie-episoden (45 van de 49 episoden) op wanneer semaglutide werd gebruikt in combinatie met een sulfonylureumderivaat of insuline. In het algemeen was er geen verhoogd risico op hypoglykemie met semaglutide 2 mg.
Gastro-intestinale bijwerkingen
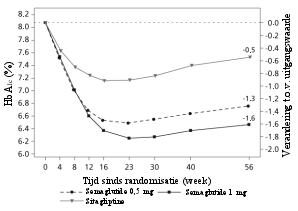
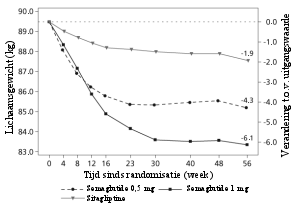
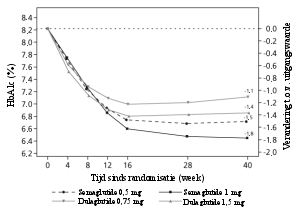
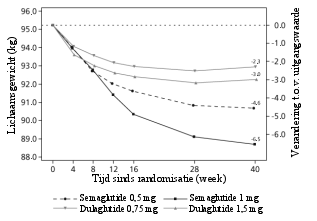
Van de patiënten behandeld met 0,5 mg en 1 mg trad misselijkheid op bij respectievelijk 17% en 19,9%, diarree bij 12,2% en 13,3% en braken bij 6,4% en 8,4% van de patiënten. De meeste bijwerkingen waren mild tot matig van aard en van korte duur. De bijwerkingen leidden bij 3,9% en 5% van de patiënten tot staken van de behandeling. De bijwerkingen werden het vaakst gemeld tijdens de eerste maanden van behandeling.
Patiënten met laag lichaamsgewicht ondervinden mogelijk meer gastro-intestinale bijwerkingen bij behandeling met semaglutide.
In een 40-weken durende fase 3b-studie bij patiënten die semaglutide 1 mg en 2 mg kregen, trad misselijkheid op in dezelfde verhouding bij patiënten die werden behandeld met respectievelijk semaglutide 1 mg en 2 mg. Diarree en braken trad op bij een groter deel van de patiënten die werden behandeld met semaglutide 2 mg vergeleken met semaglutide 1 mg. De gastro-intestinale bijwerkingen leidden tot stopzetting van de behandeling in dezelfde verhouding bij de behandelde groepen met semaglutide 1 mg en 2 mg.
In SUSTAIN 9 kwamen, bij gelijktijdig gebruik met een SGLT2-remmer, constipatie en gastro-oesofageale refluxziekte voor bij respectievelijk 6,7% en 4% van de patiënten die werden behandeld met semaglutide 1 mg, vergeleken met geen voorvallen bij de met placebo behandelde patiënten. De prevalentie van deze gebeurtenissen nam in de loop van de tijd niet af.
Patiënten met gastroparese die worden behandeld met semaglutide kunnen ernstigere of hevigere gastro-intestinale bijwerkingen ervaren.
Acute pancreatitis
De frequentie van, door beoordeling bevestigde, acute pancreatitis gemeld in fase 3a klinische studies was respectievelijk 0,3% voor semaglutide en 0,2% voor het vergelijkende middel. In de 2 jaar durende cardiovasculaire uitkomstenstudie was de frequentie van, door beoordeling bevestigde, acute pancreatitis 0,5% voor semaglutide en 0,6% voor placebo (zie rubriek 4.4).
Complicaties van diabetische retinopathie
Een 2 jaar durende klinische studie onderzocht 3.297 patiënten met diabetes type 2, met een hoog cardiovasculair risico, lange duur van de diabetes en onvoldoende gecontroleerde bloedglucose. In deze studie kwamen meer beoordeelde gevallen van complicaties van diabetische retinopathie voor bij patiënten behandeld met semaglutide (3%) in vergelijking tot placebo (1,8%). Dit werd waargenomen bij met insuline behandelde patiënten die bekend waren met diabetische retinopathie.
Het behandelverschil werd reeds in een vroeg stadium duidelijk en hield gedurende de studie aan. Systematische beoordeling van complicaties van diabetische retinopathie werd alleen uitgevoerd in de cardiovasculaire uitkomstenstudie.
In klinische studies tot maximaal 1 jaar waarbij 4.807 patiënten met diabetes type 2 betrokken waren, werden bijwerkingen met betrekking tot diabetische retinopathie gemeld bij ongeveer evenveel patiënten behandeld met semaglutide (1,7%) als met vergelijkende middelen (2,0%).
Niet-arteritische anterieure ischemische opticusneuropathie (NAION)
Resultaten uit verschillende grote epidemiologische studies geven aan dat blootstelling aan semaglutide bij volwassenen met diabetes type 2 geassocieerd wordt met een ongeveer tweevoudige toename van het relatieve risico op het ontwikkelen van NAION, wat overeenkomt met ongeveer 1 bijkomend geval per 10.000 patiëntjaren behandeling.
Staken van behandeling vanwege een bijwerking
De incidentie van het staken van de behandeling vanwege bijwerkingen was 6,1% en 8,7% voor patiënten behandeld met respectievelijk semaglutide 0,5 mg en 1 mg, versus 1,5% voor placebo. De meest frequente bijwerkingen die leidden tot het staken van de behandeling waren gastro-intestinaal van aard.
Reacties op de injectieplaats
Reacties op de injectieplaats (zoals injectieplaatsrash, erytheem) werden gemeld door 0,6% en 0,5% van de patiënten die respectievelijk semaglutide 0,5 mg en 1 mg kregen. Deze reacties waren doorgaans mild van aard.
Immunogeniciteit
In overeenstemming met de mogelijk immunogene eigenschappen van geneesmiddelen die eiwitten of peptiden bevatten, kunnen patiënten na behandeling met semaglutide antilichamen ontwikkelen. Het aandeel van patiënten dat positief testte op antilichamen tegen semaglutide op een willekeurig tijdstip na aanvang van de studie was laag (1−3%) en geen enkele patiënt had aan het einde van de studie neutraliserende antilichamen tegen semaglutide of antilichamen tegen semaglutide met endogeen GLP‑1-neutraliserend effect.
Hartslag verhoging
Verhoogde hartslag is waargenomen bij GLP‑1-receptoragonisten. In de fase 3a-studies zijn gemiddelde toenames van 1 tot 6 slagen per minuut (bpm) ten opzichte van een uitgangswaarde van 72 tot 76 bpm waargenomen bij patiënten behandeld met Ozempic. In een langetermijnstudie bij patiënten met cardiovasculaire risicofactoren had 16% van de met Ozempic behandelde patiënten een toename in hartslag van >10 bpm vergeleken met 11% van de patiënten die placebo kregen toegediend na 2 jaar behandeling.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
E-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd
Denemarken
8. NUMMERS VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/17/1251/002
EU/1/17/1251/003
EU/1/17/1251/004
EU/1/17/1251/005
EU/1/17/1251/006
EU/1/17/1251/010
EU/1/17/1251/011
EU/1/17/1251/012
EU/1/17/1251/013
EU/1/17/1251/014
EU/1/17/1251/015
10. DATUM VAN HERZIENING VAN DE TEKST
10/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
1
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3831138 | OZEMPIC 0,25MG SOL INJ 1,5ML VOORGEV.PEN 1 + 4 NLD | A10BJ06 | € 104,25 | - | Ja | € 2 | € 1 |
| 3831146 | OZEMPIC 1,00MG SOL INJ 3,0ML VOORGEV.PEN 1 + 4 NLD | A10BJ06 | € 104,25 | - | Ja | € 2 | € 1 |
| 3831153 | OZEMPIC 0,50MG SOL INJ 1,5ML VOORGEV.PEN 1 + 4 NLD | A10BJ06 | € 104,25 | - | Ja | € 2 | € 1 |