![]() Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
1. NAAM VAN HET GENEESMIDDEL
ADYNOVI 250 I.E./2 ml poeder en oplosmiddel voor oplossing voor injectie
ADYNOVI 500 I.E./2 ml poeder en oplosmiddel voor oplossing voor injectie
ADYNOVI 1 000 I.E./2 ml poeder en oplosmiddel voor oplossing voor injectie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
ADYNOVI 250 I.E./2 ml poeder en oplosmiddel voor oplossing voor injectie
Elke injectieflacon bevat nominaal 250 I.E. humane stollingsfactor VIII (rDNA), rurioctocog alfa pegol, overeenkomend met een concentratie van 125 I.E./ml na reconstitutie met 2 ml oplosmiddel.
ADYNOVI 500 I.E./2 ml poeder en oplosmiddel voor oplossing voor injectie
Elke injectieflacon bevat nominaal 500 I.E. humane stollingsfactor VIII (rDNA), rurioctocog alfa pegol, overeenkomend met een concentratie van 250 I.E./ml na reconstitutie met 2 ml oplosmiddel.
ADYNOVI 1 000 I.E./2 ml poeder en oplosmiddel voor oplossing voor injectie
Elke injectieflacon bevat nominaal 1 000 I.E. humane stollingsfactor VIII (rDNA), rurioctocog alfa pegol, overeenkomend met een concentratie van 500 I.E./ml na reconstitutie met 2 ml oplosmiddel.
De potentie (internationale eenheden, I.E.) wordt bepaald met de chromogene test. De specifieke activiteit van ADYNOVI is ongeveer 3 800-6 000 I.E./mg eiwit.
Rurioctocog alfa pegol (gePEGyleerde humane stollingsfactor VIII (rDNA) is een eiwit met 2332 aminozuren met een moleculair gewicht van ongeveer 280 kDa, geconjugeerd met een 20 kDa polyethyleenglycol (PEG). Het wordt geproduceerd middels recombinant-DNA-techniek in ovariumcellijnen van de Chinese hamster (‘Chinese Hamster Ovary’, CHO).
Hulpstof(fen) met bekend effect
Elke injectieflacon met poeder bevat 0,45 mmol (10 mg) natrium (zie rubriek 4.4).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder en oplosmiddel voor oplossing voor injectie (poeder voor oplossing voor injectie).
Poeder: wit tot gebroken wit, brokkelig poeder.
Oplosmiddel: heldere, kleurloze oplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Behandeling en profylaxe van bloedingen bij patiënten van 12 jaar en ouder met hemofilie A (congenitale factor VIII-deficiëntie).
4.2 Dosering en wijze van toediening
De behandeling moet plaatsvinden onder toezicht van een arts die ervaring heeft met de behandeling van hemofilie.
Niet eerder behandelde patiënten
De veiligheid en werkzaamheid van ADYNOVI bij niet eerder behandelde patiënten zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Controle tijdens de behandeling:
Aanbevolen wordt om gedurende de hele duur van de behandeling op geëigende wijze de factor VIII-niveaus te bepalen en te gebruiken als leidraad voor de toe te dienen dosis en de frequentie van herhaalde infusies. Individuele patiënten kunnen verschillend reageren op factor VIII, en bijvoorbeeld verschillende halfwaarde- en hersteltijden hebben. Indien de dosis wordt bepaald op basis van lichaamsgewicht, kan aanpassing voor patiënten met onder- of overgewicht nodig zijn. Vooral in het geval van grote chirurgische ingrepen is nauwkeurige monitoring van de substitutietherapie met stollingsanalyse (factor VIII-activiteit in plasma) onmisbaar.
Veldonderzoek heeft duidelijk gemaakt dat factor VIII-niveaus in plasma kunnen worden gecontroleerd door middel van een chromogene substraattest of een één-fase-stollingstest zoals standaard wordt gebruikt in klinische laboratoria.
Dosering
De dosis en duur van de substitutietherapie zijn afhankelijk van de ernst van de factor VIII-deficiëntie, de locatie en mate van de bloeding en de klinische toestand van de patiënt.
Het aantal toegediende eenheden factor VIII wordt uitgedrukt in internationale eenheden (I.E.), die zijn gerelateerd aan de huidige concentraatstandaard van de WHO (Wereldgezondheidsorganisatie) voor producten met factor VIII. De factor VIII-activiteit in plasma wordt uitgedrukt als een percentage (verhouding tot normaal menselijk plasma) of, bij voorkeur, in internationale eenheden (verhouding tot een internationale standaard voor factor VIII in plasma).
Eén internationale eenheid (I.E.) factor VIII-activiteit komt overeen met de hoeveelheid factor VIII in één ml normaal humaan plasma.
‘On demand’-behandeling
De vereiste dosis factor VIII wordt bepaald aan de hand van de empirische bevinding dat 1 I.E. factor VIII per kg lichaamsgewicht de factor VIII-activiteit in plasma doet stijgen met 2 I.E./dl. De vereiste dosis wordt bepaald aan de hand van de volgende formule:
Vereiste aantal internationale eenheden (I.E.) = lichaamsgewicht (kg) x gewenste stijging van factor VIII (%) x 0,5
De toe te dienen hoeveelheid en de frequentie van toediening moeten altijd worden bepaald op basis van de klinische werkzaamheid in individuele gevallen.
In geval van de volgende bloedingen mag de factor VIII-activiteit niet dalen tot onder het gegeven niveau van plasma-activiteit (uitgedrukt in % ten opzichte van de normale waarde of in I.E./dl) in de overeenkomstige periode.
De volgende tabel 1 kan dienen als leidraad voor de dosering bij bloedingen en tijdens een chirurgische ingreep:
Tabel 1: Leidraad voor de dosering bij bloedingen en tijdens een chirurgische ingreep
Ernst van de hemorragie/aard van de chirurgische ingreep | Vereiste factor VIII-activiteit (% of I.E./dl) | Frequentie van toediening (uren)/therapieduur (dagen) |
Hemorragie |
|
|
Beginnende hemartrose, bloeding van spier of bloeding in de mondholte. | 20 – 40 | Herhaal de injecties om de 12 tot 24 uur. Ten minste 1 dag, tot de bloeding stopt (de pijn weg is) of tot genezing van de wond is bereikt. |
Meer uitgebreide hemartrose, bloeding van spier of hematoom. | 30 – 60 | Herhaal de injecties om de 12 tot 24 uur gedurende 3 – 4 dagen of langer tot de pijn en de acute invaliditeit verdwenen zijn. |
Levensbedreigende hemorragieën. | 60 – 100 | Herhaal de injecties om de 8 tot 24 uur tot het levensgevaar geweken is. |
Chirurgische ingreep |
|
|
Klein | 30 – 60 | Om de 24 uur ten minste 1 dag, tot genezing van de wond bereikt is. |
Groot | 80 – 100 | Herhaal de injecties om de 8 tot 24 uur tot adequate genezing van de wond. Vervolgens behandeling voortzetten gedurende ten minste 7 dagen om de factor VIII-activiteit tussen 30% en 60% (I.E./dl) te houden. |
Profylaxe
Voor langetermijnprofylaxe is de aanbevolen dosering tweemaal per week 40 tot 50 I.E. ADYNOVI per kg lichaamsgewicht, bij intervallen van 3 tot 4 dagen. Aanpassing van doses en toedieningsintervallen kunnen worden overwogen op basis van bereikte factor VIII-niveaus en individuele bloedingsneiging (zie rubriek 5.1 en 5.2).
Pediatrische patiënten
De dosering bij pediatrische patiënten (12 tot 18 jaar) is bij ‘on demand’-behandeling gelijk aan die bij volwassen patiënten. De profylactische behandeling voor patiënten van 12 tot < 18 jaar is gelijk aan die voor volwassen patiënten. De huidige beschikbare gegevens voor patiënten onder de 12 jaar worden beschreven in rubriek 4.8, 5.1 en 5.2. Aanpassing van doses en toedieningsintervallen kunnen worden overwogen op basis van bereikte factor VIII-niveaus en individuele bloedingsneiging (zie rubriek 5.1 en 5.2).
Wijze van toediening
ADYNOVI is voor intraveneus gebruik.
De toedieningssnelheid moet worden bepaald zodat deze voor de patiënt aangenaam is, tot maximaal 10 ml/min.
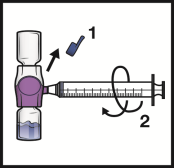
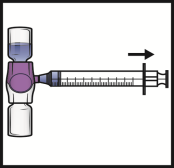
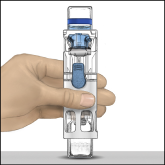
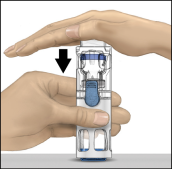
Voor instructies over reconstitutie van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof, het moedermolecuul octocog alfa of een van de in rubriek 6.1 vermelde hulpstof(fen).
Bekende allergische reactie op muizen- of hamstereiwit.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Overgevoeligheidsreacties of allergische reacties (zoals mogelijk angio-oedeem, branderig en stekend gevoel op de injectieplaats, koude rillingen, overmatig blozen, gegeneraliseerde urticaria, hoofdpijn, galbulten, hypotensie, lethargie, nausea, rusteloosheid, tachycardie, beklemd gevoel in de borst, tintelen, braken, piepen) zijn in zeldzame gevallen waargenomen en kunnen zich in sommige gevallen ontwikkelen tot ernstige anafylaxie (waaronder shock).
Bij patiënten met hemofilie A die zijn behandeld met factor VIII, waaronder ADYNOVI, kunnen zich neutraliserende antistoffen (remmers) vormen. Indien dergelijke remmers voorkomen, uit zich dit in een onvoldoende klinische respons. In deze gevallen wordt aangeraden contact op te nemen met een gespecialiseerd hemofiliecentrum (zie rubriek 5.1).
Tabel met bijwerkingen
De veiligheid van ADYNOVI werd beoordeeld bij 365 eerder behandelde patiënten met ernstige hemofilie A (factor VIII minder dan 1% van normaal), die ten minste één dosis ADYNOVI kregen tijdens zes voltooide multicenter, prospectieve, open-label klinische onderzoeken en één lopend klinisch onderzoek.
De bijwerkingen in de volgende tabel zijn gerangschikt op systeem/orgaanklasse volgens gegevensbank MedDRA en op MedDRA-voorkeursterm.
De frequenties zijn vastgesteld volgens de volgende conventie: Zeer vaak (≥1/10); Vaak (≥1/10); Vaak (1/100, <1/10); Soms (≥1/1.000, <1/100); Zelden (≥1/10.000, <1/1.000); Zeer zelden (<1/10.000); Niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen iedere frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Tabel 2: Bijwerkingen gemeld voor ADYNOVI
Systeem/orgaanklasse | Bijwerkingen | Frequentie |
Bloed- en lymfestelselaandoeningen | Factor VIII-remming | Soms (PTP’s)* |
Immuunsysteemaandoeningen | Overgevoeligheid | Soms |
Anafylactische reactie** | Niet bekend | |
Zenuwstelselaandoeningen | Hoofdpijn | Zeer vaak |
Duizeligheid | Vaak | |
Oogaandoeningen | Oculaire hyperemie | Soms |
Bloedvataandoeningen | Overmatig blozen | Soms |
Maagdarmstelselaandoeningen | Diarree | Vaak |
Nausea | Vaak | |
Huid- en onderhuidaandoeningen | Rash | Vaak |
Rash pruritus | Soms | |
Urticaria | Vaak | |
Onderzoeken | Eosinofielentelling verhoogd | Soms |
Letsels, intoxicaties en verrichtingscomplicaties | Infusie gerelateerde reactie | Soms |
* De frequentie is gebaseerd op onderzoeken met alle producten met factor VIII waaraan patiënten met ernstige hemofilie A deelnamen. PTP’s = previously treated patients (eerder behandelde patiënten). | ||
Beschrijving van geselecteerde bijwerkingen
Overgevoeligheid
De waargenomen overgevoeligheidsbijwerking was een lichte, voorbijgaande, niet‑ernstige rash, die zich voordeed bij één tweejarige patiënt die een eerdere rash had gekregen tijdens behandeling met ADYNOVI.
Pediatrische patiënten
Frequentie, type en ernst van bijwerkingen bij kinderen zijn naar verwachting gelijk aan die bij volwassenen. De veiligheid van ADYNOVI werd beoordeeld bij 38 personen < 6 jaar en 34 personen van 6 tot 12 jaar met in totaal respectievelijk 2 880 en 2 975 blootstellingsdagen. De gemiddelde (SD) leeftijd bedroeg respectievelijk 3,3 (1,55) en 8,1 (1,92) jaar.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
Afdeling Vigilantie
Galileelaan 5/03 | Postbus 97 |
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Baxalta Innovations GmbH
Industriestrasse 67
A-1221 Wenen
Oostenrijk
medinfoEMEA@takeda.com
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/17/1247/001
EU/1/17/1247/002
EU/1/17/1247/005
EU/1/17/1247/006
EU/1/17/1247/009
EU/1/17/1247/010
10. DATUM VAN HERZIENING VAN DE TEKST
07/2023
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu/
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3772860 | ADYNOVI 250IE/2ML PDR+SOLV OPL INJ FL INJ 1+1 | B02BD02 | € 230,53 | - | Ja | - | - |
| 3772878 | ADYNOVI 500IE/2ML PDR+SOLV OPL INJ FL INJ 1+1 | B02BD02 | € 446,83 | - | Ja | € 2 | € 1 |
| 3772886 | ADYNOVI 1000IE/2ML PDR+SOLV OPL INJ FL INJ 1+1 | B02BD02 | € 877,27 | - | Ja | € 2 | € 1 |