1. NAAM VAN HET GENEESMIDDEL
Levorichter 30, 30 microgram / 150 microgram omhulde tabletten.
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke tablet bevat 150 microgram levonorgestrel en 30 microgram ethinyloestradiol.
Hulpstoffen met bekend effect: elke tablet bevat 33 mg lactosemonohydraat en 22,46 mg sucrose.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Omhulde tablet.
Witte, biconvexe, ronde tabletten.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Orale hormonale contraceptie.
Bij de beslissing om Levorichter 30 voor te schrijven moet rekening worden gehouden met de huidige risicofactoren van de individuele vrouw, in het bijzonder met de risicofactoren voor veneuze trombo-embolie (VTE) en hoe het risico op VTE met Levorichter 30 zich verhoudt tot het risico met andere gecombineerde hormonale anticonceptiva (CHA’s) (zie rubrieken 4.3 en 4.4).
4.2 Dosering en wijze van toediening
Dosering
Hoe Levorichter 30 innemen?
De tabletten moeten elke dag oraal op ongeveer hetzelfde uur worden ingenomen in de volgorde die op de blisterstrip staat, indien nodig met wat vloeistof.
Een tablet per dag innemen gedurende 21 dagen na elkaar. Elke volgende blisterstrip beginnen na een periode van 7 dagen zonder tabletten. Tijdens deze periode zal over het algemeen een bloeding optreden. Over het algemeen zal deze bloeding beginnen 2 of 3 dagen na inname van de laatste tablet. Het kan gebeuren dat de bloeding nog niet gedaan is bij de start van de volgende blisterstrip.
Hoe het gebruik van Levorichter 30 starten
Geen vroegere inname van een hormonaal anticonceptivum (tijdens de vorige maand)
De eerste tablet wordt ingenomen op dag 1 van de natuurlijke cyclus van de vrouw (op de eerste dag van haar maandstonden).
Overschakeling van een ander gecombineerd hormonaal anticonceptivum (gecombineerde orale anticonceptiva (COA), intravaginale ring, transdermaal product)
De eerste tablet wordt ingenomen op de dag na de dosis van de laatste actieve tablet van het vorige anticonceptivum, of uiterlijk op de dag na de periode waarin u normaal geen tabletten neemt.
Als een vaginale ring of een transdermale pleister is gebruikt, wordt de eerste tablet ingenomen op de dag van verwijdering, of uiterlijk als de volgende ring of pleister zou worden geplaatst.
Overschakeling van producten op basis van een progestageen (minipil, injectie, implantaat of van een intra-uterien systeem (IUS) dat progestagenen afgeeft)
Overschakeling van een minipil kan om het even wanneer tijdens de cyclus plaatsvinden; Levorichter 30 omhulde tablet moet worden gestart de dag na stopzetting.
Overschakeling van een implantaat of een IUS moet gebeuren op de dag van verwijdering en in geval van een injecteerbaar anticonceptivum op de dag dat de nieuwe injectie zou moeten worden gegeven.
In alle gevallen wordt aanbevolen een aanvullende contraceptieve methode te gebruiken tijdens de eerste 7 dagen van de behandeling.
Na een abortus/miskraam tijdens het 1e trimester
De vrouw kan onmiddellijk starten met de tabletten. In dat geval moeten geen aanvullende contraceptieve maatregelen worden genomen.
Na een bevalling of een abortus/miskraam tijdens het 2e trimester
Voor vrouwen die geen borstvoeding geven, wordt aanbevolen om te starten 21 tot 28 dagen na een bevalling of miskraam in het 2e trimester gezien het verhoogde risico van trombo-embolie tijdens het postpartum. Als de vrouw later begint, zal haar aanbevolen worden om tevens een barrièrevoorbehoedmiddel te gebruiken tijdens de eerste 7 dagen van inname van de tabletten. Maar als ze al seksuele betrekkingen heeft gehad, moet eerst een zwangerschap worden uitgesloten vooraleer te starten met de tabletten ofwel moet gewacht worden tot de volgende maandstonden.
Bortsvoeding
Zie rubriek 4.6
Inname van de tabletten vergeten
De anticonceptieve werking kan afnemen bij een vergeten dosis, vooral als de dosis >12 uur vergeten is.
Als de vrouw gedurende minder dan 12 uur een tablet is vergeten in te nemen, komt de contraceptieve doeltreffendheid niet in het gedrang daardoor. De vrouw moet de tablet innemen zodra ze eraan denkt en de overige tabletten moeten op het normale tijdstip worden ingenomen.
Als de vrouw gedurende meer dan 12 uur een tablet is vergeten in te nemen, kan de contraceptieve doeltreffendheid in het gedrang komen. Als de vrouw vergeten is om tabletten in te nemen, zijn de volgende twee basisregels van toepassing:
1. De inname van de tabletten mag nooit meer dan 7 dagen worden uitgesteld.
2. De ononderbroken inname van tabletten gedurende 7 dagen is vereist om de hypothalamus-hypofyse-ovariumas voldoende te onderdrukken.
In de praktijk worden de volgende adviezen gegeven:
Week 1:
De vrouw neemt de laatste tablet die ze vergeten is, in zodra ze eraan denkt, ook al wil dat zeggen dat ze dan 2 tabletten tegelijkertijd moet innemen. De volgende tabletten neemt ze dan in op het gebruikelijke tijdstip.
De volgende 7 dagen moet ze ook een barrièrevoorbehoedmiddel gebruiken (bv. een condoom). Als ze de laatste 7 dagen seksuele betrekkingen heeft gehad, moet worden gedacht aan de mogelijkheid van zwangerschap. Hoe meer pillen de vrouw vergeten is en hoe korter dat bij de normale periode zonder pillen was, des te hoger is het risico van zwangerschap.
Week 2:
De vrouw neemt de laatste tablet die ze vergeten is, in zodra ze eraan denkt, ook al wil dat zeggen dat ze dan 2 tabletten tegelijkertijd moet innemen. De volgende tabletten neemt ze dan in op het gebruikelijke tijdstip.
Als de tabletten correct werden ingenomen de laatste 7 dagen vóór de vergeten tablet, hoeft ze geen extra contraceptieve maatregelen te nemen. Maar als dat niet zo is of als ze meerdere tabletten vergeten heeft, zal de vrouw aanbevolen worden om tevens een barrièrevoorbehoedmiddel (bv. een condoom) te gebruiken gedurende 7 dagen.
Week 3:
Het risico van verminderde betrouwbaarheid dreigt, aangezien de periode zonder tabletten nadert. Toch is het mogelijk om het verlies van contraceptieve doeltreffendheid te beperken door de inname van de tabletten aan te passen. Ze hoeft dus niet per se extra contraceptieve maatregelen te nemen als ze een van de onderstaande alternatieven volgt op voorwaarde dat ze alle tabletten correct heeft ingenomen de laatste 7 dagen vóór de vergeten tablet. Maar als dat niet zo is, zal de vrouw aanbevolen worden om het eerste van de volgende twee alternatieven te volgen en tevens een barrièrevoorbehoedmiddel (bv. een condoom) te gebruiken gedurende 7 dagen.
- De vrouw neemt de laatste tablet die ze vergeten is, in zodra ze eraan denkt, ook al wil dat zeggen dat ze dan 2 tabletten tegelijkertijd moet innemen. De volgende tabletten neemt ze dan in op het gebruikelijke tijdstip. Ze begint de volgende blisterstrip meteen na inname van de laatste tablet van de lopende blisterstrip, dus zonder onderbreking tussen de twee blisterstrips. Het is weinig waarschijnlijk dat er zich een dervingsbloeding zal voordoen voor het einde van de tweede blisterstrip, maar spotting of secundair bloedverlies uit de baarmoeder zijn mogelijk tijdens inname van de tabletten.
- Het kan de vrouw ook aangeraden worden om de lopende blisterstrip stop te zetten. Ze neemt dan geen tabletten in gedurende hoogstens 7 dagen, met inbegrip van de dagen dat ze vergeten is de tabletten in te nemen, en ze gaat dan voort met de volgende blisterstrip.
Als de vrouw tabletten vergeten is en als er geen dervingsbloeding optreedt tijdens de eerste normale periode zonder tabletten, moet worden gedacht aan de mogelijkheid van zwangerschap.
Advies in geval van maag-darmstoornissen
Bij verschijnselen van ernstige maag-darmsymptomen (bv. braken of diarree) worden de werkzame bestanddelen wellicht niet volledig geabsorbeerd en moeten er aanvullende anticonceptiemaatregelen getroffen worden.
In geval van braken of ernstige diarree binnen 3 tot 4 uur na inname van een tablet moet u ter vervanging zo snel mogelijk een nieuwe tablet innemen. U moet de nieuwe tablet zo mogelijk innemen binnen 12 uur na het gebruikelijke uur van inname.
Als er meer dan 12 uur zijn verstreken, gelden dezelfde instructies worden als na het overslaan van een tablet (zie rubriek 4.2).
Wanneer de vrouw haar gebruikelijke manier van innemen niet wil veranderen, moet ze de vereiste extra pil(len) uit een andere blisterverpakking nemen.
Hoe de menstruele bloeding vervroegen of uitstellen
Om de menstruele bloeding uit te stellen, moet de vrouw voortgaan met de volgende blisterstrip van Levorichter 30 na inname van de laatste tablet van de lopende blisterstrip, dus zonder tabletvrije periode. Ze kan de maandstonden uitstellen zolang ze wil tot het einde van de tweede blisterstrip. Tijdens die periode kunnen secundaire baarmoederbloedingen (dervingsbloeding of spotting) optreden. Ze begint dan Levorichter 30 opnieuw regelmatig in te nemen na de gebruikelijke periode van 7 dagen zonder tabletten.
Om de menstruele bloeding te vervroegen opdat die zou beginnen op een andere dag van de week dan de vrouw gewoon is, kan haar aangeraden worden om de tabletvrije periode in te korten met het gewenste aantal dagen. Hoe korter de stopperiode, des de groter is de kans dat er geen dervingsbloeding zal optreden en dat de vrouw tijdens inname van de tabletten van de tweede blisterstrip wat bloedverlies zal vertonen (dat is ook zo als ze de maandstonden probeert uit te stellen). Het is belangrijk te benadrukken dat ze de tabletvrije periode niet mag verlengen.
Pediatrische patiënten
Er is geen relevante toepassing van Levorichter 30 bij pediatrische patiënten voor de puberteitsleeftijd.
Wijze van toediening
Voor oraal gebruik
4.3 Contra-indicaties
Gecombineerde orale anticonceptiva (COA’s) mogen niet worden gebruikt in een van de onderstaande gevallen. Als een van de volgende aandoeningen voor het eerst optreedt tijdens de inname van COA’s, moet het gebruik van de pil meteen worden stopgezet:
- Aanwezigheid van of risico op veneuze trombo-embolie (VTE)
- Veneuze trombo-embolie – bestaande VTE (bij antistollingsmiddelen) of eerder doorgemaakte VTE (bijv. diepe veneuze trombose [DVT] of longembolie [LE])
- Bekende erfelijke of verworven predispositie voor veneuze trombo-embolie, bijvoorbeeld APC-resistentie, (waaronder factor V-Leiden), antitrombine-III-deficiëntie, proteïne C-deficiëntie, proteïne S-deficiëntie
- Zware operatie met langdurige immobilisatie (zie rubriek 4.4)
- Een hoog risico op veneuze trombo-embolie door de aanwezigheid van meerdere risicofactoren (zie rubriek 4.4)
- Aanwezigheid van of risico op arteriële trombo-embolie (ATE)
- Arteriële trombo-embolie – bestaande arteriële trombo-embolie, eerder doorgemaakte arteriële trombo-embolie (bijv. myocardinfarct) of prodromale aandoening (bijv. angina pectoris)
- Cerebrovasculaire ziekte – bestaande beroerte, eerder doorgemaakte beroerte of prodromale aandoening (bijv. transient ischaemic attack (TIA))
- Bekende erfelijke of verworven predispositie voor arteriële trombo-embolie, bijvoorbeeld hyperhomocysteïnemie en antifosfolipiden-antistoffen (anticardiolipine-antistoffen, lupusanticoagulans)
- Voorgeschiedenis van migraine met focale neurologische symptomen
- Een hoog risico op arteriële trombo-embolie als gevolg van meerdere risicofactoren (zie rubriek 4.4) of door de aanwezigheid van een ernstige risicofactor, zoals:
• diabetes mellitus met vasculaire symptomen
• ernstige hypertensie
• ernstige dislipoproteïnemie
- Ernstige leverziekte, huidig of in het verleden, zolang de leverfunctiewaarden nog niet genormaliseerd zijn
- Aanwezigheid of antecedenten van levertumoren (goedaardig of kwaadaardig)
- Bekende hormoonafhankelijke kwaadaardige tumor (bijv. van de geslachtsorganen of de borsten) of een vermoeden daarvan
- Niet-gediagnosticeerde vaginale bloeding
- Gelijktijdig gebruik met sint-janskruid (zie rubriek 4.5)
- Overgevoeligheid voor de werkzame stoffen levonorgestrel, ethinyloestradiol of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Levorichter 30 is gecontra-indiceerd for gelijktijdig gebruik met geneesmiddelen die ombitasvir/paritaprevir/ritonavir, dasabuvir, glecaprevir/pibrentasvir en sofosbuvir/velpatasvir/voxilaprevir bevatten (zie rubriek 4.4 en 4.5).
4.8 Bijwerkingen
De volgende bijwerkingen zijn gerapporteerd tijdens het gebruik van ethinyloestradiol/levonorgestrel:
Systeem-orgaanklasse | Vaak | Soms ( 1/1.000 tot < 1/100) | Zelden ( 1/10.000 tot <1/1.000) | Zeer zelden (< 1/10.000) | Niet bekend (frequentie kan met de beschikbare gegevens niet worden bepaald) |
Benigne, maligne en niet-gespecificeerd neoplasmata (inclusief cysten en poliepen) |
|
|
| Hepatocellulair carcinoom, goedaardige levertumoren (bijv. focale nodulaire hyperplasie, leveradenoom) |
|
Infecties en parasitaire aandoeningen | Vaginitis met inbegrip van vaginale candidiase |
|
|
|
|
Immuunziekten |
|
| Anafylactische reacties met zeer zeldzame gevallen van urticaria, angio-oedeem, circulatoire en ernstige respiratoire stoornissen | Exacerbatie van lupus erythematodes disseminatus | Verergering van de symptomen van erfelijk en verworven angio-oedeem |
Voedings- en stofwisselingsstoornissen |
| Veranderde eetlust (toename of afname) | Glucose-intolerantie | Exacerbatie van porfyrie |
|
Psychische stoornissen | Stemmingsschommelingen met inbegrip van depressie, gewijzigde |
|
|
|
|
Zenuwstelselaandoeningen | Zenuwachtigheid, duizeligheid |
|
| Toename van chorea |
|
Oogaandoeningen |
|
| Intolerantie van contactlenzen | Neuritis optica, trombose van een bloedvat van het netvlies |
|
Bloedvataandoeningen |
| Hypertensie | Veneuze trombo-embolie en arteriële trombo-embolie | Verergering van spataders |
|
Maag-darmstelselaandoeningen | Nausea, braken, buikpijn | Buikkrampen, opgeblazen gevoel |
| Ischemische colitis | Inflammatoire darmaandoening (ziekte van Crohn, colitis ulcerosa) |
Lever- en galaandoeningen |
|
| Cholestatische icterus | Pancreatitis, | Hepatocellulaire aandoening (bijv. hepatitis, abnormale leverfunctie) |
Huid- en onderhuidaandoeningen | Acne | Huiduitslag, chloasma (melasma) die kan persisteren, hirsutisme, alopecie | Erythema nodosum | Erythema multiforme |
|
Nier- en urinewegaandoeningen |
|
|
| Hemolytisch uremisch syndroom |
|
Voortplantingsstelsel- en borstaandoeningen | Pijn in de borsten, gevoeligheid van de borsten, zwelling en secreties, dysmenorroe, gewijzigde menstruatie, gewijzigd ectropion en vaginale secreties, amenorroe |
|
|
|
|
Algemene aandoeningen en toedieningsplaatsstoornissen | Vochtretentie/oedeem, gewichtsverandering (stijging of daling) |
|
|
|
|
Onderzoeken |
| Veranderde plasmalipiden met inbegrip van hypertriglyceridemie |
| Daling van folaatspiegels in het serum |
|
Beschrijving van geselecteerde bijwerkingen
Er is een verhoogd risico waargenomen op arteriële en veneuze trombotische en trombo-embolische
voorvallen, waaronder myocardinfarct, beroerte, transiënte ischemische aanvallen, veneuze trombose en longembolie bij vrouwen die CHC’s gebruikten. Hier wordt in rubriek 4.4 dieper op ingegaan.
De volgende ernstige bijwerkingen zijn gerapporteerd bij COA-gebruiksters en worden besproken in de rubriek 4.4 Bijzondere waarschuwingen en voorzorgen bij gebruik:
- Veneuze trombo-embolie
- Arteriële trombo-embolie
- Hypertensie
- Baarmoederhalskanker
- Levertumoren
- Huid- en onderhuidaandoeningen: chloasma, erythema nodosum
- Ziekte van Crohn, colitis ulcerosa, porfyrie, systemische lupus erythematodes, herpes gestationis, sydenham-chorea, hemolytisch uremisch syndroom, cholestatische icterus.
Er worden iets meer gevallen van borstkanker gediagnosticeerd bij COA-gebruiksters. Aangezien borstkanker zeldzaam is bij vrouwen jonger dan 40 jaar, stijgt het aantal gevallen weinig in vergelijking met het totale risico van borstkanker. Het is niet bewezen dat er een verband bestaat met COA. Voor meer informatie zie rubrieken 4.3 en 4.4.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België:
Federaal agentschap voor geneesmiddelen en gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
Luxemburg:
Centre Régional de Pharmacovigilance de Nancy of Division de la pharmacie et des médicaments de la Direction de la santé
website : www.guichet.lu/pharmacovigilance
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Gedeon Richter Plc.
Gyömrıi út 19-21
H-1103 Boedapest
Hongarije
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE285232
10. DATUM VAN HERZIENING VAN DE TEKST
02/2025
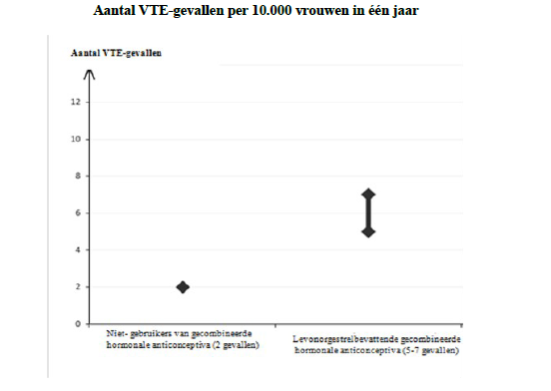
[1] Middelste punt van het bereik ('mid-point of range') van 5-7 per 10.000 vrouwjaren, op basis van een relatief risico voor levonorgestrelbevattende gecombineerde hormonale anticonceptiva versus niet-gebruik van ongeveer 2,3 tot 3,6
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1625516 | LEVORICHTER 30 COMP ENROBES 3 X 21 | G03AA07 | € 6,66 | - | Ja | - | - |
| 2383107 | LEVORICHTER 30 COMP ENROBES 13 X 21 | G03AA07 | € 20,08 | - | Ja | - | - |
| 2383115 | LEVORICHTER 30 COMP ENROBES 6 X 21 | G03AA07 | € 12,67 | - | Ja | - | - |