1. NAAM VAN HET GENEESMIDDEL
Abilify Maintena 300 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
Abilify Maintena 400 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
Abilify Maintena 300 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte in een voorgevulde spuit
Abilify Maintena 400 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte in een voorgevulde spuit
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Abilify Maintena 300 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
Elke injectieflacon bevat 300 mg aripiprazol.
Abilify Maintena 400 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
Elke injectieflacon bevat 400 mg aripiprazol.
Abilify Maintena 300 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte in een voorgevulde spuit
Elke voorgevulde spuit bevat 300 mg aripiprazol.
Abilify Maintena 400 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte in een voorgevulde spuit
Elke voorgevulde spuit bevat 400 mg aripiprazol.
Na reconstitutie bevat elke ml suspensie 200 mg aripiprazol.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
Poeder: wit tot gebroken wit
Oplosmiddel: heldere oplossing
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Abilify Maintena is geïndiceerd voor onderhoudsbehandeling van schizofrenie bij volwassen patiënten die gestabiliseerd zijn met oraal aripiprazol.
4.2 Dosering en wijze van toediening
Dosering
Patiënten die nooit aripiprazol hebben gebruikt, dienen eerst oraal aripiprazol te verdragen voordat behandeling met Abilify Maintena wordt ingesteld.
De dosis Abilify Maintena hoeft niet te worden getitreerd.
De aanvangsdosis kan worden toegediend door een van de volgende twee schema's te volgen:
• Beginnen met één injectie: op de aanvangsdag dient één injectie met Abilify Maintena 400 mg te worden toegediend en de behandeling dient gedurende 14 opeenvolgende dagen te worden voortgezet met 10 mg tot 20 mg oraal aripiprazol per dag om de therapeutische concentraties aripiprazol tijdens de aanvang van de behandeling te onderhouden.
• Beginnen met twee injecties: op de aanvangsdag dienen twee afzonderlijke injecties met Abilify Maintena 400 mg te worden toegediend op twee verschillende injectieplaatsen (zie Wijze van toediening), samen met één dosis oraal aripiprazol van 20 mg.
Na aanvang van de injectie bedraagt de aanbevolen onderhoudsdosis van Abilify Maintena 400 mg. Abilify Maintena 400 mg dient eenmaal per maand als enkelvoudige injectie te worden toegediend (niet eerder dan 26 dagen na de vorige injectie). Als er bij de dosis van 400 mg bijwerkingen optreden, dient te worden overwogen om de dosis te verlagen tot 300 mg eenmaal per maand.
Overgeslagen doses
Overgeslagen doses | |
Timing van overgeslagen dosis | Actie |
Indien de 2e of 3e dosis is overgeslagen en de tijd die verstreken is sinds de laatste injectie is: |
|
> 4 weken en < 5 weken | De injectie dient zo spoedig mogelijk te worden toegediend, waarna het schema met maandelijkse injecties dient te worden hervat. |
> 5 weken | Tegelijkertijd toegediend oraal aripiprazol dient gedurende 14 dagen te worden herstart bij de volgende toegediende injectie of twee afzonderlijke injecties die tegelijkertijd worden gegeven, samen met een enkelvoudige dosis oraal aripiprazol van 20 mg. Het schema met maandelijkse injecties dient vervolgens te worden hervat. |
Indien de 4e of een latere dosis is overgeslagen (d.w.z. na het bereiken van steady-state) en de tijd die verstreken is sinds de laatste injectie is: |
|
> 4 weken en < 6 weken | De injectie dient zo spoedig mogelijk te worden toegediend, waarna het schema met maandelijkse injecties dient te worden hervat. |
> 6 weken | Tegelijkertijd toegediend oraal aripiprazol dient gedurende 14 dagen te worden herstart bij de volgende toegediende injectie of twee afzonderlijke injecties die tegelijkertijd worden gegeven, samen met een enkelvoudige dosis oraal aripiprazol van 20 mg. Het schema met maandelijkse injecties dient vervolgens te worden hervat. |
Speciale populaties
Ouderen
De veiligheid en werkzaamheid van Abilify Maintena 400 mg/300 mg bij de behandeling van schizofrenie bij patiënten in de leeftijd van 65 jaar of ouder zijn niet vastgesteld (zie rubriek 4.4).
Nierfunctiestoornis
De dosis hoeft niet te worden aangepast voor patiënten met een nierfunctiestoornis (zie rubriek 5.2).
Leverfunctiestoornis
De dosis hoeft niet te worden aangepast voor patiënten met een lichte tot matig ernstige leverfunctiestoornis. Voor patiënten met een ernstige leverfunctiestoornis zijn er onvoldoende gegevens beschikbaar om aanbevelingen op te stellen. Bij deze patiënten dient voorzichtigheid te worden betracht bij de dosering. Het orale preparaat dient de voorkeur te krijgen (zie rubriek 5.2).
Bekende trage CYP2D6-metaboliseerders
Bij patiënten van wie bekend is dat ze trage CYP2D6-metaboliseerders zijn:
• Beginnen met één injectie: de aanvangsdosis dient Abilify Maintena 300 mg te zijn en de behandeling dient gedurende 14 opeenvolgende dagen te worden voortgezet met de voorgeschreven dosis oraal aripiprazol per dag. De onderhoudsdosis dient Abilify Maintena 300 mg eenmaal per maand te zijn.
• Beginnen met twee injecties: de aanvangsdosis dient twee afzonderlijke injecties met Abilify Maintena 300 mg te zijn (zie Wijze van toediening), samen met een enkelvoudige dosis van de eerder voorgeschreven dosis oraal aripiprazol. De onderhoudsdosis dient Abilify Maintena 300 mg eenmaal per maand te zijn.
Bij patiënten van wie bekend is dat ze trage CYP2D6-metaboliseerders zijn en gelijktijdig een sterke CYP3A4-remmer gebruiken:
• Beginnen met één injectie: de aanvangsdosis dient te worden verlaagd tot 200 mg (zie rubriek 4.5) en de behandeling dient gedurende 14 opeenvolgende dagen te worden voortgezet met de voorgeschreven dosis oraal aripiprazol per dag.
• Beginnen met twee injecties mag niet worden gebruikt bij patiënten van wie bekend is dat ze trage CYP2D6-metaboliseerders zijn en gelijktijdig een sterke CYP3A4-remmer gebruiken.
Zie de onderstaande tabel voor de aanbevolen onderhoudsdosis Abilify Maintena na de aanvangsinjectie. Abilify Maintena 400 mg en 300 mg dient eenmaal per maand als enkelvoudige injectie te worden toegediend (niet eerder dan 26 dagen na de vorige injectie).
Aanpassingen van de onderhoudsdosis vanwege interacties met CYP2D6- en/of CYP3A4-remmers en/of CYP3A4-inductoren
De onderhoudsdosis dient te worden aangepast bij patiënten die gelijktijdig gedurende meer dan 14 dagen sterke CYP3A4-remmers of sterke CYP2D6-remmers gebruiken. Als het gebruik van de CYP3A4-remmer of CYP2D6-remmer wordt gestopt, kan het zijn dat de dosis moet worden verhoogd tot de voorgaande dosis (zie rubriek 4.5). In het geval dat er ondanks dosisaanpassingen van Abilify Maintena bijwerkingen optreden, dient de noodzaak om gelijktijdig CYP2D6- of CYP3A4-remmers te gebruiken opnieuw te worden beoordeeld.
Gelijktijdig gebruik van CYP3A4-inductoren en Abilify Maintena 400 mg of 300 mg gedurende meer dan 14 dagen dient te worden vermeden, omdat de concentraties aripiprazol in het bloed worden verlaagd en lager kunnen worden dan de effectieve concentraties (zie rubriek 4.5).
Aanpassingen van de onderhoudsdosis van Abilify Maintena bij patiënten die gelijktijdig gedurende meer dan 14 dagen sterke CYP2D6-remmers, sterke CYP3A4-remmers en/of CYP3A4-inductoren gebruiken
| Aangepaste maandelijkse dosis |
Patiënten die Abilify Maintena 400 mg gebruiken | |
Sterke CYP2D6-remmers of sterke CYP3A4-remmers | 300 mg |
Sterke CYP2D6-remmers en sterke CYP3A4-remmers | 200 mg* |
CYP3A4-inductoren | Gebruik vermijden |
Patiënten die Abilify Maintena 300 mg gebruiken | |
Sterke CYP2D6-remmers of sterke CYP3A4-remmers | 200 mg* |
Sterke CYP2D6-remmers en sterke CYP3A4-remmers | 160 mg* |
CYP3A4-inductoren | Gebruik vermijden |
* 200 mg en 160 mg kunnen uitsluitend worden verkregen via aanpassing van het injectievolume door gebruik te maken van Abilify Maintena poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
Pediatrische patiënten
De veiligheid en werkzaamheid van Abilify Maintena 400 mg/300 mg bij kinderen en adolescenten in de leeftijd van 0 tot 17 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Abilify Maintena 400 mg en 300 mg is uitsluitend bedoeld voor intramusculair gebruik en mag niet intraveneus of subcutaan worden toegediend. Het mag alleen worden toegediend door een beroepsbeoefenaar in de gezondheidszorg.
De suspensie moet langzaam worden toegediend als een enkelvoudige injectie (de dosis mag niet worden opgedeeld) in de bilspier of de deltaspier. Voorzichtigheid is geboden om onbedoelde injectie in een bloedvat te voorkomen.
Als met de twee injecties wordt begonnen, injecteer dan op twee verschillende plaatsen in twee verschillende spieren. Geef beide injecties NIET gelijktijdig in dezelfde deltaspier of bilspier. Geef de injecties bij bekende trage CYP2D6-metaboliseerders ofwel in twee verschillende deltaspieren of in één deltaspier en één bilspier. Injecteer NIET in twee bilspieren.
Volledige instructies voor het gebruik en hanteren van Abilify Maintena 400 mg en 300 mg worden in de bijsluiter gegeven (informatie bedoeld voor beroepsbeoefenaren in de gezondheidszorg).
Voor instructies over reconstitutie van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof(fen) of voor een van de in rubriek 6.1 vermelde hulpstof(fen).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest frequent waargenomen bijwerkingen die bij ≥ 5 % van de patiënten zijn gemeld in twee dubbelblinde gecontroleerde langdurige klinische onderzoeken met Abilify Maintena 400 mg/300 mg waren gewichtstoename (9,0 %), acathisie (7,9 %), insomnia (5,8 %) en injectieplaatspijn (5,1 %).
Bijwerkingen weergegeven in tabelvorm
De incidenties van de bijwerkingen die geassocieerd zijn met behandeling met aripiprazol zijn weergegeven in de onderstaande tabel. De tabel is gebaseerd op de bijwerkingen die zijn gemeld tijdens klinische onderzoeken en in de postmarketingfase.
Alle bijwerkingen worden weergegeven per systeem/orgaanklasse en frequentie: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen elke frequentiegroep zijn de bijwerkingen gerangschikt naar afnemende ernst.
De onder de frequentie ‘niet bekend’ vermelde bijwerkingen werden in de postmarketingfase gemeld.
| Vaak | Soms | Niet bekend |
Bloed- en lymfestelsel-aandoeningen |
| Neutropenie | Leukopenie |
Immuunsysteem-aandoeningen |
| Overgevoeligheid | Allergische reactie (bijv. anafylactische reactie, angio-oedeem met inbegrip van gezwollen tong, tongoedeem, gezichtsoedeem, pruritus of urticaria) |
Endocriene aandoeningen |
| Bloedprolactine verlaagd | Diabetisch hyperosmolair coma |
Voedings- en stofwisselingsstoornissen | Gewichtstoename | Hyperglykemie | Anorexie |
Psychische stoornissen | Agitatie | Zelfmoordgedachte | Gelukte zelfmoord |
Zenuwstelsel-aandoeningen | Extrapiramidale aandoening | Dystonie | Neuroleptisch maligne syndroom |
Oogaandoeningen |
| Oculogyrische crisis |
|
Hartaandoeningen |
| Ventriculaire extrasystoles | Plotseling onverklaard overlijden |
Bloedvataandoeningen |
| Hypertensie | Syncope |
Ademhalingsstelsel-, borstkas- en mediastinum-aandoeningen |
| Hoesten | Orofarynxspasme |
Maagdarmstelsel-aandoeningen | Droge mond | Gastro-oesofageale refluxziekte | Pancreatitis |
Lever- en galaandoeningen |
| Leverfunctietests abnormaal | Leverfalen |
Huid- en onderhuidaandoeningen |
| Alopecia | Rash |
Skeletspierstelsel- en bindweefsel-aandoeningen | Musculoskeletale stijfheid | Spierrigiditeit | Rabdomyolyse |
Nier- en urinewegaandoeningen |
| Nefrolithiase | Urineretentie |
Zwangerschap, perinatale periode en puerperium |
|
| Geneesmiddelontwenningsverschijnselen-syndroom, neonataal (zie rubriek 4.6) |
Voortplantingsstelsel- en borstaandoeningen | Erectiele disfunctie | Galactorroe | Priapisme |
Algemene aandoeningen en toedieningsplaatsstoornissen | Injectieplaatspijn | Pyrexie | Temperatuursregelingsstoornis (bijv. hypothermie, pyrexie) |
Onderzoeken | Bloedcreatinefosfokinase verhoogd | Bloedglucose verhoogd | Bloed glucoseschommeling |
Beschrijving van geselecteerde bijwerkingen
Injectieplaatsreacties
Tijdens de dubbelblinde, gecontroleerde fasen van de twee langdurige onderzoeken werden injectieplaatsreacties waargenomen; deze waren over het algemeen licht tot matig van ernst en verdwenen in de loop van de tijd. Injectieplaatspijn (incidentie 5,1 %) ontstaat mediaan op dag 2 na de injectie en heeft een mediane duur van 4 dagen.
In een open-label onderzoek waarin de biologische beschikbaarheid van Abilify Maintena 400 mg/300 mg werd vergeleken bij toediening in de deltaspier of in de bilspier, kwamen reacties in verband met de injectieplaats iets vaker voor bij toediening in de deltaspier. De meeste van deze reacties waren licht van ernst en verbeterden bij volgende injecties. Wanneer wordt vergeleken met onderzoeken waarbij Abilify Maintena 400 mg/300 mg in de bilspier werd geïnjecteerd, kwam herhaald optreden van pijn op de injectieplaats vaker voor bij toediening in de deltaspier.
Neutropenie
Neutropenie is in het klinische programma gemeld met Abilify Maintena 400 mg/300 mg. Neutropenie begon doorgaans rond dag 16 na de eerste injectie en had een mediane duur van 18 dagen.
Extrapiramidale symptomen (EPS)
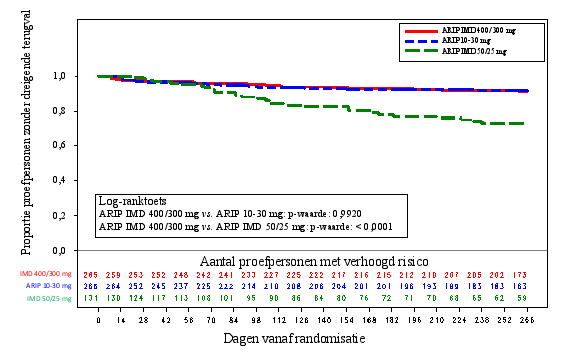
In onderzoeken met stabiele patiënten met schizofrenie was Abilify Maintena 400 mg/300 mg geassocieerd met een hogere frequentie van EPS (18,4 %) dan behandeling met oraal aripiprazol (11,7 %). Acathisie was het vaakst waargenomen symptoom (8,2 %). Acathisie begon doorgaans rond dag 10 na de eerste injectie en had een mediane duur van 56 dagen. Personen met acathisie kregen doorgaans anticholinerge geneesmiddelen als behandeling, voornamelijk benzatropinemesilaat en trihexyfenidyl. Stoffen als propranolol en benzodiazepinen (clonazepam en diazepam) werden minder vaak toegediend om acathisie onder controle te brengen. Aan parkinsonisme gerelateerde voorvallen kwamen wat betreft de frequentie daarna, met respectievelijk 6,9 % voor Abilify Maintena 400 mg/300 mg, 4,15 % voor oraal aripiprazol 10 mg tot 30 mg tabletten en 3,0 % voor placebo.
Dystonie
Klasse-effect: Symptomen van dystonie, langer durende abnormale samentrekkingen van spiergroepen, kunnen voorkomen bij gevoelige personen gedurende de eerste paar dagen van de behandeling. Symptomen van dystonie zijn onder meer: spasme van de nekspieren, soms leidend tot vernauwing van de keel, slikproblemen, ademhalingsproblemen en/of protrusie van de tong. Deze symptomen kunnen al bij lage doses optreden, maar ze komen vaker voor en zijn ernstiger bij sterkere middelen en hogere doses van eerstegeneratie-antipsychotica. Een verhoogd risico van acute dystonie wordt waargenomen bij mannen en in jongere leeftijdsgroepen.
Gewicht
Tijdens de dubbelblinde, actief-gecontroleerde fase van het 38 weken durende langdurige onderzoek (zie rubriek 5.1) bedroeg de incidentie van een gewichtstoename 7 %, van de uitgangswaarde tot het laatste bezoek, 9,5 % voor Abilify Maintena 400 mg/300 mg en 11,7 % voor de orale tabletten aripiprazol 10 mg tot 30 mg. De incidentie van een gewichtsverlies ≥ 7 %, van de uitgangswaarde tot het laatste bezoek, bedroeg 10,2 % voor Abilify Maintena 400 mg/300 mg en 4,5 % voor de orale tabletten aripiprazol 10 mg tot 30 mg. Tijdens de dubbelblinde, placebogecontroleerde fase van het 52 weken durende langdurige onderzoek (zie rubriek 5.1) bedroeg de incidentie van een gewichtstoename 7 %, van de uitgangswaarde tot het laatste bezoek, 6,4 % voor Abilify Maintena 400 mg/300 mg en 5,2 % voor placebo. De incidentie van een gewichtsverlies ≥ 7 %, van de uitgangswaarde tot het laatste bezoek, bedroeg 6,4 % voor Abilify Maintena 400 mg/300 mg en 6,7 % voor placebo. Tijdens de dubbelblinde behandeling bedroeg de gemiddelde verandering in lichaamsgewicht, van de uitgangswaarde tot het laatste bezoek, −0,2 kg voor Abilify Maintena 400 mg/300 mg en −0,4 kg voor placebo (p = 0,812).
Prolactine
In klinische onderzoeken voor de goedgekeurde indicaties en in de postmarketingfase zijn zowel een toename als afname in serumprolactine ten opzichte van de uitgangswaarde waargenomen met aripiprazol (rubriek 5.1).
Gokstoornis en andere impulsbeheersingsstoornissen
Gokstoornis, hyperseksualiteit, compulsief winkelen en overmatig of compulsief eten kunnen optreden bij patiënten die met aripiprazol worden behandeld (zie rubriek 4.4).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
Nederland
Nederlands Bijwerkingen Centrum Lareb
Website: www.lareb.nl
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Otsuka Pharmaceutical Netherlands B.V.
Herikerbergweg 292
1101 CT, Amsterdam
Nederland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Abilify Maintena 300 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
EU/1/13/882/001
EU/1/13/882/003
Abilify Maintena 400 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte
EU/1/13/882/002
EU/1/13/882/004
Abilify Maintena 300 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte in een voorgevulde spuit
EU/1/13/882/005
EU/1/13/882/007
Abilify Maintena 400 mg poeder en oplosmiddel voor suspensie voor injectie met verlengde afgifte in een voorgevulde spuit
EU/1/13/882/006
EU/1/13/882/008
10. DATUM VAN HERZIENING VAN DE TEKST
03/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3154887 | ABILIFY MAINTENA 1 FL 400 MG+ 1 FL 2 ML | N05AX12 | € 195,17 | - | Ja | € 12,5 | € 8,3 |