SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Constella 290 microgram harde capsules
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke capsule bevat 290 microgram linaclotide.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Harde capsule.
Witte tot gebroken wit/oranje ondoorzichtige capsule (18 mm x 6,35 mm) met het opschrift “290” in grijze inkt.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
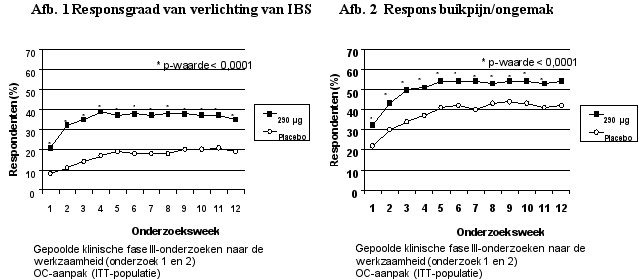
Constella is geïndiceerd voor de symptomatische behandeling van matig tot ernstig prikkelbaredarmsyndroom met constipatie (IBS‑C) bij volwassenen.
4.2 Dosering en wijze van toediening
Dosering
De aanbevolen dosis is één capsule (290 microgram) eenmaal daags.
Artsen dienen regelmatig de behoefte aan een verdere behandeling te evalueren. De werkzaamheid van linaclotide is vastgesteld in dubbelblinde, placebogecontroleerde onderzoeken van maximaal 6 maanden. Indien de patiënt geen verbetering van de symptomen ondervindt na 4 weken behandeling, moet hij/zij opnieuw worden onderzocht en dienen het voordeel en de risico’s van een verdere behandeling opnieuw te worden overwogen.
Speciale patiëntengroepen
Patiënten met nier- of leverfunctiestoornis
Er zijn geen dosisaanpassingen vereist voor patiënten met een lever- of nierfunctiestoornis (zie rubriek 5.2).
Oudere patiënten
Hoewel geen dosisaanpassingen vereist zijn, dient de behandeling voor oudere patiënten zorgvuldig te worden gecontroleerd en regelmatig te worden geherevalueerd (zie rubriek 4.4).
Pediatrische patiënten
De veiligheid en werkzaamheid van Constella bij kinderen jonger dan 18 jaar zijn nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Constella mag niet worden gebruikt bij kinderen en adolescenten (zie rubriek 5.1).
Wijze van toediening
Oraal gebruik. De capsule dient ten minste 30 minuten vóór een maaltijd te worden ingenomen (zie rubriek 4.5).
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Patiënten met een bekende of vermoedelijke mechanische gastro-intestinale obstructie.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Linaclotide werd oraal toegediend aan 1166 patiënten met IBS‑C in gecontroleerde klinische onderzoeken. Van deze patiënten kregen er 892 linaclotide in de aanbevolen dosis van 290 microgram per dag. De totale blootstelling in het klinisch ontwikkelingsplan overschreed 1500 patiëntjaren. De meest gemelde bijwerking die geassocieerd werd met de behandeling met Constella was diarree, hoofdzakelijk licht tot matig in intensiteit, die bij minder dan 20 % van de patiënten optrad. In zeldzame en meer ernstiger gevallen kan dit – als consequentie – leiden tot het optreden van dehydratie, hypokaliëmie, daling van de concentratie bicarbonaat in het bloed, duizeligheid, en orthostatische hypotensie.
Andere vaak voorkomende bijwerkingen (>1 %) waren buikpijn, een opgezette buik en winderigheid.
Tabel met de bijwerkingen
De volgende bijwerkingen werden gemeld in klinische onderzoeken en post-marketingervaring (tabel 1) met de aanbevolen dosis van 290 microgram per dag, met frequenties als volgt: zeer vaak (≥1/10), vaak (≥1/100, <1/10), soms (1/1.000, <1/100), zelden (1/10.000, <1/1.000) en zeer zelden (<1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1 Gemelde bijwerkingen uit klinische onderzoeken en uit post-marketingervaring met de aanbevolen dosis van 290 microgram per dag
MedDRA | Zeer vaak | Vaak | Soms | Zelden | Niet bekend |
Infecties en parasitaire aandoeningen |
| Virale gastro‑enteritis |
|
|
|
Voedings- en stofwisselings- |
|
| Hypokaliëmie |
|
|
Zenuwstelsel- |
| Duizeligheid |
|
|
|
Bloedvat- |
|
| Orthostatische hypotensie |
|
|
Maagdarmstelsel- | Diarree | Buikpijn | Fecale incontinentie Ontlastingsaandrang | Gastro‑intestinale perforatie |
|
Huid- en |
|
| Urticaria |
| Huiduit- |
Onderzoeken |
|
|
| Daling van bicarbonaat in het bloed |
|
Beschrijving van geselecteerde bijwerkingen
Diarree is de meest voorkomende bijwerking en strookt met de farmacologische werking van het werkzame stof. In klinische onderzoeken kreeg 2 % van de behandelde patiënten ernstige diarree en stopte 5 % van de patiënten de behandeling vanwege diarree.
De meerderheid van de gemelde gevallen van diarree was licht (43 %) tot matig (47 %); 2 % van de behandelde patiënten kreeg ernstige diarree. Ongeveer de helft van de diarree‑episoden begon in de eerste behandelingsweek.
De diarree verdween binnen zeven dagen bij ongeveer een derde van de patiënten, maar bij 80 patiënten (50%) duurde de diarree meer dan 28 dagen (overeenkomend met 9,9 % van alle patiënten die met linaclotide behandeld werden).
In klinische onderzoeken staakte 5 % van de patiënten de behandeling vanwege diarree. Bij patiënten die de behandeling moesten stopzetten wegens diarree, verdween deze een paar dagen na stopzetting van de behandeling.
Ouderen (>65 jaar), patiënten met hypertensie en patiënten met diabetes meldden vaker diarree in vergelijking met de algemene IBS-C-populatie geïncludeerd in de klinische onderzoeken.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
België
Federaal agentschap voor geneesmiddelen en gezondheidsproducten
Afdeling Vigilantie
Postbus 97
B-1000 BRUSSEL, Madou
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
AbbVie Deutschland GmbH & Co. KG
Knollstrasse
67061 Ludwigshafen
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/12/801/001
EU/1/12/801/002
EU/1/12/801/004
EU/1/12/801/005
10. DATUM VAN HERZIENING VAN DE TEKST
09/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau (https://www.ema.europa.eu).
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3096922 | CONSTELLA 290MCG CAPS HARD 28 | A06AX04 | € 56,2 | - | Ja | - | - |