1. NAAM VAN HET GENEESMIDDEL
Spiriva 18 microgram inhalatiepoeder in harde capsule
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke capsule bevat 22,5 microgram tiotropiumbromide monohydraat, overeenkomend met 18 microgram tiotropium.
De afgeleverde dosis (de dosis die het mondstuk van de HandiHaler verlaat) is 10 microgram tiotropium.
Hulpstof met bekend effect:
Een capsule bevat 5,5 milligram lactose (als monohydraat).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Inhalatiepoeder in harde capsule.
Lichtgroene capsules met inhalatiepoeder, langs de buitenkant bedrukt met de productcode TI 01 en het bedrijfslogo.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Spiriva is een bronchusverwijder, aangewezen als onderhoudsbehandeling om de symptomen van patiënten met chronisch obstructief longlijden (COPD) te verlichten.
4.2 Dosering en wijze van toediening
Dosering
Dit geneesmiddel mag alleen gebruikt worden door middel van inhalatie.
De aanbevolen dosering voor tiotropiumbromide is een inhalatie van de inhoud van een capsule met behulp van de HandiHaler, eenmaal per dag en steeds op hetzelfde uur van de dag.
De aanbevolen dosis mag niet worden overschreden.
Spiriva capsules zijn alleen voor inhalatie en niet voor orale inname.
Spirivacapsules mogen niet worden ingeslikt.
Spiriva capsules mogen alleen maar worden geïnhaleerd met de HandiHaler.
Speciale patiëntengroepen
Oudere patiënten kunnen tiotropiumbromide in de aanbevolen dosering gebruiken.
Patiënten met nierinsufficiëntie kunnen tiotropiumbromide in de aanbevolen dosering gebruiken. Voor patiënten met matige tot ernstige nierinsufficiëntie (creatinineklaring 50 ml/min) zie rubriek 4.4 en rubriek 5.2
Patiënten met leverinsufficiëntie kunnen tiotropiumbromide in de aanbevolen dosering gebruiken (zie rubriek 5.2).
Pediatrische patiënten
COPD
Gebruik bij kinderen en jongeren (onder de 18 jaar) is niet relevant binnen de indicatie zoals vermeld in rubriek 4.1
Cystische fibrose
De veiligheid en werkzaamheid van Spiriva 18 microgram bij kinderen en adolescenten is niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
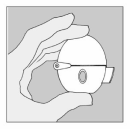
The HandiHaler is een inhalator speciaal ontworpen zodat patienten de medicatie in de Spiriva capsules kunnen inhaleren. The HandiHaler dient niet te worden gebruikt om andere geneesmiddelen in te nemen. De HandiHaler is bedoeld voor één patiënt en kan meerdere keren worden gebruikt.
Om er zeker van te zijn dat dit geneesmiddel op de juiste manier wordt toegediend, moet de patiënt goed uitgelegd krijgen hoe de inhalator gebruikt moet worden, door een arts of een andere medisch deskundige.
Instructies voor het gebruik van de inhalator
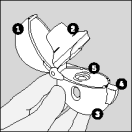
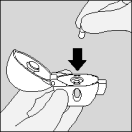
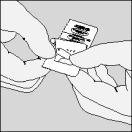
De volgende stappen moeten door patiënten gevolgd worden om de HandiHaler te gebruiken.
| Volg nauwgezet de instructies van uw arts voor het gebruik van Spiriva. |
| De HandiHaler |
| |
| |
| |
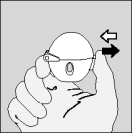
| 4. Sluit het mondstuk goed, totdat u een klik hoort, en laat de beschermkap open. |
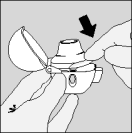
| 5. Houd het HandiHaler apparaatje verticaal, met het mondstuk naar boven gericht en druk de groene knop in één keer helemaal in. Laat de knop vervolgens weer los. |
| 6. Adem volledig uit. |
| |
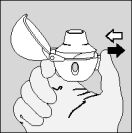
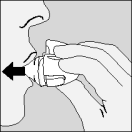
| 8. Open opnieuw het mondstuk. Tik de gebruikte capsule eruit en gooi ze weg. |
Reinigen van de HandiHaler
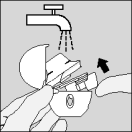
| Maak de HandiHaler één keer per maand schoon. Open de beschermkap en het mondstuk. Open vervolgens de capsulehouder door de drukknop op te tillen. Spoel de HandiHaler helemaal uit met warm water om achtergebleven poederresten te verwijderen. Droog de HandiHaler grondig door het achtergebleven water met een papieren servetje te verwijderen. Laat de HandiHaler vervolgens aan de lucht drogen en laat daarbij de beschermkap, mondstuk en de capsulehouder open. Het duurt ongeveer 24 uur voordat de HandiHaler helemaal droog is. Maak hem daarom onmiddelijk na gebruik schoon, zodat hij klaar is voor uw volgende inhalatie. Zo nodig kan de buitenkant van de HandiHaler met een vochtig doekje worden schoongemaakt. |
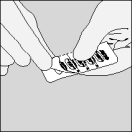
Openen van de blisterverpakking
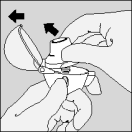
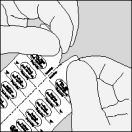
| A. Deel de Spiriva blisterverpakking langs de perforatielijn in twee helften. |
| B. Trek de folie vanaf het vrije uiteinde naar achter tot één capsule helemaal zichtbaar wordt. Doe dit pas vlak vóór het gebruik. Wanneer per vergissing een tweede capsule aan de lucht wordt blootgesteld, moet deze weggegooid worden. |
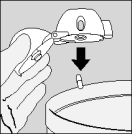
| C. Haal de capsule eruit. |
De Spiriva capsules bevatten slechts een kleine hoeveelheid poeder en zijn dus maar gedeeltelijk gevuld.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor de in rubriek 6.1 vermelde hulpstof, of voor atropine of derivaten zoals ipratropium of oxitropium.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Van de genoemde bijwerkingen kunnen er vele worden toegeschreven aan de anticholinerge eigenschappen van Spiriva.
Tabel met de samenvatting van de bijwerkingen
De frequenties, weergegeven in onderstaande tabel, zijn gebaseerd op onbewerkte incidentiecijfers van bijwerkingen (dat wil zeggen gebeurtenissen toegeschreven aan tiotropium) waargenomen in de tiotropiumgroep (9.647 patiënten) van 28 gepoolde placebo-gecontroleerde klinische onderzoeken met een behandelingsduur variërend van vier weken tot vier jaar.
De frequenties worden als volgt gedefiniëerd:
Zeer vaak: > 1/10; Vaak: > 1/100 en < 1/10; Soms: > 1/1.000 en < 1/100; Zelden: > 1/10.000 en
< 1/1.000; Zeer zelden: < 1/10.000; Niet bekend: kan niet uit de beschikbare gegevens worden afgeleid.
Systeem Orgaan Klasse/MedDRA voorkeursterm | Frequentie | |
Voedings- en stofwisselingsstoornissen |
| |
Dehydratie | niet bekend | |
Zenuwstelselaandoeningen |
| |
Duizeligheid | soms | |
Hoofdpijn | soms | |
Smaakstoornissen | soms | |
Slapeloosheid | zelden | |
Oogaandoeningen |
| |
Wazig zien | soms | |
Glaucoom | zelden | |
Verhoogde oogboldruk | zelden | |
Hartaandoeningen |
| |
Atriumfibrilleren | soms | |
Supraventriculaire tachycardie | zelden | |
Tachycardie | zelden | |
Hartkloppingen | zelden | |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen |
| |
Faryngitis | soms | |
Stemstoornis | soms | |
Hoest | soms | |
Bronchospasmen | zelden | |
Neusbloeding | zelden | |
Laryngitis | zelden | |
Sinusitis | zelden | |
Maagdarmstelselaandoeningen |
| |
Droge mond | vaak | |
Gastro-oesofagale reflux aandoening | soms | |
Constipatie | soms | |
Orofaryngeale candidiasis | soms | |
Intestinale obstructie, waaronder paralytische ileus | zelden | |
Gingivitis | zelden | |
Glossitis | zelden | |
Dysfagie | zelden | |
Stomatitis | zelden | |
Misselijkheid | zelden | |
Tandcariës | niet bekend | |
Huid- en onderhuidaandoeningen, immuunsysteemaandoeningen |
| |
Huiduitslag | soms | |
Urticaria | zelden | |
Pruritus | zelden | |
Overgevoeligheid (waaronder snelle reacties) | zelden | |
Angio-oedeem | zelden | |
Huidinfectie, huidulcer | niet bekend | |
Droge huid | niet bekend | |
Skeletspierstelsel- en bindweefsel-aandoeningen |
| |
Zwelling van gewrichten | niet bekend | |
Nier- en urinewegaandoeningen |
| |
Dysurie | soms | |
Urineretentie | soms | |
Urineweginfectie | zelden | |
Beschrijving van geselecteerde bijwerkingen
De vaakst geobserveerde bijwerkingen in gecontroleerd klinisch onderzoek zijn anticholinerge bijwerkingen zoals droge mond, wat voorkwam in 4% van de patiënten. In 28 klinische studies leidde een droge mond tot het staken van de behandeling bij 18 van de 9.647 met tiotropoium behandelde patiënten (0,2%).
Ernstige bijwerkingen eigen aan de anticholinerge effecten zijn onder andere glaucoom, constipatie en darmobstructie, met mogelijk paralytische ileus, en urineretentie.
Andere speciale patiëntengroepen
De anticholinerge bijwerkingen kunnen met de leeftijd toenemen.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico's van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten - Afdeling Vigilantie
Galileelaan 5/03 - 1210 Brussel
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
Luxemburg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Website : www.guichet.lu/pharmacovigilance
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Boehringer Ingelheim International GmbH
Binger Straße 173
55216 Ingelheim am Rhein
Duitsland
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE236047
10. DATUM VAN HERZIENING VAN DE TEKST
03/2023
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1713023 | SPIRIVA CAPS. 30 X 18 MCG + HANDIHALER | R03BB04 | € 35,98 | - | Ja | - | - |