1. NAAM VAN HET GENEESMIDDEL
Miflonide Breezhaler 200 microgram inhalatiepoeder, harde capsules
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke capsule van 200 microgram bevat 230 microgram budesonide en geeft 200 microgram budesonide af uit het mondstuk van het toestel bij gebruik samen met de Miflonide Breezhaler (naam inhalator).
Hulpstof met bekend effect:
De capsules van 200 microgram bevatten 24,77 mg lactose monohydraat.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Inhalatiepoeder, harde capsule.
De capsule van 200 microgram heeft een lichtroze, opake dop en een kleurloos, doorschijnend lichaam, bedrukt met het logo /BUDE 200.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Miflonide Breezhaler is geïndiceerd bij astmalijders van 6 jaar oud en ouder voor een langdurige ontstekingsremmende controle van een persisterend astma en voor profylaxe van acute exacerbaties van astma.
4.2 Dosering en wijze van toediening
Dosering
De dosering moet zorgvuldig bij elke patiënt afzonderlijk worden aangepast tot de laagste dosering die volstaat om de astmasymptomen te controleren. De laagste dosering in één capsule is 200 microgram. Als een dosis van minder dan 200 microgram per keer vereist is, kan dit product niet worden gebruikt.
Miflonide Breezhaler is gecontra-indiceerd bij kinderen jonger dan 6 jaar (zie rubriek 4.3).
Volwassenen:
De behandeling van volwassenen met een licht astma mag worden gestart met de minimale efficiënte dosering van 200 microgram eenmaal per dag.
De gebruikelijke dagelijkse aanbevolen dosering is 200-1600 microgram verdeeld in 2 giften. De onderhoudsdosering moet de laagste dosering zijn waarmee het astma efficiënt onder controle kan worden gehouden.
Speciale populaties
Pediatrische patiënten (6 jaar en ouder):
Bij gebrek aan klinische ervaring bij kinderen jonger dan 6 jaar mag Miflonide Breezhaler in die leeftijdsgroep niet worden gebruikt.
De behandeling van kinderen van 6 jaar oud en ouder met een licht astma mag worden gestart met een dosering van 200 microgram eenmaal per dag. De gebruikelijke aanbevolen dagelijkse dosering is 200-400 microgram verdeeld in 2 giften per dag. In ernstige gevallen van astma kunnen doseringen tot 800 microgram per dag in verdeelde doses noodzakelijk zijn.
Als onderhoudsdosering moet de laagste dosering worden gegeven waarmee het astma efficiënt onder controle kan worden gehouden.
Patiënten met onderhoudsbehandeling van orale glucocorticosteroïden
De dosering van orale glucocorticosteroïden kan mogelijk door Miflonide Breezhaler worden vervangen of aanzienlijk verlaagd terwijl de astma onder controle gehouden wordt. Bij overschakeling van behandeling met orale steroïden op Miflonide Breezhaler moet de patiënt zich in een vrij stabiele fase bevinden. Gedurende ongeveer 10 dagen moet een hoge dosis budesonide worden gegeven in combinatie met de eerder gebruikte orale steroïde. Daarna moet de orale dosis geleidelijk worden verlaagd (met bijvoorbeeld 2,5 mg prednisolon of het equivalent per maand) tot de laagst mogelijke dosering. In veel gevallen is het mogelijk om de orale steroïde volledig door Miflonide Breezhaler te vervangen. Voor meer informatie over het stopzetten van corticosteroïden, zie rubriek 4.4.
Patiënten met nierinsufficiëntie
Er zijn geen aanwijzingen dat de dosering moet worden aangepast bij patiënten met nierinsufficiëntie. Gezien de farmacokinetische gegevens over budesonide per os is het onwaarschijnlijk dat de systemische blootstelling aan het geneesmiddel bij dergelijke patiënten in klinisch significante mate zal veranderen (zie rubriek 5.2).
Patiënten met leverinsufficiëntie
Er zijn geen aanwijzingen dat de dosering moet worden aangepast bij patiënten met leverinsufficiëntie. Aangezien budesonide echter overwegend wordt geklaard door levermetabolisme, is voorzichtigheid geboden bij gebruik van Miflonide Breezhaler bij patiënten met een ernstige leverinsufficiëntie. Patiënten met een lichte tot matige leverinsufficiëntie zullen waarschijnlijk geen klinisch significante verandering van de blootstelling aan het geneesmiddel vertonen te oordelen naar de farmacokinetische gegevens betreffende budesonide per os (zie rubriek 5.2).
Ouderen (ouder dan 65 jaar)
Er zijn geen aanwijzingen dat patiënten ouder dan 65 jaar een andere dosering nodig hebben dan die die bij jongere volwassen patiënten wordt gebruikt.
Toediening
Bij het overschakelen van het ene op het andere inhalatietoestel, moet de dosering opnieuw individueel getitreerd worden. Het wordt aanbevolen om de mond na elke toediening goed met water te spoelen en het spoelwater daarna uit te spuwen om heesheid, irritatie van de keel en Candida-infectie van de mond en de keel te voorkomen en mogelijk om het risico op systemische effecten te verlagen. Patiënten dient te worden verteld dat de capsules alleen bedoeld zijn voor inhalatie en niet om door te slikken (zie rubriek 4.4). De inhoud van de capsule wordt ingeademd met een inhalatietoestel, Miflonide Breezhaler genoemd.
De patiënten moeten leren hoe ze het Miflonide Breezhaler inhalatieapparaat goed moeten gebruiken in overeenstemming met de richtlijnen voor de gebruikers om ervoor te zorgen dat het geneesmiddel de doelgebieden van de longen bereikt.
Voor instructies over het gebruik van het geneesmiddel voorafgaand aan toediening, zie rubriek 6.6.
4.3 Contra-indicaties
Niet gebruiken bij kinderen jonger dan 6 jaar.
Overgevoeligheid voor de werkzame stof of voor (één van) de in rubriek 6.1 vermelde hulpstoffen.
Actieve longtuberculose.
4.8 Bijwerkingen
De bijwerkingen worden gegroepeerd volgens hun frequentie. Die laatste wordt als volgt gedefinieerd: zeer vaak (≥ 1/10), vaak (≥ 1/100 tot <1/10), soms (≥ 1/1000 tot <1/100), zelden (≥ 1/10000 tot <1/1000), zeer zelden (<1/10000), niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1 toont bepaalde bijwerkingen die werden gerapporteerd bij patiënten die werden behandeld met budesonide. De bijwerkingen werden samengevoegd volgens de MedDRA-standaardorgaanklassen.
Infecties en parasitaire aandoeningen | |
Vaak | Orofaryngeale candidiase |
Immuunsysteemaandoeningen | |
Zelden | Onmiddellijke en late overgevoeligheidsreacties waaronder uitslag, contactdermatitis, urticaria, angio-oedeem, jeuk en anafylactische reactie |
Endocriene aandoeningen | |
Zelden | Tekenen en symptomen van systemische effecten van corticosteroïden, waaronder bijniersuppressie, afname van de groeisnelheid*, hypoadrenocorticisme, hyperadrenocorticisme, cushingsyndroom |
Psychische stoornissen | |
Zelden | Rusteloosheid, zenuwachtigheid, gedragsveranderingen (overwegend bij kinderen) |
Soms | Angst, depressie** |
Niet bekend | Slaapstoornissen, psychomotorische hyperactiviteit, agressie |
Oogaandoeningen | |
Soms | Cataract***, wazig zien**** |
Zelden | Glaucoom |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | |
Vaak | Dysfonie, hoest, heesheid, irritatie van de keel |
Zelden | Bronchospasme, met inbegrip van paradoxaal bronchospasme |
Huid- en onderhuidaandoeningen | |
Zelden | Blauwe plekken |
Skeletspierstelsel- en bindweefselaandoeningen | |
Soms | Spierspasme, tremor |
Zelden | Daling van de botdichtheid |
*zie verder pediatrische patiënten
**Klinische onderzoeken met 13119 patiënten die inhalatiebudesonide en 7278 patiënten die een placebo gebruikten, zijn gepoold. De frequentie van angst was 0,52% bij het gebruik van inhalatiebudesonide en 0,63% bij een placebo; die van depressie was 0,67% bij het gebruik van inhalatiebudesonide en 1,15% bij een placebo.
***Bij placebo-gecontroleerde onderzoeken werd cataract even vaak (met frequentie ‘soms’) waargenomen in de placebogroep.
****zie ook rubriek 4.4.
Er is een hoger risico op pneumonie bij patiënten met een nieuw gediagnosticeerde COPD die een behandeling met inhalatiecorticosteroïden starten. Bij een gewogen evaluatie van de samengevoegde resultaten van 8 klinische studies met in het totaal 4643 COPD-patiënten die werden behandeld met budesonide, en 3643 patiënten die werden gerandomiseerd naar een behandeling zonder inhalatiecorticosteroïden, werd geen hoger risico op pneumonie aangetoond. De resultaten van de eerste 7 van die 8 studies werden gepubliceerd als een meta-analyse.
Soms treden mogelijk tekenen of symptomen op van systemische bijwerkingen van glucocorticosteroïden bij het gebruik van inhalatieglucocorticosteroïden, waarschijnlijk afhankelijk van de dosering, blootstellingsduur, gelijktijdige en eerdere blootstelling aan corticosteroïden en individuele gevoeligheid.
Pediatrische patiënten
Gezien het risico op groeiachterstand in de pediatrische populatie moet de groei worden gevolgd zoals beschreven in rubriek 4.4.
Heesheid en irritatie van de keel zijn reversibel en verdwijnen na stopzetting van de behandeling, verlaging van de dosering en/of laten rusten van de stem.
Als een Candida-infectie van de orofarynx optreedt, krijgen de patiënten de raad om de mond na elke toediening met water te spoelen of de tanden te poetsen. In dergelijke gevallen zal de infectie meestal reageren op een topische behandeling met antifungusmiddelen zonder dat de behandeling met Budesonide hoeft te worden stopgezet.
Zoals met andere inhalatietherapieën is een paradoxaal bronchospasme mogelijk. Als dat gebeurt, moet de behandeling met budesonide onmiddellijk worden stopgezet en moet zo nodig een andere behandeling worden gestart en moet meteen een behandeling met een snelwerkende inhalatiebronchodilatator worden gegeven.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
Federaal agentschap voor geneesmiddelen en gezondheidsproducten
Afdeling Vigilantie
Postbus 97
B-1000 Brussel Madou
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novartis Pharma NV, Medialaan 40, B-1800 Vilvoorde
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE218531
10. DATUM VAN HERZIENING VAN DE TEKST
04/2018
Goedkeuring: 05/2021
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1625912 | MIFLONIDE CAPS. INHAL. 30 X 200 MCG | R03BA02 | € 7,49 | - | Ja | - | - |
| 1625938 | MIFLONIDE BREEZHALER CAPS INHAL. 120 X 200MCG | R03BA02 | € 12,72 | - | Ja | € 2,42 | € 1,45 |
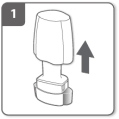 Haal de beschermdop eraf
Haal de beschermdop eraf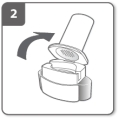 Open de inhalator
Open de inhalator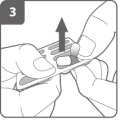 Bereid de capsule voor
Bereid de capsule voor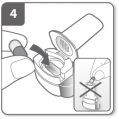 Voer de capsule in
Voer de capsule in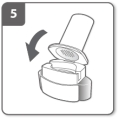 Sluit de inhalator
Sluit de inhalator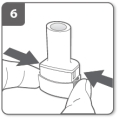 Doorboor de capsule
Doorboor de capsule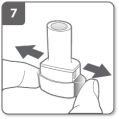 Laat de zijknoppen volledig los
Laat de zijknoppen volledig los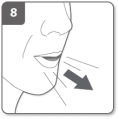 Adem uit
Adem uit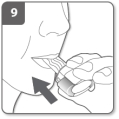 Inhaleer het geneesmiddel
Inhaleer het geneesmiddel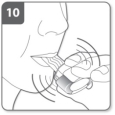 Opmerking:
Opmerking: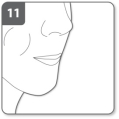 Houd uw adem in
Houd uw adem in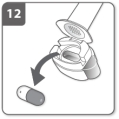 Open het mondstuk nogmaals en verwijder de lege capsule door deze uit de capsulehouder te tikken. Gooi de lege capsule weg met uw huishoudelijk afval.
Open het mondstuk nogmaals en verwijder de lege capsule door deze uit de capsulehouder te tikken. Gooi de lege capsule weg met uw huishoudelijk afval.