1. NAAM VAN HET GENEESMIDDEL
Duovent® HFA
0,020 mg/0,050 mg
Aerosol, oplossing
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Ipratropiumbromide anhydraat 0,020 mg (= 0,021 mg ipratropiumbromide monohydraat) – Fenoterolhydrobromide 0,050 mg
Hulpstof(fen) met bekend effect:
Dit geneesmiddel bevat ongeveer 13 mg alcohol (ethanol) per dosis.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Aerosol, oplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Duovent HFA is een bronchusverwijder aangewezen bij volwassenen en kinderen vanaf 6 jaar voor de preventie en de symptomatische behandeling van chronisch obstructief longlijden dat gepaard gaat met een niet-permanent beperkte luchtstroom, zoals bronchiaal astma en chronische bronchitis met of zonder emfyseem.
Gelijktijdige behandeling met anti-inflammatoire middelen moet worden overwogen bij patiënten met bronchiaal astma of chronisch obstructief longlijden die gunstig reageren op corticosteroïden.
4.2 Dosering en wijze van toediening
Dosering
De posologie moet individueel worden aangepast. De volgende dosissen worden aanbevolen:
Volwassenen:
- Tijdens aanvallen van acuut astma bedraagt de aanbevolen posologie 2 verstuivingen.
In de meeste gevallen zijn 2 verstuivingen voldoende om een onmiddellijke verlichting van de symptomen te verkrijgen. In ernstige gevallen, als de ademhaling na 5 minuten niet verbeterd is, kunnen 2 supplementaire verstuivingen nodig zijn.
Als de aanval na 4 verstuivingen nog niet verlicht is, kunnen herhaalde dosissen noodzakelijk zijn. In deze gevallen moet de patiënt zijn arts raadplegen of zich naar het dichtstbijzijnde ziekenhuis begeven. - Bij tussentijdse of langdurige behandelingen: 1 à 2 verstuivingen per keer, met een maximum van 8 verstuivingen per dag.
De gemiddelde onderhoudsdosis bij volwassenen bedraagt 1 à 2 verstuivingen, 3 maal per dag. - Bij patiënten die lijden aan bronchiaal astma, mag Duovent HFA aerosol oplossing alleen maar gebruikt worden in geval van behoefte.
Pediatrische patiënten:
- Kinderen ouder dan 6 jaar: zie volwassenen.
- Duovent HFA is gecontra-indiceerd bij kinderen jonger dan 6 jaar (zie rubriek 4.3).
Bij kinderen moet de behandeling altijd gebeuren op advies van de arts en onder toezicht van een volwassene.
Wijze van toediening
Patiënten moeten worden voorgelicht over het juiste gebruik van de aerosol oplossing om een doeltreffende behandeling te garanderen.
Vóór het eerste gebruik:
De beschermdop verwijderen en de klep tweemaal activeren vóór de eerste toepassing van de aerosol oplossing.
Als het apparaatje meer dan 3 dagen niet gebruikt geweest is, wordt aanbevolen de klep opnieuw éénmaal te activeren.
Vóór elk gebruik:
- De beschermdop verwijderen.
- Zo diep mogelijk uitademen (los van het apparaat).
- Het mondstuk in de mond steken en goed met de lippen omsluiten zoals aangestoond in fig. 1.
- Langzaam door de mond beginnen in te ademen, terwijl men een verstuiving van het aerosol uitvoert (door het apparaatje tussen duim en wijsvinger in te drukken) (fig. 1). De langzame inademing zo diep mogelijk verder zetten. De adem enkele seconden inhouden. Het apparaatje uit de mond nemen en langzaam uitademen. Dit hele proces herhalen voor een tweede verstuiving.
- De beschermdop terugplaatsen na gebruik.
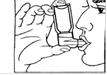
Fig. 1
Aangezien het busje onder druk van Duovent HFA niet doorschijnend is, kan men niet zien wanneer het leeg is. Het busje onder druk maakt 200 dosissen (verstuivingen) vrij. Na toediening van 200 dosissen kan het lijken alsof het nog een kleine hoeveelheid vloeistof bevat. De inhalator moet echter worden vervangen, zodat u zeker weet dat u bij elke handeling de juiste hoeveelheid van uw geneesmiddel binnenkrijgt.
- Reinig het mondstuk minstens 1x/week.
- Het is belangrijk dat het mondstuk van uw inhalator proper blijft om te voorkomen dat zichproduct in het mondstuk ophoopt en dat de spray blokkeert . De beschermdop verwijderen en het busje van het mondstuk verwijderen. Het mondstuk met warm water wassen totdat alle product of vuil verwijderd is.
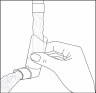
Fig. 2
- Nadat u deze hebt schoongemaakt, schud u het mondstuk af en laat u deze aan de lucht drogen, zonder een warmtebron te gebruiken. Van zodra het mondstuk droog is, het busje en de beschermdop terugplaatsen.
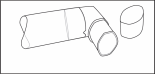
Fig. 3
Aandacht!
Het plastieken mondstuk is specifiek voor Duovent HFA aerosol oplossing, zodat u steeds de geschikte hoeveelheid product zou inhaleren. Deze mag niet samen gebruikt worden met het busje van een ander product. Ook mag de aerosol oplossing van Duovent HFA niet worden gebruikt met het mondstuk van een ander product.
Patiënten die voorbeschikt zijn voor glaucoom, moeten hun ogen beschermen (zie § 4.4 "Bijzondere waarschuwingen en voorzorgen bij gebruik").
Het busje staat onder druk en mag in geen geval met geweld geopend worden of blootgesteld aan temperaturen boven 50°C.
4.3 Contra-indicaties
- Overgevoeligheid voor fenoterolhydrobromide, andere sympathicomimetische amines, andere atropinederivaten of één van de hulpstoffen vermeld in rubriek 6.1.
- Patiënten die lijden aan thyreotoxicose, obstructieve hypertrofische cardiomyopathie of tachyaritmie.
- Kinderen jonger dan 6 jaar.
4.8 Bijwerkingen
Overzicht van het veiligheidsprofiel
De meeste bijwerkingen kunnen worden toegeschreven aan de anticholinerge en bèta-adrenerge eigenschappen van Duovent HFA. Zoals elke topische behandeling, kan Duovent HFA plaatselijke irritatie veroorzaken.
De meest voorkomende bijwerkingen gemeld tijdens klinische studies waren: hoofdpijn, hoesten, droge mond, braken, misselijkheid en duizeligheid, tremor, faryngitis, heesheid, tachycardie, hartkloppingen, verhoogde systolische bloeddruk, nervositeit.
Overzicht in tabelvorm van bijwerkingen
De bijwerkingen zijn geclassificeerd in functie van hun incidentie, gebruikmakend van het volgende systeem:
Zeer vaak (> 1/10); vaak (> 1/100, <1/10); soms (> 1/1.000, < 1/100); zelden (>1/10.000,
< 1/1.000); zeer zelden (< 1/10.000); niet bekend (kan met de beschikbare klinische gegevens niet worden bepaald)
Systeem/Orgaanklassen | Bijwerkingen | Frequentie |
Immuunsysteemaandoeningen | huidaandoeningen of allergie-achtige reacties (overgevoeligheid)* zoals huiduitslag, angio-oedeem, urticaria, laryngospasme en anafylactische reacties* | Zelden |
Voedings- en stofwisselingsstoornissen | hypokaliëmie* | Zelden |
Psychiatrische aandoeningen | gevallen van psychische veranderingen, agitatie | Zelden |
nervositeit | Soms | |
Zenuwstelselaandoeningen | hoofdpijn, lichte tremor van de skeletspieren, duizeligheid | Soms |
hyperactiviteit | Frequentie niet bekend | |
Oogaandoeningen | accommodatiestoornissen*, geslotenhoekglaucoom*, verhoogde intra-oculaire druk*, mydriasis*, wazig zien*, oogpijn*, cornea-oedeem*, hyperemie van de conjunctiva*, halo*. Zie ook § "Bijzondere waarschuwingen en voorzorgen bij gebruik". | Zelden |
Hartaandoeningen | atriumfibrilleren, aritmie, supraventriculaire tachycardie*, myocardischemie* | Zelden |
tachycardie, verhoogde hartslag, hartkloppingen | Soms | |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | hoest | Vaak |
faryngitis, dysfonie | Soms | |
bronchospasme, irritatie van de keel, farynxoedeem, laryngospasme*, paradoxale bronchospasmen, droge keel* | Zelden | |
Maagdarmstelselaandoeningen | droge mond, misselijkheid, braken | Soms |
stomatitis, glossitis, mondoedeem*, aandoeningen van het maagdarmkanaal, constipatie* en diarree | Zelden | |
Huid- en onderhuidaandoeningen | huiduitslag, hyperhidrose*, urticaria, pruritus, angio-oedeem* | Zelden |
Skeletspierstelsel- en bindweefselaandoeningen | spierpijn, zwakte en spierkrampen | Zelden |
Nier- en urinewegaandoeningen | urineretentie | Zelden |
Onderzoeken | verhoging van de systolische bloeddruk | Zelden |
daling van de diastolische bloeddruk | Soms |
* Deze bijwerking werd spontaan gemeld in het kader van de post-marketing follow-upgegevens. Deze bijwerking werd in geen van de geselecteerde klinische studies met Duovent HFA waargenomen. De schatting is gebaseerd op de bovengrens van zijn betrouwbaarheidsinterval van 95%, berekend op basis van het geheel van patiënten die in klinische onderzoeken en studies werden behandeld.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor geneesmiddelen en gezondheidsproducten -
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Boehringer Ingelheim SComm
Arnaud Fraiteurlaan 15-23
1050 Brussel
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
België: BE223063
10. DATUM VAN HERZIENING VAN DE TEKST DD/MM/YYYY
06/05/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1677863 | DUOVENT HFA AERO DOS 10 ML (200) | R03AL01 | € 12,03 | - | Ja | € 2,2 | € 1,32 |