SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
VISTABEL, 4 Allerganeenheden/0,1 ml, poeder voor oplossing voor injectie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Botulinumtoxine type A1 …………………4 Allerganeenheden per 0,1 ml gereconstitueerde oplossing.
1van Clostridium botulinum
Allerganeenheden zijn niet uitwisselbaar met andere preparaten van botulinumtoxine.
Injectieflacon met 50 Eenheden.
Injectieflacon met 100 Eenheden.
Voor een volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder voor oplossing voor injectie.
Wit poeder.
VISTABEL verschijnt als een dunne witte afzetting die aan de onderkant van de injectieflacon moeilijk zichtbaar is.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
VISTABEL is geïndiceerd om tijdelijk het uitzicht te verbeteren van:
- matige tot ernstige verticale lijnen tussen de wenkbrauwen die bij volledig fronsen zichtbaar zijn (fronslijnen) en/of
- matige tot ernstige laterale canthallijnen (kraaienpootjes) die bij een volledige glimlach zichtbaar zijn en/of
- matige tot ernstige voorhoofdslijnen die zichtbaar zijn bij maximaal opgetrokken wenkbrauwen,
wanneer de ernst van de gezichtslijnen een belangrijke psychologische impact heeft op volwassen patiënten.
4.2 Dosering en wijze van toediening
Dosering
Raadpleeg de specifieke aanbevelingen voor elke onderstaande indicatie.
Botulinumtoxine-eenheden van verschillende producten zijn niet onderling uitwisselbaar. De doseringen die worden aanbevolen in Allerganeenheden zijn niet dezelfde als die van andere preparaten van botulinumtoxine.
Oudere patiënten
Er zijn beperkte gegevens van klinische fase 3-studies met VISTABEL bij patiënten ouder dan 65 jaar (zie rubriek 5.1).
Er is geen specifieke dosisaanpassing nodig voor het gebruik bij oudere patiënten.
Pediatrische patiënten
De veiligheid en werkzaamheid van VISTABEL bij de behandeling van fronslijnen, kraaienpootjes of voorhoofdslijnen die zichtbaar zijn bij maximaal opgetrokken wenkbrauwen bij personen jonger dan 18 jaar werden niet onderzocht. Het gebruik van VISTABEL wordt niet aanbevolen bij personen jonger dan 18 jaar (zie rubriek 4.4).
Wijze van toediening
VISTABEL mag enkel worden toegediend door artsen die bevoegd zijn in en voldoende expertise hebben met deze behandeling en die over de vereiste apparatuur beschikken.
Na reconstitutie mag VISTABEL slechts voor één injectiesessie per patiënt worden gebruikt. Het resterende, ongebruikte product moet worden verwijderd, zoals beschreven in rubriek 6.6. Bijzondere voorzorgen dienen te worden genomen bij de bereiding en de toediening van het product en bij de inactivatie en de verwijdering van de resterende ongebruikte oplossing (zie rubrieken 4.4 en 6.6).
Het aanbevolen volume per injectieplaats is 0,1 ml. Zie ook de verdunningstabel in rubriek 6.6.
Voor de gebruiksaanwijzing, de manipulatie en de verwijdering van de injectieflacons, zie rubriek 6.6.
Er moet op worden gelet dat VISTABEL niet in een bloedvat wordt geïnjecteerd als het wordt geïnjecteerd in de verticale lijnen tussen de wenkbrauwen zichtbaar bij een volledige frons (ook wel fronslijnen genoemd), in de laterale canthallijnen zichtbaar bij een volledige glimlach (ook gekend als kraaienpootjes) of voorhoofdslijnen die zichtbaar zijn bij maximaal opgetrokken wenkbrauwen, zie rubriek 4.4.
Behandelingen mogen niet vaker dan één keer per drie maanden worden uitgevoerd.
Toedieningsinstructies voor fronslijnen zichtbaar bij een volledige frons:
Gereconstitueerde VISTABEL (50 Eenheden/1,25 ml of 100 eenheden/2,5 ml) wordt geïnjecteerd met een steriele naald van 30 gauge. Op elk van de 5 injectieplaatsen (zie figuur 1) wordt 0,1 ml (4 Eenheden) toegediend: 2 injecties in elke musculus corrugator en 1 injectie in de musculus procerus voor een totale dosis van 20 Eenheden.
Voor de injectie wordt de duim of de wijsvinger stevig onder de rand van de oogkas geplaatst om extravasatie onder de rand van de oogkas te voorkomen. De naald wordt tijdens de injectie naar boven en mediaalwaarts gericht. Om het risico van ooglid ptosis te verkleinen mag zowel de maximale dosis van 4 Eenheden per injectieplaats als het aantal injectieplaatsen niet overschreden worden. Tevens, mag men geen injecties geven dicht bij de musculus levator palpebrae superioris, vooral bij patiënten met bredere wenkbrauw-depressorcomplexen (depressor supercilii). Injecties in de musculus corrugator dienen te gebeuren in het centrale gedeelte van die spier, een afstand van minstens 1 cm boven de boog van de wenkbrauwen.
Figuur 1:
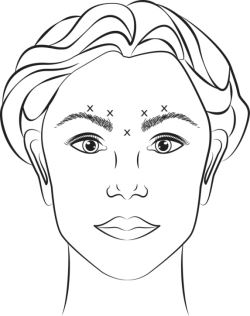
Doorgaans vermindert de ernst van de fronslijnen binnen een week na behandeling. Het effect houdt aan tot 4 maanden na injectie.
Toedieningsinstructies voor kraaienpootjes zichtbaar bij een volledige glimlach:
Gereconstitueerd VISTABEL (50 Eenheden/1,25 ml of 100 eenheden/2,5 ml) wordt geïnjecteerd met een steriele naald van 30 gauge. Op elk van de 3 injectieplaatsen per zijde (in totaal 6 injectieplaatsen) wordt 0,1 ml (4 Eenheden) toegediend in de laterale musculus orbicularis oculi, voor een totale dosis van 24 Eenheden in een totaal volume van 0,6 ml (12 Eenheden per zijde).
Om het risico op ooglid ptosis te verminderen, dient de maximale dosis van 4 Eenheden voor elke injectie en het aantal injectieplaatsen niet te worden overschreden. Bovendien moeten injecties gegeven worden temporaal van de oogkas, zodat een veilige afstand bewaard wordt ten opzichte van de spier die het ooglid bestuurt.
De afschuining van de naald wordt tijdens de injectie naar boven en weg van het oog gericht. De eerste injectie (A) moet ongeveer 1,5 tot 2,0 cm temporaal van de laterale canthus en net temporaal tot de rand van de oogkas toegediend worden. Indien de lijnen in het gebied van de kraaienpootjes zich boven en onder de laterale canthus bevinden, moet u injecteren zoals weergegeven in figuur 2. Als daarentegen de lijnen in het gebied van de kraaienpootjes vooral onder de laterale canthus zitten, moet u injecteren zoals weergegeven in figuur 3.
Figuur 2: Figuur 3:
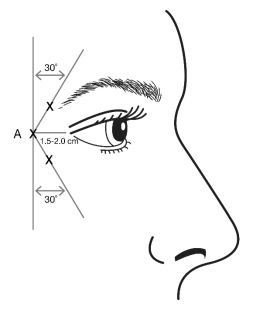
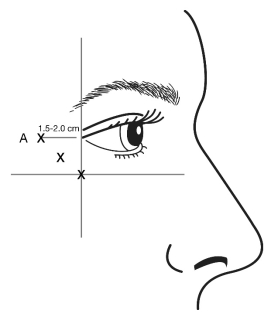
Voor simultane behandeling met fronslijnen zichtbaar bij volledige frons bedraagt de dosis 24 Eenheden voor kraaienpootjes zichtbaar bij een volledige glimlach en 20 Eenheden voor fronslijnen (zie toedieningsinstructies voor fronslijnen en figuur 1), voor een totale dosis van 44 Eenheden in een totaal volume van 1,1 ml.
Verbetering van de ernst van de kraaienpootjes, beoordeeld door de onderzoeker, werd vastgesteld binnen één week na de behandeling. Het effect werd aangetoond voor een mediaan van 4 maanden na injectie.
Instructies voor toediening bij voorhoofdslijnen die zichtbaar zijn bij maximaal opgetrokken wenkbrauwen:
Gereconstitueerde VISTABEL (50 eenheden/1,25 ml of 100 eenheden/2,5 ml) wordt geïnjecteerd met een steriele naald van 30 gauge. Op elk van de 5 injectieplaatsen in de musculus frontalis wordt 0,1 ml (4 Eenheden) toegediend, voor een totale dosering van 20 Eenheden in een totaal volume van 0,5 ml (zie afbeelding 4).
De totale dosering voor de behandeling van voorhoofdslijnen (20 Eenheden) en fronslijnen (20 Eenheden) bedraagt 40 Eenheden/1,0 ml.
Voor het bepalen van de locaties van de juiste injectieplaatsen in de musculus frontalis moet de samenhang tussen de grootte van het voorhoofd van de patiënt en de verdeling van de activiteit van de musculus frontalis worden beoordeeld.
De volgende horizontale behandelingsrijen moeten worden vastgesteld door middel van lichte palpatie van het voorhoofd in rust en bij volledig opgetrokken wenkbrauwen:
- Bovenste rand van de activiteit van de musculus frontalis: ongeveer 1 cm boven de bovenste voorhoofdplooi
- Onderste behandelingsrij: in het midden tussen de bovenste rand van de activiteit van de musculus frontalis en de wenkbrauw, ten minste 2 cm boven de wenkbrauw
- Bovenste behandelingsrij: in het midden tussen de bovenste rand van de activiteit van de musculus frontalis en de onderste behandelingsrij
De 5 injecties moeten worden geplaatst op de kruising van de horizontale behandelingsrijen en de volgende verticale markeringen:
- Op de onderste behandelingsrij op de middellijn van het gezicht en 0,5-1,5 cm mediaal aan de gepalpeerde temporale fusielijn (temporale rand); herhaal voor de andere kant.
- Op de bovenste behandelingsrij in het midden tussen de laterale en mediale locaties op de onderste behandelingsrij; herhaal voor de andere kant.
Afbeelding 4:![]()
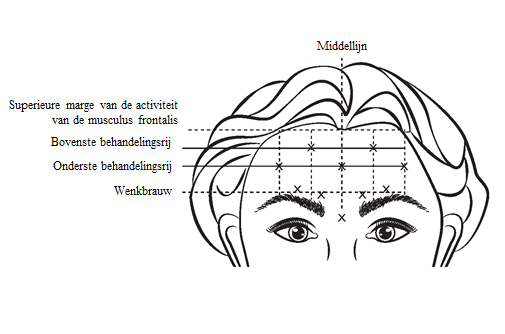
Verbetering van de ernst van voorhoofdslijnen die zichtbaar zijn bij maximaal opgetrokken wenkbrauwen trad op binnen één week na de behandeling. Het effect is aangetoond voor ongeveer 4 maanden na de injectie.
Voor de gelijktijdige behandeling van fronslijnen en kraaienpootjes bedraagt de totale dosering 64 Eenheden, onderverdeeld in 20 Eenheden voor voorhoofdslijnen, 20 Eenheden voor fronslijnen (zie Instructies voor toediening bij fronslijnen en afbeelding 1) en 24 Eenheden voor kraaienpootjes (zie Toediening bij kraaienpootjes en afbeelding 2 en 3).
Algemene informatie
Bij falen van de behandeling na de eerste behandelingssessie, d.w.z. als er een maand na injectie geen significante verbetering wordt waargenomen, kan het volgende worden overwogen:
- Analyse van de oorzaken van mislukking, bv. injectie van verkeerde spieren, verkeerde injectietechniek, vorming van toxineneutraliserende antistoffen, onvoldoende dosis;
- Herevaluatie van de relevantie van behandeling met botulinumtoxine type A.
Als er geen bijwerkingen zijn naar aanleiding van de eerste behandelingssessie, kunt u een tweede behandelingssessie starten met een tussentijd van minstens drie maanden tussen de twee behandelingssessies.
Als de dosis bij fronslijnen onvoldoende is wordt een tweede behandelingssessie gestart door de totale dosis aan te passen tot 40 of 50 Eenheden, rekening houdend met de reden van mislukken van de vorige behandeling.
De efficaciteit en de veiligheid van herhaalde injecties met VISTABEL over een periode van meer dan 12 maanden werden niet onderzocht.
4.3 Contra-indicaties
VISTABEL mag niet worden toegediend:
- bij personen met bekende overgevoeligheid voor botulinumtoxine type A of voor één van de hulpstoffen van het geneesmiddel;
- bij patiënten met myasthenia gravis of het syndroom van Eaton-Lambert;
- bij een infectie op de voorgestelde injectieplaats.
4.8 Bijwerkingen
a) Algemeen
Volgens gegevens van gecontroleerde klinische studies naar fronslijnen zichtbaar bij volledig fronsen, bedraagt het percentage patiënten waarvan wordt verwacht dat ze een bijwerking krijgen na behandeling met VISTABEL 23,5% (placebo: 19,2%). In behandelingscyclus 1 van de centraal gecontroleerde klinische onderzoeken naar kraaienpootjes zichtbaar bij een volledige glimlach, werden dergelijke bijwerkingen gerapporteerd in 7,6% (24 Eenheden voor kraaienpootjes alleen) en 6,2% (44 Eenheden: 24 Eenheden voor kraaienpootjes, samen toegediend met 20 Eenheden voor fronslijnen) van de patiënten, vergeleken met 4,5% voor placebo.
In de eerste behandelingscyclus van klinische studies naar voorhoofdslijnen die zichtbaar zijn bij maximaal opgetrokken wenkbrauwen werden bijwerkingen die door de arts werden beschouwd als gerelateerd aan VISTABEL gerapporteerd bij 20,6% van de patiënten die werden behandeld met 40 Eenheden (20 Eenheden in de musculus frontalis en 20 Eenheden in het glabellacomplex), bij 14,3% van de patiënten die werden behandeld met 64 Eenheden (20 Eenheden in de musculus frontalis, 20 Eenheden in het glabellacomplex en 24 Eenheden in gebieden met laterale canthuslijnen) en bij 8,9% van de patiënten die een placebo ontvingen.
Bijwerkingen kunnen te wijten zijn aan de behandeling, de injectietechniek of beide. Bijwerkingen treden doorgaans op enkele dagen na de injectie en zijn van voorbijgaande aard. De meeste bijwerkingen waren mild tot matig ernstig.
De verwachte farmacologische werking van het botulinumtoxine is een plaatselijke spierzwakte. Echter, zwakte van aangrenzende spieren en / of spieren op afstand van de plaats van injectie werden gerapporteerd.
Blefaroptose, eventueel te wijten aan de techniek, strookt met de farmacologische werking van VISTABEL. Zoals bij elke vorm van injectie kan de injectie aanleiding geven tot pijn/brandend of stekend gevoel, oedeem en/of een blauwe plek. Koorts en griepachtig syndroom werden ook gemeld na injectie van botulinumtoxine.
b) Bijwerkingen - frequentie
De bijwerkingen worden als volgt geclassificeerd volgens Systeem/orgaanklasse en de frequentie: Zeer vaak (≥ 1/10); vaak (≥1/100, <1/10); soms (≥1/1.000, <1/100); zelden (≥1/10.000, <1/1.000); zeer zelden (<1/10.000).
Fronslijnen
De volgende bijwerkingen van het geneesmiddel werden in de dubbelblinde, placebogecontroleerde klinische studies gerapporteerd na de injectie van 20 Eenheden VISTABEL voor alleen fronslijnen:
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Infecties en parasitaire aandoeningen | Infectie | Soms |
Psychische stoornissen | Angst | Soms |
Zenuwstelselaandoeningen | Hoofdpijn, paresthesie | Vaak |
Duizeligheid | Soms | |
Oogaandoeningen | Ptose van het ooglid | Vaak |
Blefaritis, oogpijn, gezichtsstoornis (waaronder troebel zicht) | Soms | |
Maagdarmstelselaandoeningen | Nausea | Vaak |
Droge mond | Soms |
Huid- en onderhuidaandoeningen | Erytheem, gespannen huid | Vaak |
Oedeem (gelaat, ooglid, periorbitaal), overgevoeligheid voor licht, jeuk, droge huid | Soms | |
Skeletspierstelsel- en bindweefselaandoeningen | Plaatselijke spierzwakte | Vaak |
Spiertrekkingen | Soms | |
Mephisto-effect (lateraal optrekken van de wenkbrauwen) | Soms | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Aangezichtspijn, oedeem op de plaats van injectie, ecchymose, pijn op de plaats van injectie, irritatie op de plaats van injectie | Vaak |
Griepachtig syndroom, asthenie, koorts | Soms |
Kraaienpootjes met of zonder fronslijnen
De volgende bijwerkingen van het geneesmiddel werden in de dubbelblinde, placebogecontroleerde klinische studies gerapporteerd na de injectie van VISTABEL voor kraaienpootjes met of zonder fronslijnen.
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Oogaandoeningen | Ooglidoedeem | Soms |
Algemene aandoeningen en toedieningsplaatsstoornissen | Hematoom op de plaats van injectie* | Vaak |
Bloedingen op de plaats van injectie* | Soms | |
Pijn op de plaats van injectie* | Soms | |
Paresthesie op de plaats van injectie | Soms |
* procedure-gerelateerde bijwerkingen
Voorhoofdslijnen en fronslijnen met of zonder kraaienpootjes
De volgende bijwerkingen van het middel werden in de dubbelblinde, placebogecontroleerde klinische studies gerapporteerd na de injectie van VISTABEL voor gelijktijdige behandeling van voorhoofdslijnen en fronslijnen met of zonder kraaienpootjes:
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Zenuwstelselaandoeningen | Hoofdpijn | Vaak |
Oogaandoeningen | Ooglidptosis1 | Vaak |
Huid- en onderhuidaandoeningen | Gespannen huid | Vaak |
Wenkbrauwptosis2 | Vaak | |
Skeletspierstelsel- en bindweefselaandoeningen | Mephisto-effect (lateraal optrekken van de wenkbrauwen) | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Blauwe plekken op de plaats van injectie* | Vaak |
Hematoom op de plaats van injectie* | Vaak | |
Pijn op de plaats van injectie* | Soms |
1De mediane tijd tot de aanvang van ooglidptosis was 9 dagen na de behandeling
2De mediane tijd tot de aanvang van wenkbrauwptosis was 5 dagen na de behandeling
* procedure-gerelateerde bijwerkingen
Er werd geen verandering waargenomen in het algemene veiligheidsprofiel na herhaalde dosering.
c) Postmarketinggegevens (frequentie niet bekend)
De volgende bijwerkingen of medisch relevante bijwerkingen werden gerapporteerd sinds het geneesmiddel op de markt werd gebracht voor de behandeling van fronslijnen, kraaienpootjes en andere klinische indicaties:
Systeem/orgaanklasse | Voorkeursterm |
Immuunsysteemaandoeningen | Anafylaxie, angio-oedeem, serumziekte, urticaria |
Voedings- en stofwisselingsstoornissen | Anorexie |
Zenuwstelselaandoeningen | Brachiale plexopathie, dysfonie, dysartrie, gezichtsparese, hypo-esthesie, spierzwakte, myasthenia gravis, perifere neuropathie, paresthesie, radiculopathie, syncope, gezichtsverlamming |
Oogaandoeningen | Gesloten kamerhoek glaucoom (voor behandeling van blefarospasme), ooglidptosis, lagoftalmie, strabisme, troebel zicht, gezichtsstoornissen, droge ogen, ooglidoedeem |
Evenwichtsorgaan- en ooraandoeningen | Hypoacousis, tinnitus en vertigo |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Aspiratiepneumonie, dyspneu, bronchospasme, ademhalingsdepressie en ademhalingsfalen |
Maagdarmstelselaandoeningen | Buikpijn, diarree, droge mond, dysfagie, misselijkheid en braken |
Huid- en onderhuidaandoeningen | Alopecie, wenkbrauwptosis, psoriasische huiduitslag, erythema multiforme, hyperhidrose, madarose, puritis en uitslag |
Skeletspierstelsel- en bindweefselaandoeningen | Spieratrofie, myalgie, lokale spiertrekkingen/onvrijwillige spiercontracties |
Algemene aandoeningen en toedieningsplaatsstoornissen | Denervatie atrofie, malaise en pyrexie |
Bijwerkingen die mogelijk te wijten zijn aan diffusie van het toxine weg van de plaats van toediening, werden zeer zelden gerapporteerd met het botulinumtoxine (bv. spierzwakte, dysfagie, constipatie of mogelijk fatale slikpneumonie) (zie rubriek 4.4).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het meldsysteem (zie contactgegevens hieronder):
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
AbbVie S.A.
Av. Einstein 14
1300 Wavre
België
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Injectieflacon met 50 Eenheden: BE281477
Injectieflacon met 100 Eenheden: BE545333
10. DATUM VAN HERZIENING VAN DE TEKST
07/2025
Goedkeuring: 07/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2321677 | VISTABEL ALLERGAN 50 EENHEDEN/UNITES | M03AX01 | € 133,08 | - | Ja | - | - |
| 4566188 | VISTABEL ALLERGAN 100UI PDR OPL INJ FL 1 | € 174,73 | - | Ja | - | - |