SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Rhinospray Eucalyptus Verstopte neus 1,18 mg/ml neusspray, oplossing
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
1 ml Rhinospray Eucalyptus Verstopte neus 1,18 mg/ml oplossing voor verstuiving in de neus bevat 1,18 mg tramazolinehydrochloride (= 1,25 mg tramazolinehydrochloride monohydraat).
Hulpstof met bekend effect:
Benzalkoniumchloride: 0,02 mg per verstuiving, overeenkomend met 0,2 mg/ml oplossing
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Neusspray, oplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Symptomatische behandeling van neuscongestie, bijvoorbeeld bij neusontsteking en neuskeelontsteking.
Rhinospray Eucalyptus Verstopte neus is geïndiceerd bij volwassenen en jongeren vanaf 16 jaar.
In de eerste plaats wordt aangeraden om de neus te spoelen met een zoutoplossing. Blijft de congestie na het spoelen aanhouden, dan kan Rhinospray Eucalyptus Verstopte neus worden gebruikt als tweedelijnsbehandeling.
4.2 Dosering en wijze van toediening
Dosering
Volwassenen en adolescenten vanaf 16 jaar: eerst de neus snuiten en daarna in elk neusgat 1 verstuiving toepassen, 3 à 4 maal per dag, naargelang de behoefte. De maximale dosis bedraagt 200 mcg (= 2 verstuivingen) tot 4 keer per 24 uur.
Rhinospray Eucalyptus Verstopte neus mag gedurende maximaal 5 opeenvolgende dagen worden gebruikt.
Wijze van toediening
Bij een eerste gebruik, na verwijdering van het dopje, de duim op de bodem van het flesje en wijsvinger en middenvinger op de ring rond het uiteinde brengen. Enkele malen pompen. Wanneer een lichte nevel verstoven wordt, is de microdoseur op gang gebracht (Fig. 1). Dan het hoofd in normale positie houden en de microdoseur in het neusgat brengen (Fig. 2) en indrukken terwijl men langzaam langs de neus inademt. Hetzelfde doen in het andere neusgat. Het uiteinde reinigen en het dopje terugplaatsen.
Schema's
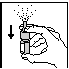
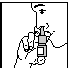
Fig. 1 Fig. 2
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor één van de in rubriek 6.1 vermelde hulpstoffen.
Rhinospray Eucalyptus Verstopte neus is gecontra-indiceerd in geval van een droge neusontsteking of gesloten-hoek-glaucoom, en na een schedeloperatie via de neus.
Niet gebruiken bij kinderen jonger dan 7 jaar.
4.8 Bijwerkingen
a) Samenvatting van het veiligheidsprofiel:
De bijwerkingen die het vaakst gerapporteerd zijn, zijn neusklachten, een droge neus en oedeem van de neus. Overgevoeligheidsreacties, waaronder oedemen van de huid en van het slijmvlies (angio-oedemen), huiduitslag, jeuk en netelroos zijn minder vaak gerapporteerd. De bijwerkingen van het hart- en vaatstelsel (hartkloppingen, tachycardie, aritmie, bloeddrukverhoging) en de bijwerkingen van het centrale zenuwstelsel (bijvoorbeeld hallucinaties, slaperigheid, zenuwachtigheid, hoofdpijn, duizeligheid en sedatie) kunnen sporadisch optreden.
b) Tabel van de bijwerkingen
De frequentie van de onderstaande bijwerkingen is gebaseerd op de bijwerkingen die tijdens 4 klinische studies met 5089 patiënten zijn gemeld.
De bijwerkingen die zijn geassocieerd met Rhinospray Eucalyptus Verstopte neus die zijn verkregen op basis van klinische studies en post-marketingonderzoek zijn hieronder opgenomen. De bijwerkingen zijn als volgt ingedeeld:
Zeer vaak (> 1/10); vaak (> 1/100 tot < 1/10); soms (> 1/1.000 tot < 1/100); zelden (> 1/10.000 tot < 1/1.000); zeer zelden (< 1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald).
ORGAANSYSTEEMKLASSE (MEDRA) | BIJWERKINGEN |
Immuunsysteemaandoeningen |
|
niet bekend | overgevoeligheid |
|
|
Psychiatrische stoornissen |
|
soms | zenuwachtigheid |
niet bekend | hallucinatie, slapeloosheid |
|
|
Zenuwstelselaandoeningen |
|
soms | hoofdpijn |
zelden | duizeligheid, dysgeusie |
niet bekend | sedatie, slaperigheid |
|
|
Hartaandoeningen |
|
soms | hartkloppingen |
niet bekend | aritmie, tachycardie |
|
|
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen |
|
vaak | neusklachten |
soms | oedeem van de neus, droge neus, rinorree, niezen |
zelden | epitaxis |
|
|
Maagdarmstelselaandoeningen |
|
soms | misselijkheid |
|
|
Huid- en onderhuidaandoeningen |
|
niet bekend | oedeem van de huid*, oedeem van het slijmvlies*, huiduitslag, jeuk |
|
|
Algemene aandoeningen en toedieningsplaatsstoornissen |
|
niet bekend | vermoeidheid |
|
|
Onderzoeken |
|
niet bekend | verhoging van de bloeddruk |
* symptoom van overgevoeligheid
c) Beschrijving van geselecteerde bijwerkingen
Gevallen van angio-oedeem (oedemen van de huid/oedemen van het slijmvlies) zijn gerapporteerd bij patiënten die behandeld zijn met Rhinospray Eucalyptus Verstopte neus .
Patiënten die geneigd zijn arteriële hypertensie te hebben, hebben een grotere kans op de ontwikkeling van een verhoging van de bloeddruk na het gebruik van Rhinospray Eucalyptus Verstopte neus .
Bij patiënten die aan prostaathypertrofie lijden, kunnen de tekenen/symptomen van deze hypertrofie erger zijn.
d) Pediatrische populatie
Rhinospray Eucalyptus Verstopte neus is gecontra-indiceerd bij kinderen jonger dan 7 jaar. Het veiligheidsprofiel bij kinderen vanaf 7 jaar is vergelijkbaar met het algemene veiligheidsprofiel van Rhinospray Eucalyptus Verstopte neus .
e) Andere bijzondere populaties
Na toediening zoals aangegeven in de bijsluiter (via de neus) is aangetoond dat 50 tot 80% van de dosis geabsorbeerd wordt. Tramazolinehydrochloride en de metabolieten ervan worden hoofdzakelijk via de nieren afgescheiden.
Er is geen enkele klinische studie uitgevoerd bij ouderen of patiënten met nier- of leverinsufficiëntie.
Wat de postmarketingervaring betreft, bestaat er geen enkel bewijs dat patiënten van andere bijzondere populaties andere/meer bijwerkingen zouden ervaren dan deze die zijn gespecificeerd in de informatie die momenteel beschikbaar is.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België: Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten – Afdeling Vigilantie – Postbus 97 – 1000 Brussel Madou – Website: www.eenbijwerkingmelden.be – E-mail: adr@fagg.be
Luxemburg: Centre Régional de Pharmacovigilance de Nancy –crpv@chru-nancy.fr – Tél.: (+33) 383 656085/87 OF Division de la Pharmacie et des Médicaments – Direction de la santé, Luxembourg – pharmacovigilance@ms.etat.lu – Tél.: (+352) 24785592 – Link naar het formulier: https://guichet.public.lu/fr/entreprises/sectoriel/sante/medecins/notification-effets-indesirables-medicaments.html
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Sanofi Belgium
Leonardo Da Vincilaan 19
1831 Diegem
Tel.: 02/710.54.00
E-mail: info.belgium@sanofi.com
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE195404
10. DATUM VAN HERZIENING VAN DE TEKST
Datum van goedkeuring: 02/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4522843 | RHINOSPRAY+EUCAL.VERST.NEUS 1,18MG/ML NEUSSPR 10ML | € 8,76 | - | Nee | - | - |