1. NAAM VAN HET GENEESMIDDEL
Benepali 50 mg oplossing voor injectie in een voorgevulde spuit
Benepali 50 mg oplossing voor injectie in een voorgevulde pen
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
50 mg oplossing voor injectie in een voorgevulde spuit
Elke voorgevulde spuit bevat 50 mg etanercept.
50 mg oplossing voor injectie in een voorgevulde pen
Elke voorgevulde pen bevat 50 mg etanercept.
Etanercept is een humaan tumornecrosefactorreceptor-p75 Fc-fusie-eiwit geproduceerd met recombinant-DNA-techniek in een zoogdierexpressiesysteem van het Chinese hamsterovarium.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie (injectie).
De oplossing is helder tot licht opaalachtig, kleurloos of lichtgeel en geformuleerd bij een pH 6,2 ± 0,3. De osmolaliteit van de oplossing is 325 ± 35 mOsm/kg.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Reumatoïde artritis
Benepali in combinatie met methotrexaat is geïndiceerd voor de behandeling van volwassenen met matige tot ernstige actieve reumatoïde artritis, waarbij de respons op disease-modifying antirheumatic drugs, waaronder methotrexaat (tenzij gecontra-indiceerd), ontoereikend is gebleken.
Benepali kan als monotherapie worden gegeven in geval van intolerantie voor methotrexaat of wanneer verdere behandeling met methotrexaat ongeschikt is.
Benepali is tevens geïndiceerd voor de behandeling van ernstige, actieve en progressieve reumatoïde artritis bij volwassenen die niet eerder behandeld zijn met methotrexaat.
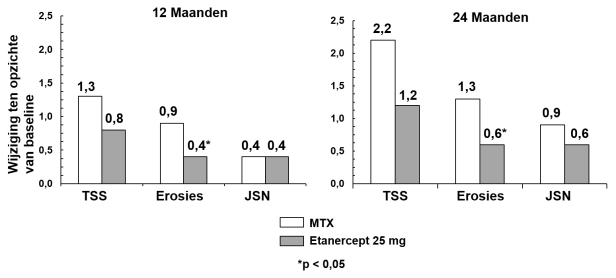
Het is gebleken dat Benepali, zowel op zichzelf gebruikt als in combinatie met methotrexaat, de progressiesnelheid van gewrichtsschade, zoals gemeten door middel van röntgenonderzoek, reduceert en het lichamelijk functioneren verbetert.
Juveniele idiopathische artritis
Behandeling van polyartritis (reumafactor positief of negatief) en uitgebreide oligoartritis bij kinderen en adolescenten vanaf 2 jaar die een ontoereikende respons hebben gehad op methotrexaat of methotrexaat niet verdroegen.
Behandeling van arthritis psoriatica bij adolescenten vanaf 12 jaar die een ontoereikende respons hebben gehad op methotrexaat of die methotrexaat niet verdroegen.
Behandeling van enthesitis-gerelateerde artritis bij adolescenten vanaf 12 jaar die een ontoereikende respons hebben gehad op conventionele therapie of die conventionele therapie niet verdroegen.
Arthritis psoriatica
Behandeling van actieve en progressieve arthritis psoriatica bij volwassenen waarbij de respons op vorige behandeling met een disease-modifying antirheumatic drug (ziektemodificerend antireumatisch geneesmiddel), ontoereikend is gebleken. Het is gebleken dat etanercept het lichamelijk functioneren van patiënten met arthritis psoriatica verbetert en de snelheid van progressie van perifere gewrichtsschade, gemeten door middel van röntgenonderzoek, vermindert bij patiënten met polyarticulaire symmetrische subtypen van de aandoening.
Axiale spondyloartritis
Spondylitis ankylopoetica
Behandeling van volwassenen met ernstige actieve spondylitis ankylopoetica met ontoereikende respons op conventionele therapie.
Niet-radiografische axiale spondyloartritis
Behandeling van volwassenen met ernstige niet-radiografische axiale spondyloartritis met objectieve verschijnselen van ontsteking, zoals aangegeven door een verhoogd C-reactief proteïne (CRP) en/of aangetoond door middel van magnetische kernspinresonantie (MRI), die een ontoereikende respons hebben gehad op niet-steroïdale ontstekingsremmers (non-steroidal anti-inflammatory drugs - NSAID’s).
Plaquepsoriasis
Behandeling van matige tot ernstige plaquepsoriasis bij volwassenen zonder respons op, of met een contra-indicatie of intolerantie voor, andere systemische therapie waaronder ciclosporine, methotrexaat of psoralenen en ultraviolet-A licht (PUVA) (zie rubriek 5.1).
Pediatrische plaquepsoriasis
Behandeling van chronische ernstige plaquepsoriasis bij kinderen en adolescenten vanaf 6 jaar met onvoldoende controle door, of intolerantie voor, andere systemische therapieën of fototherapieën.
4.2 Dosering en wijze van toediening
Behandeling met Benepali dient te worden begonnen door en onder de begeleiding te blijven van artsen, gespecialiseerd in de diagnose en behandeling van reumatoïde artritis, juveniele idiopathische artritis, arthritis psoriatica, spondylitis ankylopoetica, niet-radiografische axiale spondyloartritis, of plaquepsoriasis of pediatrische plaquepsoriasis. Aan met Benepali behandelde patiënten dient een ‘Patiëntenkaart’ te worden gegeven.
Benepali is beschikbaar in sterktes van 25 en 50 mg.
Dosering
Reumatoïde artritis
De aanbevolen dosering is 50 mg etanercept eenmaal per week toegediend (zie rubriek 5.1).
Arthritis psoriatica, spondylitis ankylopoetica en niet-radiografische axiale spondyloartritis
De aanbevolen dosering is 50 mg etanercept, eenmaal per week toegediend.
Beschikbare gegevens suggereren dat voor alle bovengenoemde indicaties een klinische respons gewoonlijk binnen 12 behandelweken wordt bereikt. Indien een patiënt niet reageert binnen dit tijdsbestek dient een vervolgbehandeling zorgvuldig te worden overwogen.
Plaquepsoriasis
De aanbevolen dosering is 50 mg etanercept, eenmaal per week toegediend. Als alternatief kan voor maximaal 12 weken tweemaal per week 50 mg worden gebruikt, indien nodig gevolgd door een dosering van 50 mg eenmaal per week. De behandeling met Benepali dient te worden voortgezet tot remissie wordt bereikt, gedurende maximaal 24 weken. Voortdurende behandeling na 24 weken kan geschikt zijn voor sommige volwassen patiënten (zie rubriek 5.1). De behandeling dient te worden gestaakt bij patiënten die na 12 weken geen respons vertonen. Als herbehandeling met Benepali is geïndiceerd, dient dezelfde richtlijn over de behandelingsduur te worden gevolgd. De dosis dient 50 mg eenmaal per week te zijn.
Bijzondere populaties
Nier- en leverfunctiestoornis
Er is geen doseringsaanpassing noodzakelijk.
Ouderen
Er is geen doseringsaanpassing noodzakelijk. Dosering en toediening zijn dezelfde als bij volwassenen van 18-64 jaar.
Pediatrische patiënten
Benepali is uitsluitend beschikbaar als voorgevulde spuit van 25 mg, voorgevulde spuit van 50 mg en voorgevulde pen van 50 mg.
Het is dus niet mogelijk om Benepali toe te dienen aan pediatrische patiënten die minder dan een volledige dosis van 25 mg of 50 mg nodig hebben. Pediatrische patiënten die een andere dosis dan een volledige dosis van 25 mg of 50 mg nodig hebben, mogen geen Benepali krijgen. Als er een alternatieve dosis nodig is, moeten andere etanerceptproducten worden gebruikt die een dergelijke optie aanbieden.
De dosis etanercept is gebaseerd op het lichaamsgewicht van pediatrische patiënten. Patiënten die minder dan 62,5 kg wegen, moeten nauwkeurig gedoseerd worden op basis van mg/kg gebruikmakend van het poeder en het oplosmiddel voor oplossing voor injectie of het poeder voor oplossing voor injectie (zie hieronder de dosering voor specifieke indicaties). Patiënten die 62,5 kg of meer wegen, kunnen met een voorgevulde spuit of voorgevulde pen met vaste dosis worden gedoseerd.
De veiligheid en werkzaamheid van etanercept bij kinderen jonger dan 2 jaar zijn niet vastgesteld.
Er zijn geen gegevens beschikbaar.
Juveniele idiopathische artritis
De aanbevolen dosering is 0,4 mg/kg (tot een maximum van 25 mg per dosis), tweemaal per week toegediend als subcutane injectie met een interval van 3-4 dagen tussen twee doses, of 0,8 mg/kg (tot een maximum van 50 mg per dosis) eenmaal per week toegediend. Het stoppen van de behandeling dient overwogen te worden bij patiënten die geen respons laten zien na 4 maanden.
Een injectieflacon met 10 mg kan geschikter zijn voor toediening aan kinderen met juveniele idiopathische artritis die een lichaamsgewicht van minder dan 25 kg hebben.
Er zijn geen formele klinische onderzoeken uitgevoerd bij kinderen van 2 tot 3 jaar oud. Beperkte veiligheidsdata uit een patiëntenregister suggereren echter dat het veiligheidsprofiel bij kinderen van 2 tot 3 jaar oud, die eenmaal per week 0,8 mg/kg subcutaan toegediend krijgen, vergelijkbaar is met dat bij volwassenen en kinderen van 4 jaar en ouder (zie rubriek 5.1).
Er is in het algemeen geen geëigend gebruik van etanercept bij kinderen jonger dan 2 jaar in de indicatie juveniele idiopathische artritis.
Pediatrische plaquepsoriasis (leeftijd 6 jaar en ouder)
De aanbevolen dosering is 0,8 mg/kg (tot een maximum van 50 mg per dosis) eenmaal per week gedurende maximaal 24 weken. De behandeling dient gestaakt te worden bij patiënten die na 12 weken geen respons vertonen.
Wanneer een herhalingsbehandeling met Benepali geïndiceerd wordt, dient bovenstaande richtlijn voor de duur van de behandeling opgevolgd te worden. De dosering dient 0,8 mg/kg (tot een maximum van 50 mg per dosis) eenmaal per week te zijn.
Er is in het algemeen geen geëigend gebruik van etanercept bij kinderen jonger dan 6 jaar in de indicatie plaquepsoriasis.
Wijze van toediening
Benepali is voor subcutaan gebruik (zie rubriek 6.6).
Uitgebreide instructies voor de toediening worden gegeven in de bijsluiter, rubriek 7, ‘Instructies voor gebruik’.
Gedetailleerde instructies over onbedoelde afwijkingen van het doseringsschema, inclusief gemiste doses, zijn vermeld in rubriek 3 van de bijsluiter.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Sepsis of kans op sepsis.
Behandeling met Benepali mag niet worden begonnen bij patiënten met actieve infecties, met inbegrip van chronische of lokale infecties.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest gerapporteerde bijwerkingen zijn reacties op de injectieplaats (waaronder pijn, zwelling, jeuk, rood worden en bloeding op de punctieplaats), infecties (waaronder infecties van de bovenste luchtwegen, bronchitis, blaasontsteking en huidinfecties), hoofdpijn, allergische reacties, vorming van autoantilichamen, jeuk en koorts.
Ernstige bijwerkingen zijn ook gerapporteerd voor etanercept. TNF-antagonisten, zoals etanercept, hebben effect op het immuunsysteem en het gebruik ervan kan de afweer van het lichaam tegen infecties en kanker beïnvloeden. Ernstige infecties komen voor bij minder dan 1 op 100 patiënten behandeld met etanercept. Meldingen betroffen ook fatale en levensbedreigende infecties en sepsis. Verschillende maligniteiten zijn ook gerapporteerd tijdens het gebruik van etanercept, waaronder borstkanker, longkanker, huidkanker en lymfeklierkanker (lymfoom).
Ernstige hematologische, neurologische en auto-immuunreacties zijn ook gerapporteerd. Deze omvatten zeldzame meldingen van pancytopenie en zeer zeldzame meldingen van aplastische anemie. Centrale en perifere demyeliniserende aandoeningen zijn respectievelijk zelden en zeer zelden waargenomen tijdens het gebruik van etanercept. Er zijn zeldzame meldingen geweest van lupus, lupusgerelateerde aandoeningen en vasculitis.
Overzicht van bijwerkingen in tabelvorm
De lijst met bijwerkingen die hieronder is weergegeven, is gebaseerd op ervaring uit klinische onderzoeken en op postmarketingervaring.
Binnen de systeem/orgaanklassen worden de bijwerkingen vermeld onder kopjes met frequenties (aantal patiënten waarvan verwacht wordt dat ze de bijwerking zullen krijgen). Het gaat daarbij om de volgende categorieën: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Systeem/orgaanklasse | Zeer vaak | Vaak | Soms | Zelden | Zeer zelden | Niet bekend (kan met de beschikbare gegevens niet worden bepaald) |
Infecties en parasitaire aandoeningen | Infectie (waaronder bovenste luchtweginfectie, bronchitis, cystitis, huidinfectie)* |
| Ernstige infecties (waaronder pneumonie, cellulitis, artritis bacterieel, sepsis en parasitaire infectie)* | Tuberculose, opportunistische infecties (waaronder invasieve schimmel-, protozoale, bacteriële, atypische mycobacteriële, virale infecties en Legionella)* |
| Hepatitis B-reactivering, listeria |
Neoplasmata, benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) |
|
| Niet-melanome huidkankers* (zie rubriek 4.4) | Maligne melanomen (zie rubriek 4.4), lymfoom, leukemie |
| Merkelcelcarcinoom (zie rubriek 4.4), Kaposi-sarcoom |
Bloed- en lymfestelselaandoeningen |
|
| Trombocytopenie, anemie, leukopenie, neutropenie | Pancytopenie* | Aplastische anemie* | Histiocytose hematofaag (macrofaagactivatiesyndroom)* |
Immuunsysteemaandoeningen |
| Allergische reacties (zie Huid- en onderhuidaandoeningen), autoantilichaamvorming* | Vasculitis (waaronder antineutrofielen-cytoplasma-antilichaamgeassocieerde vasculitis) | Ernstige allergische/anafylactische reacties (waaronder angio-oedeem, bronchospasme), sarcoïdose |
| Verergering van symptomen van dermatomyositis |
Zenuwstelselaandoeningen | Hoofdpijn |
|
| Gevallen van demyelinisatie van het CZS wijzend op multipele sclerose of gelokaliseerde demyeliniserende aandoeningen, zoals neuritis optica en myelitis transversa (zie rubriek 4.4), perifere demyelinisatie, waaronder Guillain- Barré-syndroom, chronische inflammatoire demyeliniserende polyneuropathie, demyeliniserende polyneuropathie en multifocale motorische neuropathie (zie rubriek 4.4), epileptische aanval |
|
|
Oogaandoeningen |
|
| Uveïtis, scleritis |
|
|
|
Hartaandoeningen |
|
| Verergering van congestief hartfalen (zie rubriek 4.4) | Nieuw ontstaan van congestief hartfalen (zie rubriek 4.4) |
|
|
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen |
|
|
| Interstitiële longaandoening (waaronder pneumonitis en longfibrose)* |
|
|
Maagdarmstelselaandoeningen |
|
| Inflammatoire darmziekte |
|
|
|
Lever- en galaandoeningen |
|
| Verhoogde leverenzymen* | Auto-immuunhepatitis* |
|
|
Huid- en onderhuidaandoeningen |
| Pruritus,uitslag | Angio-oedeem, psoriasis (waaronder nieuwe of erger wordende pustuleuze, voornamelijk op de handpalmen en voetzolen), urticaria, psoriasiforme huiduitslag | Stevens-Johnson-syndroom, cutane vasculitis (waaronder overgevoeligheids vasculitis), erythema multiforme, lichenoïde reacties | Toxische epidermale necrolyse |
|
Skeletspierstelsel- en bindweefselaandoeningen |
|
|
| Cutane lupus erythematosus, subacute cutane lupus erythematosus, lupusachtig syndroom |
|
|
Nier- en urinewegaandoeningen |
|
|
| Glomerulonefritis |
|
|
Algemene aandoeningen en toedieningsplaatsstoornissen | Reacties op de injectieplaats (waaronder bloeding, blauwe plekken, erytheem, jeuk, pijn, zwelling)* | Pyrexie |
|
|
|
|
*Zie Beschrijving van geselecteerde bijwerkingen hieronder | ||||||
Beschrijving van geselecteerde bijwerkingen
Maligniteiten en lymfoproliferatieve aandoeningen
Honderdnegenentwintig (129) nieuwe maligniteiten van verschillende types werden geobserveerd bij 4114 patiënten met reumatoïde artritis die in klinische studies behandeld werden met etanercept gedurende maximaal ongeveer 6 jaar, waaronder 231 patiënten die behandeld werden met etanercept in combinatie met methotrexaat tijdens het 2 jaar durend, actiefgecontroleerd onderzoek. De waargenomen frequentie en incidentie in deze klinische studies waren overeenkomstig de verwachting voor de bestudeerde populatie. Een totaal aantal van 2 maligniteiten werd gemeld in klinische onderzoeken die ongeveer 2 jaar duurden en die 240 met etanercept behandelde patiënten met arthritis psoriatica omvatten. In klinische onderzoeken die gedurende meer dan 2 jaar werden uitgevoerd met 351 patiënten met spondylitis ankylopoetica, werden 6 maligniteiten gemeld onder de met etanercept behandelde patiënten. In een groep van 2711 patiënten met plaquepsoriasis die met etanercept behandeld werden in dubbelblinde en open-label onderzoeken van maximaal 2,5 jaar werden 30 maligniteiten en 43 NMHK’s gemeld.
In een groep van 7416 met etanercept behandelde patiënten in klinische studies voor reumatoïde artritis, arthritis psoriatica, spondylitis ankylopoetica en psoriasis werden 18 lymfomen gemeld.
Tijdens de postmarketingperiode waren er ook meldingen van verscheidene maligniteiten (waaronder borst- en longcarcinoom en lymfoom) (zie rubriek 4.4).
Reacties op de injectieplaats
Vergeleken met placebo hadden patiënten met reumatische aandoeningen die met etanercept werden behandeld een significant hogere incidentie van reacties op de plaats van injectie (36% versus 9%). Reacties op de plaats van injectie vonden gewoonlijk plaats in de eerste maand. De gemiddelde duur was ongeveer 3 tot 5 dagen. Voor de meerderheid van de reacties op de plaats van injectie in de met etanercept behandelde groep werd geen behandeling gegeven en de meerderheid van de patiënten die wel behandeld werden, kregen lokale preparaten, zoals corticosteroïden, of orale antihistaminica. Daarnaast ontwikkelden zich bij sommige patiënten geheugenreacties op de plaats van injectie, die werden gekarakteriseerd door een huidreactie op de meest recente plaats van injectie, samen met een simultane verschijning van reacties op de plaats van de vorige injecties. Deze reacties waren in het algemeen van voorbijgaande aard en keerden niet terug in de loop van de behandeling.
In gecontroleerde onderzoeken bij patiënten met plaquepsoriasis ontwikkelde ongeveer 13,6% van de met etanercept behandelde patiënten reacties op de plaats van injectie vergeleken met 3,4% van de met placebo behandelde patiënten gedurende de eerste 12 weken van behandeling.
Ernstige infecties
In placebogecontroleerd onderzoek werd geen verhoging van de incidentie van ernstige infecties (fataal, levensbedreigend, of met de noodzaak tot ziekenhuisopnames of intraveneuze antibiotica) waargenomen. Ernstige infecties traden op in 6,3% van de patiënten met reumatoïde artritis die met etanercept behandeld werden gedurende maximaal 48 maanden. Deze bestonden uit abces (op verschillende plaatsen), bacteriëmie, bronchitis, bursitis, cellulitis, cholecystitis, diarree, diverticulitis, endocarditis (verdenking), gastro-enteritis, hepatitis B, herpes zoster, beenulcus, mondinfectie, osteomyelitis, otitis, peritonitis, pneumonie, pyelonefritis, sepsis, septische artritis, sinusitis, huidinfectie, huidulcus, urineweginfectie, vasculitis en wondinfectie. In het twee jaar durend actief-gecontroleerd onderzoek waarin patiënten werden behandeld met alleen etanercept, of alleen methotrexaat of met etanercept in combinatie met methotrexaat, waren de aantallen ernstige infecties gelijk in de verschillende behandelingsgroepen. Het kan echter niet worden uitgesloten dat de combinatie van etanercept en methotrexaat verband zou kunnen houden met een verhoogd percentage infecties.
Er waren geen verschillen in infectiepercentages tussen patiënten die behandeld werden met etanercept en die behandeld werden met placebo voor plaquepsoriasis in placebogecontroleerde onderzoeken die tot 24 weken duurden. Ernstige infecties die de met etanercept behandelde patiënten ondervonden, waren cellulitis, gastro-enteritis, pneumonie, cholecystitis, osteomyelitis, gastritis, appendicitis, streptokokkenfasciitis, myositis, septische shock, diverticulitis en abces. In de dubbelblinde en open-label arthritis psoriatica-onderzoeken meldde 1 patiënt een ernstige infectie (pneumonie).
Ernstige en fatale infecties zijn gerapporteerd tijdens het gebruik van etanercept; gemelde pathogenen waren onder andere bacteriën, mycobacteriën (waaronder M. tuberculosis), virussen en schimmels. Sommige hebben plaatsgevonden binnen enkele weken na het starten van de behandeling met etanercept bij patiënten met onderliggende ziektes (bijv. diabetes, congestief hartfalen, een voorgeschiedenis van actieve of chronische infectie) naast hun reumatoïde artritis (zie rubriek 4.4). Behandeling met etanercept zou de mortaliteit kunnen verhogen bij patiënten met vastgestelde sepsis.
Opportunistische infecties zijn gemeld in associatie met etanercept, inclusief invasieve schimmel-, parasitaire (inclusief protozoale), virale (waaronder herpes zoster), bacteriële (inclusief Listeria en Legionella) en atypische mycobacteriële infecties. In een gepoolde dataset van klinische onderzoeken was de totale incidentie van opportunistische infecties 0,09% voor de 15.402 patiënten die etanercept kregen. De incidentie aangepast aan de duur van blootstelling was 0,06 gebeurtenissen per 100 patiëntjaren. In postmarketingervaring bestond ongeveer de helft van alle wereldwijde case reports van opportunistische infecties uit invasieve schimmelinfecties. De meest voorkomende gerapporteerde invasieve schimmelinfecties omvatten Candida, Pneumocystis, Aspergillus en Histoplasma. Invasieve schimmelinfecties veroorzaakten meer dan de helft van de overlijdensgevallen onder patiënten die opportunistische infecties ontwikkelden. De meerderheid van de meldingen met een fatale uitkomst was bij patiënten met pneumonie door Pneumocystis, ongespecificeerde systemische schimmelinfecties en aspergillose (zie rubriek 4.4).
Autoantilichamen
Van volwassen patiënten werd op meerdere tijdstippen serum getest op autoantilichamen. Van de patiënten met reumatoïde artritis die geëvalueerd werden op antinucleaire antilichamen (ANA) was het percentage patiënten dat nieuwe positieve ANA ontwikkelde (≥ 1:40) hoger bij de met etanercept behandelde patiënten (11%) dan bij de met placebo behandelde patiënten (5%). Het percentage patiënten dat nieuwe positieve anti-ds-DNA ontwikkelde was ook groter met radio-immuunbepaling (15% van de patiënten die behandeld werden met etanercept vergeleken met 4% van de met placebo-behandelde patiënten) en met de Crithidia lucida-test (3% van de met etanercept behandelde patiënten vergeleken met geen van de met placebo-behandelde patiënten). Van de patiënten die behandeld werden met etanercept was de proportie die anticardiolipineantilichamen ontwikkelde, vergelijkbaar verhoogd vergeleken met de met placebo-behandelde patiënten. De invloed van langdurige behandeling met etanercept op het ontstaan van auto-immuunziekten is niet bekend.
Er zijn zeldzame meldingen geweest van patiënten, inclusief reumafactorpositieve patiënten, die andere autoantilichamen hebben ontwikkeld in samenhang met een lupusachtig syndroom of uitslag welke qua klinische presentatie en biopsie vergelijkbaar is met subactieve huidlupus of discoïde lupus.
Pancytopenie en aplastische anemie
Er waren postmarketingmeldingen van pancytopenie en aplastische anemie waarvan sommige een fatale afloop hadden (zie rubriek 4.4).
Interstitiële longaandoening
In gecontroleerde klinische onderzoeken met etanercept bij alle indicaties bedroeg de frequentie (incidentie als proportie) van interstitiële longaandoening bij patiënten die etanercept kregen, zonder dat ze gelijktijdig ook methotrexaat kregen 0,06% (frequentie zelden). In de gecontroleerde klinische onderzoeken die gelijktijdige behandeling met etanercept en methotrexaat toestonden, bedroeg de frequentie (incidentie als proportie) van interstitiële longaandoening 0,47% (frequentie soms). Er waren postmarketingmeldingen van interstitiële longaandoening (inclusief pneumonitis en longfibrose) waarvan sommige een fatale afloop hadden.
Gelijktijdige behandeling met anakinra
In onderzoeken waarin volwassen patiënten gelijktijdig behandeld werden met etanercept en anakinra, werd een hoger percentage ernstige infecties gevonden dan bij patiënten die alleen met etanercept behandeld werden en bij 2% van de patiënten (3/139) ontwikkelde zich neutropenie (absoluut aantal neutrofielen < 1000/mm3). Eén neutropenische patiënt ontwikkelde cellulitis die na ziekenhuisopname vanzelf verdween (zie rubriek 4.4 en 4.5).
Verhoogde leverenzymen
In de dubbelblinde periodes van gecontroleerde klinische onderzoeken met etanercept bij alle indicaties, bedroeg de frequentie (incidentie als proportie) van de bijwerking verhoogde leverenzymen bij patiënten die etanercept kregen, zonder dat ze gelijktijdig ook methotrexaat kregen 0,54% (frequentie soms). In de dubbelblinde periodes van gecontroleerde klinische onderzoeken die gelijktijdige behandeling met etanercept en methotrexaat toestonden, bedroeg de frequentie (incidentie als proportie) van de bijwerking verhoogde leverenzymen 4,18% (frequentie vaak).
Auto-immuunhepatitis
In gecontroleerde klinische onderzoeken met etanercept bij alle indicaties bedroeg de frequentie (incidentie als proportie) van auto-immuunhepatitis bij patiënten die etanercept kregen, zonder dat ze gelijktijdig ook methotrexaat kregen 0,02% (frequentie zelden). In de gecontroleerde klinische onderzoeken die gelijktijdige behandeling met etanercept en methotrexaat toestonden, bedroeg de frequentie (incidentie als proportie) van auto-immuunhepatitis 0,24% (frequentie soms).
Pediatrische patiënten
Bijwerkingen bij pediatrische patiënten met juveniele idiopathische artritis
In het algemeen waren de bijwerkingen bij kinderen met juveniele idiopathische artritis overeenkomstig in frequentie en type met de bijwerkingen die gezien werden bij volwassenen. Verschillen met volwassenen en andere speciale overwegingen staan beschreven in de volgende paragrafen.
De typen infecties die werden gezien in klinische studies met patiënten van 2 tot 18 jaar met juveniele idiopathische artritis waren meestal licht tot matig en kwamen overeen met de typen infecties die vaak gezien worden bij poliklinische pediatrische patiënten. Ernstige bijwerkingen die werden gerapporteerd omvatten varicella met verschijnselen en symptomen van aseptische meningitis die zonder sequela verdwenen (zie ook rubriek 4.4), appendicitis, gastro-enteritis, depressie/persoonlijkheidsstoornis, huidulcus, oesofagitis/gastritis, septische shock door groep A-streptokokken, diabetes mellitus type I en infectie van weke delen en postoperatieve wonden.
In één onderzoek met kinderen van 4 tot 17 jaar met juveniele idiopathische artritis liepen 43 van de 69 (62%) kinderen een infectie op terwijl ze etanercept kregen gedurende 3 maanden van het onderzoek (deel 1, open-label). De frequentie en ernst van de infecties was vergelijkbaar bij 58 patiënten die de 12 maanden durende open-label extensietherapie afgerond hadden. De typen en proportie van bijwerkingen bij patiënten met juveniele idiopathische artritis waren gelijk aan die gezien werden in onderzoeken met etanercept bij volwassen patiënten met reumatoïde artritis en waren merendeels licht van aard. Verschillende bijwerkingen werden meer gerapporteerd bij 69 patiënten met juveniele idiopathische artritis die gedurende 3 maanden etanercept kregen dan bij de 349 volwassen patiënten met reumatoïde artritis. Deze omvatten hoofdpijn (19% van de patiënten, 1,7 gebeurtenissen per patiëntjaar), misselijkheid (9%, 1,0 gebeurtenis per patiëntjaar), buikpijn (19%, 0,74 gebeurtenissen per patiëntjaar) en braken (13%, 0,74 gebeurtenissen per patiëntjaar).
Er waren 4 meldingen van het macrofaagactivatiesyndroom in klinische studies met juveniele idiopathische artritis.
Bijwerkingen bij kinderen met plaquepsoriasis
In een 48 weken durend onderzoek met 211 kinderen in de leeftijd van 4 tot 17 jaar met plaquepsoriasis waren de gemelde bijwerkingen vergelijkbaar met de bijwerkingen die in eerdere onderzoeken met volwassenen met plaquepsoriasis werden gezien.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico's van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via
Nederland
Nederlands Bijwerkingen Centrum Lareb
Website: www.lareb.nl
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Samsung Bioepis NL B.V.
Olof Palmestraat 10
2616 LR Delft
Nederland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/15/1074/001
EU/1/15/1074/002
EU/1/15/1074/003
EU/1/15/1074/004
10. DATUM VAN HERZIENING VAN DE TEKST
08/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3456688 | BENEPALI 50MG OPL INJ VOORGEVULDE PEN 4 | L04AB01 | € 464,34 | - | Ja | € 12,5 | € 8,3 |
| 3456696 | BENEPALI 50MG OPL INJ VOORGEVULDE SPUIT 4 | L04AB01 | € 464,34 | - | Ja | € 12,5 | € 8,3 |
| 3518354 | BENEPALI 50MG OPL INJ VOORGEVULDE SPUIT 12 | L04AB01 | € 1314,63 | - | Ja | € 12,5 | € 8,3 |
| 3518362 | BENEPALI 50MG OPL INJ VOORGEVULDE PEN 12 | L04AB01 | € 1314,63 | - | Ja | € 12,5 | € 8,3 |