1. NAAM VAN HET GENEESMIDDEL
EXJADE 90 mg filmomhulde tabletten
EXJADE 180 mg filmomhulde tabletten
EXJADE 360 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
EXJADE 90 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 90 mg deferasirox.
EXJADE 180 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 180 mg deferasirox.
EXJADE 360 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 360 mg deferasirox.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet
EXJADE 90 mg filmomhulde tabletten
Lichtblauwe, ovale, biconvexe filmomhulde tablet met schuine randen en inscripties (NVR op de ene en 90 op de andere zijde). Tabletafmetingen zijn ongeveer 10,7 mm x 4,2 mm.
EXJADE 180 mg filmomhulde tabletten
Middenblauwe, ovale, biconvexe filmomhulde tablet met schuine randen en inscripties (NVR op de ene en 180 op de andere zijde). Tabletafmetingen zijn ongeveer 14 mm x 5,5 mm.
EXJADE 360 mg filmomhulde tabletten
Donkerblauwe, ovale, biconvexe filmomhulde tablet met schuine randen en inscripties (NVR op de ene en 360 op de andere zijde). Tabletafmetingen zijn ongeveer 17 mm x 6,7 mm.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
EXJADE is geïndiceerd voor de behandeling van chronische ijzerstapeling als gevolg van veelvuldige bloedtransfusies (7 ml/kg/maand rode bloedcellen) bij patiënten van 6 jaar en ouder met bètathalassemie major.
EXJADE is ook geïndiceerd voor de behandeling van chronische ijzerstapeling als gevolg van bloedtransfusies wanneer deferoxamine behandeling gecontra-indiceerd of inadequaat is in de volgende patiëntengroepen:
- pediatrische patiënten met bètathalassemie major met ijzerstapeling als gevolg van veelvuldige bloedtransfusies (7 ml/kg/maand rode bloedcellen) in de leeftijd van 2 tot 5 jaar,
- volwassen en pediatrische patiënten met bètathalassemie major met ijzerstapeling als gevolg van occasionele bloedtransfusies (<7 ml/kg/maand rode bloedcellen) in de leeftijd van 2 jaar en ouder,
- volwassen en pediatrische patiënten met andere anemieën in de leeftijd van 2 jaar en ouder.
EXJADE is ook geïndiceerd voor de behandeling van chronische ijzerstapeling waarbij chelatietherapie noodzakelijk is en wanneer deferoxaminebehandeling gecontra-indiceerd of inadequaat is bij patiënten in de leeftijd van 10 jaar en ouder met niet-transfusieafhankelijke thalassemiesyndromen.
4.2 Dosering en wijze van toediening
Behandeling met EXJADE dient te worden gestart en onderhouden door artsen die ervaring hebben met de behandeling van chronische ijzerstapeling.
Dosering
Transfusiegerelateerde ijzerstapeling en niet-transfusieafhankelijke thalassemiesyndromen vereisen verschillende doseringen. Alle artsen die EXJADE willen voorschrijven, moeten ervoor zorgen dat ze het educatieve materiaal voor artsen hebben ontvangen en ermee vertrouwd zijn (de handleiding voor beroepsbeoefenaren in de gezondheidszorg, inclusief een checklist voor voorschrijvers).
Transfusiegerelateerde ijzerstapeling
Doses (in mg/kg lichaamsgewicht) moeten worden berekend en afgerond naar de dichtstbijzijnde gehele tabletgrootte.
Voorzichtigheid is geboden tijdens chelatietherapie om het risico op overchelatie bij alle patiënten te minimaliseren (zie rubriek 4.4).
In de EU zijn geneesmiddelen die deferasirox bevatten beschikbaar als filmomhulde tabletten en als dispergeerbare tabletten, gecommercialiseerd onder verschillende merknamen als generieke alternatieven voor EXJADE. Vanwege verschillende farmacokinetische profielen, is een 30% lagere dosis van EXJADE filmomhulde tabletten nodig in vergelijking met de aanbevolen dosis van EXJADE dispergeerbare tabletten (zie rubriek 5.1).
Startdosering
Het wordt aanbevolen om de behandeling te starten na transfusie van ongeveer 20 eenheden (ongeveer 100 ml/kg) verpakte rode bloedcellen (PRBC) of wanneer er bewijs is uit klinische monitoring dat er sprake is van chronische ijzerstapeling (bijv. serumferritine >1.000 µg/l) (zie Tabel 1).
Tabel 1 Aanbevolen startdoseringen voor transfusiegerelateerde ijzerstapeling
Aanbevolen startdosering | |||
Serumferritine |
| Patiëntenpopulatie | Aanbevolen startdosering |
>1.000 µg/l | of | Patiënten die al ongeveer 20 eenheden (ongeveer 100 ml/kg) PRBC hebben ontvangen. | 14 mg/kg/dag |
Alternatieve startdosering | |||
Patiëntenpopulatie | Alternatieve startdosering | ||
Patiënten die geen verlaging van het ijzergehalte in het lichaam nodig hebben en die ook <7 ml/kg/maand PRBC krijgen (ongeveer <2 eenheden/maand voor een volwassene). De respons van de patiënt moet worden gecontroleerd en een dosisverhoging moet worden overwogen als er onvoldoende werkzaamheid wordt verkregen. | 7 mg/kg/dag | ||
Patiënten die een verlaging van het verhoogde ijzergehalte nodig hebben en die ook >14 ml/kg/maand PRBC krijgen (ongeveer >4 eenheden/maand voor een volwassene). | 21 mg/kg/dag | ||
Patiënten die goed reageren op deferoxamine. | Een derde van de dosis deferoxamine* | ||
*Een startdosering die numeriek een derde is van de dosis deferoxamine (bijv. een patiënt die 40 mg/kg/dag deferoxamine gedurende 5 dagen per week [of equivalent] krijgt, kan worden overgezet naar een startdosering van 14 mg/kg/dag van EXJADE filmomhulde tabletten). Wanneer dit resulteert in een dagelijkse dosering <14 mg/kg, moet de respons van de patiënt worden gecontroleerd en moet een dosisverhoging worden overwogen als er onvoldoende werkzaamheid wordt verkregen (zie rubriek 5.1). | |||
Dosisaanpassing
Aangeraden wordt om serumferritine elke maand te controleren en de dosis van EXJADE filmomhulde tabletten indien nodig elke 3 tot 6 maanden aan te passen op basis van de ontwikkeling van de waarde van het serumferritine (zie Tabel 2). Dosisaanpassingen kunnen worden gedaan in stappen van 3,5 tot 7 mg/kg/dag en kunnen worden aangepast aan de respons van de individuele patiënt en het therapeutisch doel (onderhoud of reductie van ijzerbelasting).
Tabel 2 Aanbevolen dosisaanpassingen voor transfusiegerelateerde ijzerstapeling
Serumferritine (maandelijkse controle) | Aanbevolen dosisaanpassing |
Aanhoudend >2.500 µg/l en geen dalende trend in de tijd | Verhoog de dosis elke 3 tot 6 maanden in stappen van 3,5 tot 7 mg/kg/dag. |
>1.000 µg/l maar aanhoudend ≤2.500 µg/l met een dalende trend in de tijd | Verlaag de dosis elke 3 tot 6 maanden in stappen van 3,5 tot 7 mg/kg/dag bij patiënten die worden behandeld met doseringen >21 mg/kg/dag, tot het doel van 500 tot en met 1.000 µg/l is bereikt. |
500 tot en met 1.000 µg/l (streefbereik) | Verlaag de dosis in stappen van 3,5 tot 7 mg/kg/dag elke 3 tot 6 maanden om de serumferritinewaarden binnen het streefbereik te houden en het risico op overchelatie tot een minimum te beperken. |
Consequent <500 µg/l | Overweeg een onderbreking van de behandeling (zie rubriek 4.4). |
De beschikbaarheid van data over langdurige werkzaamheid en veiligheid uit klinische studies die uitgevoerd zijn met EXJADE dispergeerbare tabletten gebruikt bij doses hoger dan 30 mg/kg (equivalent aan 21 mg/kg wanneer gegeven als filmomhulde tablet) is momenteel beperkt (264 patiënten zijn gemiddeld 1 jaar gevolgd na dosisverhoging). Doses hoger dan 28 mg/kg/dag worden niet aanbevolen omdat er slechts beperkte ervaring is met doses hoger dan deze dosis (zie rubriek 5.1).
Niet-transfusieafhankelijke thalassemiesyndromen
Chelatietherapie dient alleen te worden gestart wanneer er aanwijzingen zijn voor ijzerstapeling (ijzerconcentratie in de lever [LIC] ≥5 mg Fe/g droog gewicht [dw] of serumferritine voortdurend >800 µg/l). LIC is de voorkeursmethode voor het bepalen van ijzerstapeling en dient te worden gebruikt indien beschikbaar. Bij alle patiënten is voorzichtigheid geboden tijdens chelatietherapie om het risico op een te sterke chelatie te minimaliseren (zie rubriek 4.4).
In de EU zijn geneesmiddelen die deferasirox bevatten beschikbaar als filmomhulde tabletten en als dispergeerbare tabletten, gecommercialiseerd onder verschillende merknamen als generieke alternatieven voor EXJADE. Vanwege verschillende farmacokinetische profielen, is een 30% lagere dosis van EXJADE filmomhulde tabletten nodig in vergelijking met de aanbevolen dosis van EXJADE dispergeerbare tabletten (zie rubriek 5.1).
Startdosering
De aanbevolen startdosering van EXJADE filmomhulde tabletten bij patiënten met niet-transfusieafhankelijke thalassemiesyndromen is 7 mg/kg lichaamsgewicht/dag.
Dosisaanpassing
Aanbevolen wordt om serumferritine elke maand te controleren om de respons van de patiënt op de behandeling te beoordelen en het risico op overchelatie te minimaliseren (zie rubriek 4.4). Aanbevolen dosisaanpassingen voor niet-transfusieafhankelijke thalassemiesyndromen zijn samengevat in Tabel 3.
Tabel 3 Aanbevolen dosisaanpassingen voor niet-transfusieafhankelijke thalassemiesyndromen
Serumferritine (maandelijkse controle) |
| IJzerconcentratie in de lever (LIC)* | Aanbevolen dosisaanpassing |
Consequent >2.000 µg/l en laat geen dalende trend zien | of | ≥7 mg Fe/g droog gewicht | Verhoog de dosis elke 3 tot 6 maanden in stappen van 3,5 tot 7 mg/kg/dag als de patiënt het geneesmiddel goed verdraagt. |
≤2.000 µg/l | of | <7 mg Fe/g droog gewicht | Verlaag de dosis elke 3 tot 6 maanden in stappen van 3,5 tot 7 mg/kg/dag tot een dosering van 7 mg/kg/dag (of minder) bij patiënten die worden behandeld met doses >7 mg/kg/dag. |
<300 µg/l | of | <3 mg Fe/g droog gewicht | Behandeling moet worden gestaakt zodra een bevredigend ijzergehalte in het lichaam is bereikt. |
Er zijn geen gegevens beschikbaar over de herbehandeling van patiënten bij wie ijzerstapeling weer optreedt na een geschikt ijzergehalte in het lichaam te hebben bereikt. Herbehandeling kan daarom niet worden aanbevolen. | |||
* LIC is de voorkeursmethode voor het bepalen van ijzerstapeling | |||
Bij zowel pediatrische als volwassen patiënten bij wie de LIC niet is bepaald en het serumferritine ≤2.000 µg/l is, dient de dosis van EXJADE filmomhulde tabletten niet hoger te zijn dan 7 mg/kg/dag.
Speciale patiëntgroepen
Ouderen (≥65 jaar)
De dosisaanbevelingen voor ouderen zijn dezelfde als hierboven beschreven. In klinische studies ondervonden oudere patiënten een hogere frequentie van bijwerkingen (in het bijzonder diarree) dan jongere patiënten en zouden nauwlettend gecontroleerd dienen te worden op bijwerkingen die mogelijk een dosisaanpassing vereisen.
Pediatrische patiënten
Transfusiegerelateerde ijzerstapeling:
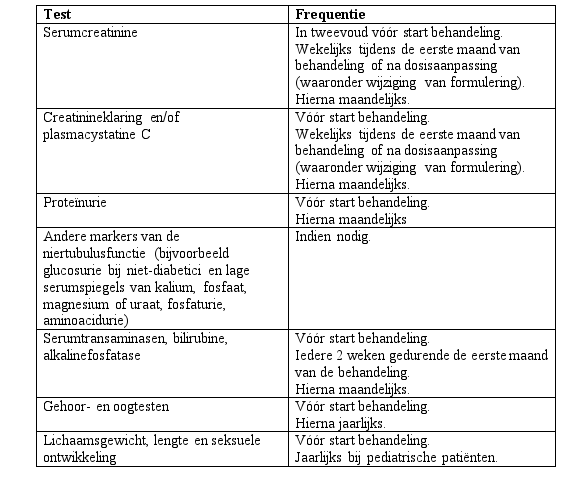
De dosisaanbevelingen voor kinderen van 2 tot 17 jaar met transfusiegerelateerde ijzerstapeling zijn dezelfde als voor volwassen patiënten (zie rubriek 4.2). Het is aanbevolen om serumferritine iedere maand te monitoren om de respons van de patiënt op de behandeling te beoordelen en om het risico op overchelatie te minimaliseren (zie rubriek 4.4). Bij het berekenen van de dosering dient rekening te worden gehouden met gewichtsveranderingen bij kinderen met de tijd.
Bij kinderen van 2 tot 5 jaar oud met transfusiegerelateerde ijzerstapeling is de blootstelling lager dan bij volwassenen (zie rubriek 5.2). Deze leeftijdsgroep kan daarom een hogere dosis nodig hebben dan volwassenen. De startdosis dient echter dezelfde te zijn als bij volwassenen, gevolgd door individuele titratie.
Niet-transfusieafhankelijke thalassemiesyndromen:
Bij pediatrische patiënten met niet-transfusieafhankelijke thalassemiesyndromen dient de dosis van EXJADE filmomhulde tabletten niet hoger te zijn dan 7 mg/kg/dag. Bij deze patiënten is een meer nauwgezette controle van de LIC en serumferritine noodzakelijk om te sterke chelatie te voorkomen (zie rubriek 4.4). Naast maandelijkse bepalingen van serumferritine dient bij deze patiënten de LIC elke drie maanden te worden gecontroleerd wanneer het serumferritine ≤800 µg/l is.
Kinderen vanaf de geboorte tot de leeftijd van 23 maanden:
De veiligheid en werkzaamheid van EXJADE bij kinderen vanaf de geboorte tot de leeftijd van 23 maanden zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Patiënten met nierfunctiestoornissen
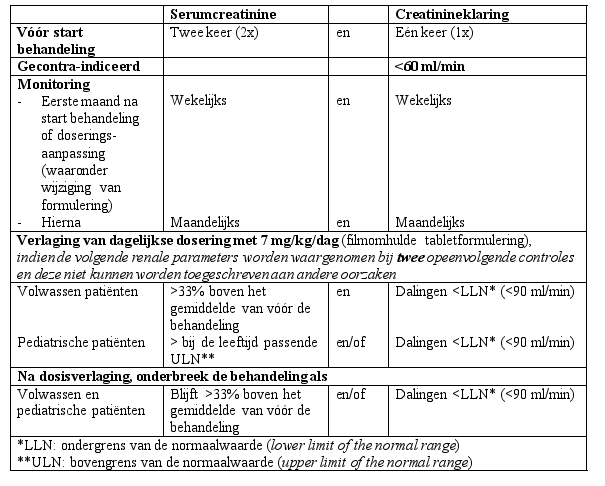
EXJADE is niet onderzocht bij patiënten met nierfunctiestoornissen en is gecontra-indiceerd bij patiënten met een geschatte creatinineklaring <60 ml/min (zie rubrieken 4.3 en 4.4).
Patiënten met leverfunctiestoornissen
EXJADE wordt niet aanbevolen bij patiënten met ernstige leverinsufficiëntie (Child-Pugh classificatie C). Bij patiënten met matige leverinsufficiëntie (Child-Pugh classificatie B) moet de dosering aanzienlijk worden gereduceerd gevolgd door een geleidelijke verhoging tot maximaal 50% van de aanbevolen dosering voor patiënten met een normale leverfunctie (zie rubrieken 4.4 en 5.2) en EXJADE moet bij deze patiënten met voorzichtigheid worden gebruikt. De leverfunctie dient bij alle patiënten vóór de behandeling, elke 2 weken gedurende de eerste maand en daarna elke maand te worden gecontroleerd (zie rubriek 4.4).
Wijze van toediening
Voor oraal gebruik.
De filmomhulde tabletten dienen in hun geheel met een beetje water te worden doorgeslikt. Voor patiënten die niet in staat zijn om tabletten in hun geheel door te slikken, kunnen filmomhulde tabletten worden verpulverd en worden toegediend door de volledige dosis op zacht voedsel, bijv. yoghurt of appelmoes (gepureerde appel) te strooien. De dosis moet onmiddellijk en volledig worden ingenomen en mag niet worden bewaard voor later gebruik.
Filmomhulde tabletten dienen eenmaal daags te worden ingenomen, bij voorkeur dagelijks op hetzelfde tijdstip, en mogen op een nuchtere maag of met een lichte maaltijd worden ingenomen (zie rubrieken 4.5 en 5.2).
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Combinatie met andere ijzerchelatietherapieën aangezien de veiligheid van dergelijke combinaties niet is vastgesteld (zie rubriek 4.5).
Patiënten met geschatte creatinineklaring <60 ml/min.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Tot de meest frequente reacties die zijn gemeld tijdens chronische behandeling in klinische studies uitgevoerd met dispergeerbare tabletten van deferasirox bij volwassen patiënten en kinderen behoren gastroïntestinale bijwerkingen (voornamelijk misselijkheid, braken, diarree of buikpijn) en huidrash. Diarree is vaker gemeld bij kinderen in de leeftijd van 2 tot 5 jaar en bij ouderen. Deze reacties zijn dosisafhankelijk, meestal mild tot matig en in het algemeen van voorbijgaande aard. Ze verdwijnen meestal zelfs als de behandeling wordt voortgezet.
Tijdens klinische studies kwamen dosisafhankelijke stijgingen in serumcreatinine voor bij ongeveer 36% van de patiënten, hoewel de meeste stijgingen binnen het normale bereik bleven. Dalingen van de gemiddelde creatinineklaring zijn waargenomen bij zowel pediatrische als volwassen patiënten met beta-thalassemie en ijzerstapeling tijdens het eerste jaar van de behandeling, maar er zijn aanwijzingen dat deze niet verder dalen in de daaropvolgende jaren van de behandeling. Verhogingen van levertransaminasen zijn gemeld. Regelmatige controles op de veiligheid voor nier- en leverparameters worden aanbevolen. Auditieve (verminderd horen) en visuele (lenstroebelingen) stoornissen zijn zeldzaam, en jaarlijkse controles worden ook aanbevolen (zie rubriek 4.4).
Ernstige cutane bijwerkingen, waaronder Stevens-Johnson-syndroom (SJS), toxische epidermale necrolyse (TEN) en geneesmiddelenreactie met eosinofilie en systemische symptomen (DRESS) zijn gemeld bij gebruik van EXJADE (zie rubriek 4.4).
Tabellarische lijst met bijwerkingen
Bijwerkingen zijn hieronder gerangschikt volgens de volgende afspraak: zeer vaak (≥1/10); vaak (≥1/100, <1/10); soms (≥1/1.000, <1/100); zelden (≥1/10.000, <1/1.000); zeer zelden (<1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen iedere frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Tabel 6
Bloed- en lymfestelselaandoeningen | ||
| Niet bekend: | Pancytopenie1, trombocytopenie1, verergering anemie1, neutropenie1 |
Immuunsysteemaandoeningen | ||
| Niet bekend: | Overgevoeligheidsreacties (met inbegrip van anafylactische reacties en angio-oedeem)1 |
Voedings- en stofwisselingsstoornissen | ||
| Niet bekend: | Metabole acidose1 |
Psychische stoornissen | ||
| Soms: | Angst, slaapstoornissen |
Zenuwstelselaandoeningen | ||
| Vaak: | Hoofdpijn |
| Soms: | Duizeligheid |
Oogaandoeningen | ||
| Soms: | Cataract, maculopathie |
| Zelden: | Opticus neuritis |
Evenwichtsorgaan- en ooraandoeningen | ||
| Soms: | Doofheid |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | ||
| Soms: | Laryngeale pijn |
Maagdarmstelselaandoeningen | ||
| Vaak: | Diarree, obstipatie, braken, misselijkheid, buikpijn, zwelling van de buik, dyspepsie |
| Soms: | Gastro-intestinale bloedingen, maagzweer (waaronder multipele ulceraties), duodenumzweer, gastritis |
| Zelden: | Oesofagitis |
| Niet bekend: | Maagdarmperforatie1, acute pancreatitis1 |
Lever- en galaandoeningen | ||
| Vaak: | Transaminasestijgingen |
| Soms: | Hepatitis, cholelithiasis |
| Niet bekend: | Leverfalen1,2 |
Huid- en onderhuidaandoeningen | ||
| Vaak: | Rash, pruritus |
| Soms: | Pigmentatiestoornissen |
| Zelden: | Geneesmiddelenreactie met eosinofilie en systemische symptomen (DRESS) |
| Niet bekend: | Stevens-Johnson-syndroom1, overgevoeligheidsvasculitis1, urticaria1, erythema multiforme1, alopecia1, toxische epidermale necrolyse (TEN) 1 |
Nier- en urinewegaandoeningen | ||
| Zeer vaak: | Bloedcreatininestijgingen |
| Vaak: | Proteïnurie |
| Soms: | Renale tubulaire stoornis² (verworven Fanconi-syndroom), glycosurie |
| Niet bekend: | Acuut nierfalen1,2, tubulo-interstitiële nefritis1, nefrolithiase1, tubulaire niernecrose1 |
Algemene aandoeningen en toedieningsplaatsstoornissen | ||
| Soms: | Koorts, oedeem, moeheid |
1 Bijwerkingen zijn gemeld tijdens postmarketingervaringen. Deze zijn afgeleid van spontane meldingen waarvoor het niet altijd mogelijk is om de frequentie of een causaal verband met de blootstelling aan het geneesmiddel op betrouwbare wijze te bepalen.
2 Ernstige vormen geassocieerd met veranderingen in het bewustzijn in de context van hyperammonemische encefalopathie zijn gemeld.
Beschrijving van geselecteerde bijwerkingen
Galstenen en gerelateerde galwegaandoeningen werden gemeld bij ongeveer 2% van de patiënten. Stijgingen van levertransaminasen werden gemeld als bijwerking bij 2% van de patiënten. Transaminasestijgingen hoger dan 10 keer de bovengrens van de normaalwaarden, hetgeen suggestief is voor hepatitis, kwamen soms voor (0,3%). Tijdens postmarketingervaringen werd leverfalen, soms met fatale afloop, gemeld met deferasirox (zie rubriek 4.4). Er zijn postmarketingmeldingen geweest van het optreden van metabole acidose. De meerderheid van deze patiënten had nierfunctiestoornissen, renale tubulopathie (Fanconi-syndroom) of diarree, of aandoeningen waarbij een verstoring van het zuur-base-evenwicht een bekende complicatie is (zie rubriek 4.4). Gevallen van ernstige acute pancreatitis werden waargenomen zonder gedocumenteerde onderliggende galziekten. Zoals met andere ijzerchelatietherapieën werden soms hoge frequentie gehoorverlies en lenstroebelingen (immatuur cataract) gemeld bij patiënten die werden behandeld met deferasirox (zie rubriek 4.4).
Creatinineklaring in transfusiegerelateerde ijzerstapeling
In een retrospectieve meta-analyse van 2.102 volwassen en pediatrische patiënten met bètathalassemie en transfusiegerelateerde ijzerstapeling behandeld met dispergeerbare tabletten van deferasirox in twee gerandomiseerde en vier open-label studies met een duur tot 5 jaar, werd een gemiddelde daling van de creatinineklaring van 13,2% bij volwassen patiënten (95%-BI: -14,4% tot -12,1%; n=935) en van 9,9% (95%-BI: -11,1% tot -8,6%; n=1.142) bij pediatrische patiënten waargenomen tijdens het eerste jaar van de behandeling. In 250 patiënten, die tot 5 jaar werden opgevolgd, werd geen verdere daling van het gemiddelde niveau van creatinineklaring waargenomen.
Klinische studie bij patiënten met niet-transfusieafhankelijke thalassemiesyndromen
In een 1-jarige studie bij patiënten met niet-transfusieafhankelijke thalassemiesyndromen en ijzerstapeling (dispergeerbare tabletten met een dosis van 10 mg/kg/dag) waren diarree (9,1%), huiduitslag (9,1%) en misselijkheid (7,3%) de meest gemelde bijwerkingen gerelateerd aan de studiemedicatie. Afwijkende waarden voor serumcreatinine en creatinineklaring werden gemeld bij respectievelijk 5,5% en 1,8% van de patiënten. Stijgingen van levertransaminasen hoger dan 2 keer de uitgangswaarde en 5 keer de bovengrens van de normaalwaarde werden gemeld bij 1,8% van de patiënten.
Pediatrische patiënten
In drie klinische onderzoeken werden groei en seksuele ontwikkeling van kinderen die werden behandeld met deferasirox tot maximaal 5 jaar niet beïnvloed (zie rubriek 4.4).
Diarree is vaker gemeld bij pediatrische patiënten in de leeftijd van 2 tot 5 jaar dan bij oudere patiënten.
Renale tubulopathie werd voornamelijk gemeld bij kinderen en adolescenten met bètathalassemie behandeld met deferasirox. In postmarketingrapporten deed een groot deel van de gevallen van metabole acidose zich voor bij kinderen in het kader van het Fanconi-syndroom.
Acute pancreatitis is gemeld, vooral bij kinderen en adolescenten.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Ierland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EXJADE 90 mg filmomhulde tabletten
EU/1/06/356/011
EU/1/06/356/012
EU/1/06/356/013
EXJADE 180 mg filmomhulde tabletten
EU/1/06/356/014
EU/1/06/356/015
EU/1/06/356/016
EXJADE 360 mg filmomhulde tabletten
EU/1/06/356/017
EU/1/06/356/018
EU/1/06/356/019
10. DATUM VAN HERZIENING VAN DE TEKST
04.02.2026
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3540093 | EXJADE 90 MG FILMOMH TABL 90 X 90 MG | V03AC03 | € 194,03 | - | Ja | € 2 | € 1 |
| 3540101 | EXJADE 180 MG FILMOMH TABL 90 X 180 MG | V03AC03 | € 408,63 | - | Ja | € 2 | € 1 |
| 3540119 | EXJADE 360 MG FILMOMH TABL 90 X 360 MG | V03AC03 | € 751,36 | - | Ja | € 2 | € 1 |