SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
TREVICTA 175 mg suspensie voor injectie met verlengde afgifte
TREVICTA 263 mg suspensie voor injectie met verlengde afgifte
TREVICTA 350 mg suspensie voor injectie met verlengde afgifte
TREVICTA 525 mg suspensie voor injectie met verlengde afgifte
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
175 mg suspensie voor injectie met verlengde afgifte
Elke voorgevulde spuit bevat 273 mg paliperidonpalmitaat, equivalent aan 175 mg paliperidon, in 0,88 ml.
263 mg suspensie voor injectie met verlengde afgifte
Elke voorgevulde spuit bevat 410 mg paliperidonpalmitaat, equivalent aan 263 mg paliperidon, in 1,32 ml.
350 mg suspensie voor injectie met verlengde afgifte
Elke voorgevulde spuit bevat 546 mg paliperidonpalmitaat, equivalent aan 350 mg paliperidon, in 1,75 ml.
525 mg suspensie voor injectie met verlengde afgifte
Elke voorgevulde spuit bevat 819 mg paliperidonpalmitaat, equivalent aan 525 mg paliperidon, in 2,63 ml.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Suspensie voor injectie met verlengde afgifte.
De suspensie is wit tot gebroken wit. De suspensie is pH‑neutraal (ongeveer 7,0).
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
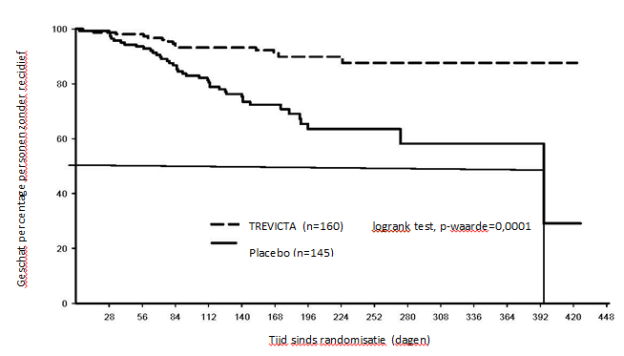
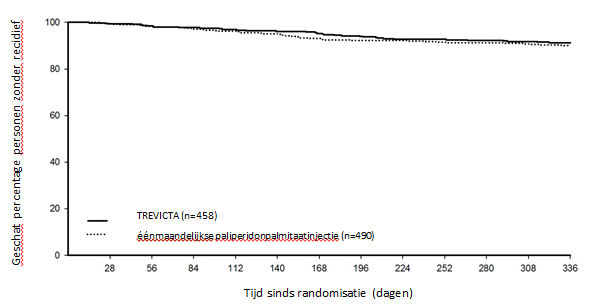
TREVICTA, een driemaandelijkse injectie, is geïndiceerd voor de onderhoudsbehandeling van schizofrenie bij volwassen patiënten die klinisch stabiel zijn op de éénmaandelijkse paliperidonpalmitaatinjectie (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Dosering
Patiënten die adequaat worden behandeld met de éénmaandelijkse paliperidonpalmitaatinjectie (bij voorkeur gedurende vier maanden of langer) en die geen dosisaanpassing nodig hebben, kunnen overgeschakeld worden op de driemaandelijkse paliperidonpalmitaatinjectie.
TREVICTA dient te worden gestart op het moment van de volgende geplande dosis van de éénmaandelijkse paliperidonpalmitaatinjectie (± 7 dagen). De dosis van TREVICTA dient te worden gebaseerd op de voorgaande dosis van de éénmaandelijkse paliperidonpalmitaatinjectie, vermenigvuldigd met een factor 3,5, zoals is weergegeven in de volgende tabel.
Doses van TREVICTA voor patiënten die adequaat worden behandeld met de éénmaandelijkse paliperidonpalmitaatinjectie | |
Bij een laatste dosis van de éénmaandelijkse injectie met paliperidonpalmitaat van | Start TREVICTA in de volgende dosis |
50 mg | 175 mg |
75 mg | 263 mg |
100 mg | 350 mg |
150 mg | 525 mg |
Er is geen equivalente dosis van TREVICTA voor de dosis van 25 mg van de éénmaandelijkse paliperidonpalmitaatinjectie, aangezien deze niet is onderzocht.
Na de initiële dosis van TREVICTA, dient TREVICTA te worden toegediend via een intramusculaire injectie eenmaal per 3 maanden (± 2 weken, zie ook de paragraaf Gemiste dosis).
Indien nodig kan de dosis van TREVICTA elke 3 maanden worden aangepast met verhogingen binnen het bereik van 175 mg tot 525 mg, afhankelijk van de individuele verdraagbaarheid en/of werkzaamheid bij de patiënt. Door de langdurige werking van TREVICTA kan de reactie van de patiënt op een dosisaanpassing gedurende enkele maanden onduidelijk zijn (zie rubriek 5.2). Indien de patiënt symptomen blijft vertonen, dienen deze te worden behandeld volgens de gangbare klinische praktijk.
Overschakelen van andere antipsychotica
Patiënten dienen niet direct overgeschakeld te worden vanaf andere antipsychotica, omdat de driemaandelijkse paliperidonpalmitaatinjectie alleen dient te worden opgestart nadat de patiënt is gestabiliseerd op de éénmaandelijkse paliperidonpalmitaatinjectie.
Overschakelen van TREVICTA naar andere antipsychotica
Als met TREVICTA wordt gestopt, moet rekening worden gehouden met de verlengde afgifte.
Overschakelen van TREVICTA naar de éénmaandelijkse paliperidonpalmitaatinjectie
Om over te schakelen van TREVICTA naar de éénmaandelijkse paliperidonpalmitaatinjectie dient de éénmaandelijkse paliperidonpalmitaatinjectie te worden toegediend op het moment dat de volgende dosis TREVICTA toegediend had moeten worden, in een dosis die een factor 3,5 lager is, zoals te zien is in de volgende tabel. De startdosering zoals beschreven in de voorschriftinformatie van de éénmaandelijkse paliperidonpalmitaatinjectie is niet vereist. Vervolgens dient men door te gaan met de toediening van de éénmaandelijkse paliperidonpalmitaatinjectie met intervallen van een maand, zoals is beschreven in de voorschriftinformatie hiervan.
Doses van de éénmaandelijkse paliperidonpalmitaatinjectie voor patiënten die overschakelen van TREVICTA | |
Bij een laatste dosis van TREVICTA van | Start de éénmaandelijkse paliperidonpalmitaatinjectie 3 maanden later met de volgende dosis |
175 mg | 50 mg |
263 mg | 75 mg |
350 mg | 100 mg |
525 mg | 150 mg |
Overschakelen van TREVICTA naar dagelijks oraal paliperidon in tabletten met verlengde afgifte
Om over te schakelen van TREVICTA naar paliperidon tabletten met verlengde afgifte dient de dagelijkse toediening van de paliperidon tabletten met verlengde afgifte te worden begonnen 3 maanden na de laatste toediening van TREVICTA en dient de behandeling te worden voortgezet met paliperidon tabletten met verlengde afgifte zoals beschreven in de tabel hieronder. De volgende tabel verschaft aanbevolen dosisconversieschema’s om te zorgen dat patiënten die eerder stabiel waren op verschillende doses van TREVICTA een vergelijkbare blootstelling aan paliperidon zullen krijgen met de paliperidon tabletten met verlengde afgifte.
Doses van paliperidon tabletten met verlengde afgifte voor patiënten die overschakelen van TREVICTA* | |||
Laatste dosis TREVICTA (week 0) | Weeknummer na de laatste dosis TREVICTA | ||
Week 12 tot en met week 18 | Week 19 tot en met week 24 | Week 25 en verder | |
Dagelijkse dosis paliperidon tabletten met verlengde afgifte | |||
175 mg | 3 mg | 3 mg | 3 mg |
263 mg | 3 mg | 3 mg | 6 mg |
350 mg | 3 mg | 6 mg | 9 mg |
525 mg | 6 mg | 9 mg | 12 mg |
* Alle doses van eenmaaldaagse paliperidon tabletten met verlengde afgifte dienen te worden afgestemd op de individuele patiënt, rekening houdend met variabelen zoals de redenen voor het overschakelen, de reactie op eerdere behandeling met paliperidon, de ernst van psychotische symptomen, en/of de aanleg voor bijwerkingen. | |||
Gemiste dosis
Toedieningsperiode
TREVICTA dient eenmaal per 3 maanden te worden geïnjecteerd. Om te vermijden dat een toediening van TREVICTA wordt gemist, kan de injectie maximaal 2 weken vóór of na het tijdstip van 3 maanden aan de patiënt worden toegediend.
Gemiste doses | |
Als een geplande toediening is gemist en de tijd sinds de laatste injectie is | Actie |
> 3½ maand tot maximaal 4 maanden | Dien de injectie zo spoedig mogelijk toe en begin vervolgens opnieuw met een injectieschema van eens per 3 maanden. |
4 maanden tot 9 maanden | Gebruik het aanbevolen hervattingsschema in de tabel hieronder. |
> 9 maanden | Hervat de behandeling met de éénmaandelijkse paliperidonpalmitaatinjectie zoals beschreven in de voorschriftinformatie van dat product. TREVICTA kan dan worden hervat nadat de patiënt adequaat is behandeld met de éénmaandelijkse paliperidonpalmitaatinjectie, bij voorkeur gedurende vier maanden of langer. |
Aanbevolen hervattingsschema na onderbreking van TREVICTA gedurende 4 maanden tot 9 maanden | |||
Bij een laatste dosis van TREVICTA van | Dien de éénmaandelijkse paliperidonpalmitaatinjectie toe, twee toedieningen met één week ertussen (in de deltaspier) | Dien vervolgens TREVICTA toe (in de deltaa- of de bilspier) | |
Dag 1 | Dag 8 | 1 maand na dag 8 | |
175 mg | 50 mg | 50 mg | 175 mg |
263 mg | 75 mg | 75 mg | 263 mg |
350 mg | 100 mg | 100 mg | 350 mg |
525 mg | 100 mg | 100 mg | 525 mg |
a Zie voor de keuze van de naald voor injectie in de deltaspier op basis van het lichaamsgewicht ook Informatie bedoeld voor medische beroepsbeoefenaren of hulpverleners in de gezondheidszorg. | |||
Speciale populaties
Ouderen
De werkzaamheid en veiligheid bij ouderen > 65 jaar zijn niet vastgesteld.
In het algemeen is de aanbevolen dosering TREVICTA voor oudere patiënten met een normale nierfunctie dezelfde als voor jongere volwassen patiënten met een normale nierfunctie. Omdat oudere patiënten echter een verminderde nierfunctie kunnen hebben, dient men Nierinsufficiëntie hieronder te raadplegen voor de dosisaanbevelingen voor patiënten met nierinsufficiëntie.
Nierinsufficiëntie
TREVICTA is niet onderzocht bij patiënten met nierinsufficiëntie (zie rubriek 5.2). Voor patiënten met milde nierinsufficiëntie (creatinineklaring ≥ 50 tot < 80 ml/min), dient de dosis te worden aangepast en de patiënt te worden gestabiliseerd met de éénmaandelijkse paliperidonpalmitaatinjectie, en daarna te worden overgezet op TREVICTA.
TREVICTA wordt niet aanbevolen bij patiënten met matige of ernstige nierinsufficiëntie (creatinineklaring < 50 ml/min).
Leverinsufficiëntie
TREVICTA is niet onderzocht bij patiënten met leverinsufficiëntie. Op basis van de ervaringen met oraal paliperidon is geen dosisaanpassing nodig bij patiënten met milde of matige leverinsufficiëntie. Aangezien paliperidon niet is onderzocht bij patiënten met ernstige leverinsufficiëntie, is voorzichtigheid geboden voor deze patiënten (zie rubriek 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van TREVICTA bij kinderen en adolescenten < 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
TREVICTA is uitsluitend bestemd voor intramusculair gebruik. Het mag niet via een andere route worden toegediend. Elke injectie mag alleen door een beroepsbeoefenaar in de gezondheidszorg worden toegediend, waarbij de volledige dosis in één enkele injectie moet worden toegediend. De dosis moet langzaam, diep in de delta- of de bilspier worden geïnjecteerd. Overschakelen van de bilspier naar de deltaspier (en vice versa) dient te worden overwogen voor de volgende injectie als er ongemak optreedt op de plaats van de injectie (zie rubriek 4.8).
TREVICTA mag alleen worden toegediend met gebruik van de dunwandige naalden die in de TREVICTA‑verpakking worden meegeleverd. Naalden uit de verpakking van de éénmaandelijkse paliperidonpalmitaatinjectie of andere commercieel verkrijgbare naalden mogen bij de toediening van TREVICTA niet worden gebruikt (zie Informatie bedoeld voor medische beroepsbeoefenaren of hulpverleners in de gezondheidszorg).
De inhoud van de voorgevulde spuit dient voor de toediening visueel te worden geïnspecteerd op vreemde deeltjes en verkleuring. Het is belangrijk de spuit minstens 15 seconden krachtig te schudden, met de punt naar boven en met een losse pols, om een homogene suspensie te garanderen. TREVICTA dient binnen 5 minuten na het schudden te worden toegediend. Als er tot de injectie meer dan 5 minuten zijn verstreken, schud dan nogmaals krachtig gedurende minstens 15 seconden om het geneesmiddel opnieuw in suspensie te brengen. (Zie Informatie bedoeld voor medische beroepsbeoefenaren of hulpverleners in de gezondheidszorg).
Toediening in de deltaspier
De geschikte naald voor toediening van TREVICTA in de deltaspier wordt bepaald door het gewicht van de patiënt.
- Voor patiënten 90 kg dient de dunwandige 1½ inch, 22 gauge naald (0,72 mm x 38,1 mm) te worden gebruikt.
- Voor patiënten < 90 kg dient de dunwandige 1 inch, 22 gauge naald (0,72 mm x 25,4 mm) te worden gebruikt.
De injectie dient te worden gegeven in het midden van de deltaspier. De injecties in de deltaspier moeten afwisselend in de linker- en rechterdeltaspier worden toegediend.
Toediening in de bilspier
De naald die moet worden gebruikt voor toediening van TREVICTA in de bilspier is de dunwandige 1½ inch, 22 gauge naald (0,72 mm x 38,1 mm), ongeacht het lichaamsgewicht. Toediening dient te gebeuren in het bovenste buitenste kwadrant van de bilspier. De injecties in de bilspier moeten afwisselend in de linker- en rechterbilspier worden toegediend.
Onvolledige toediening
Om onvolledige toediening van TREVICTA te voorkomen, moet de voorgevulde spuit gedurende minstens 15 seconden krachtig worden geschud binnen 5 minuten voor de toediening om zeker te zijn van een homogene suspensie (zie Informatie bedoeld voor medische beroepsbeoefenaren of hulpverleners in de gezondheidszorg).
In het geval van een onvolledig geïnjecteerde dosis mag de resterende dosis in de spuit echter niet alsnog geïnjecteerd worden en mag er ook geen andere dosis worden gegeven, aangezien het moeilijk is om de hoeveelheid van de feitelijk toegediende dosis in te schatten. De patiënt dient nauwlettend te worden gemonitord en behandeld als klinisch aangewezen tot de volgende geplande driemaandelijkse injectie van TREVICTA.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof, voor risperidon of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest frequent waargenomen bijwerkingen, gemeld bij ≥ 5% van de patiënten, in twee dubbelblinde gecontroleerde klinische studies met TREVICTA waren gewicht verhoogd, bovenste luchtweginfectie, angst, hoofdpijn, insomnia en injectieplaatsreactie.
Tabel met bijwerkingen
De volgende bijwerkingen werden alle gerapporteerd tijdens gebruik van paliperidon, waarbij de frequentiecategorie wordt geschat op basis van klinisch onderzoek met paliperidonpalmitaat. De volgende termen en frequenties worden gebruikt: zeer vaak (1/10); vaak (1/100 tot <1/10); soms (1/1.000 tot <1/100); zelden (1/10.000 tot <1/1.000); zeer zelden (<1/10.000); en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Systeem/ orgaanklasse | Bijwerkingen | ||||
Frequentie | |||||
Zeer vaak | Vaak | Soms | Zelden | Niet bekenda | |
Infecties en parasitaire aandoeningen |
| bovensteluchtweginfectie, urineweginfectie, influenza | pneumonie, bronchitis, luchtweginfectie, sinusitis, cystitis, oorinfectie, tonsillitis, onychomycose, cellulitis,subcutaan abces | ooginfectie, acarodermatitis, |
|
Bloed- en lymfestelsel-aandoeningen |
|
| witte bloedcellen verlaagd, anemie | neutropenie, trombocytopenie, | agranulocytose |
Immuunsysteem-aandoeningen |
|
| overgevoeligheid |
| anafylactische reactie |
Endocriene aandoeningen |
| hyperprolactinemieb |
| antidiuretisch hormoonsecretie-deficiëntie, glucose in urine |
|
Voedings- en stofwisselings-stoornissen |
| hyperglykemie, gewicht verhoogd, gewicht verlaagd, verminderde eetlust | diabetes mellitusd, hyperinsulinemie, gestimuleerde eetlust, anorexie, bloed triglyceriden verhoogd, bloed cholesterol verhoogd | diabetische ketoacidose, hypoglykemie, polydipsie | waterintoxicatie |
Psychische stoornissen | Insomniae | agitatie, depressie, angst | slaapstoornis, manie, verminderd libido, zenuwachtigheid, nachtmerrie | katatonie, verwarde toestand, somnambulisme, afgestompt affect, anorgasmie | slaapgerelateerde eetstoornis |
Zenuwstelselaan-doeningen |
| parkinsonismec, acathisiec, sedatie/ somnolentie, dystoniec, duizeligheid, dyskinesiec, tremor, hoofdpijn | tardieve dyskinesie, syncope, psychomotorische hyperactiviteit, duizeligheid houdingsafhankelijk, aandachtsstoornis, dysartrie, dysgeusie, hypo-esthesie, paresthesie | maligne neuroleptica-syndroom, cerebrale ischemie, niet reagerend op prikkels, bewustzijnsverlies, verminderd bewustzijn, convulsiee, evenwichts-stoornis, coördinatie afwijkend, titubatie van hoofd | diabetisch coma |
Oogaandoeningen |
|
| gezichtsvermogen wazig, conjunctivitis, droog oog | glaucoom, oogbewegings-afwijking, oogrollen, fotofobie, traanproductie verhoogd, oculaire hyperemie | floppy iris-syndroom (intraoperatief) |
Evenwichtsorgaan- en ooraandoeningen |
|
| vertigo, tinnitus, oorpijn |
|
|
Hartaandoeningen |
| tachycardie | atrioventriculair blok, geleidingsstoornis, elektrocardiogram QT verlengd, posturele orthostatische tachycardie-syndroom, bradycardie, elektrocardiogram abnormaal, hartkloppingen | atriale fibrillatie, sinusaritmie |
|
Bloedvataandoeningen |
| hypertensie | hypotensie, orthostatische hypotensie | longembolie, veneuze trombose, overmatig blozen | ischemie |
Ademhalingsstelsel-, borstkas- en mediastinumaan-doeningen |
| hoest, neuscongestie | dyspneu, faryngolaryngeale pijn, bloedneus | slaapapneu-syndroom, longstuwing, luchtwegcongestie, ratelgeluiden, piepen | hyperventilatie, aspiratie-pneumonie, dysfonie |
Maagdarmstelsel-aandoeningen |
| abdominale pijn, braken, nausea, constipatie, diarree, dyspepsie, tandpijn | abdominaal ongemak, gastro-enteritis, | pancreatitis, intestinale obstructie, gezwollen tong, fecale incontinentie, fecaloom, cheilitis | ileus |
Lever- en galaandoeningen |
| transaminasen verhoogd | gamma-glutamyltransferase verhoogd, leverenzym verhoogd |
| geelzucht |
Huid- en onderhuidaandoe-ningen |
|
| urticaria, pruritus, rash, alopecia, eczeem, droge huid, erytheem, acne | geneesmiddeleneruptie, hyperkeratose, seborroïsche dermatitis, hoofdroos | Stevens-Johnson- syndroom/toxische epidermale necrolyse, angio-oedeem, huidverkleuring, |
Skeletspierstelsel- en bindweefselaan-doeningen |
| musculoskeletale pijn, rugpijn, artralgie | bloed creatinefosfokinase verhoogd, spierspasmen, gewrichtsstijfheid, spierzwakte | rabdomyolyse, gewrichtszwelling | houding afwijkend |
Nier- en urinewegaan-doeningen |
|
| urine-incontinentie, pollakisurie, dysurie | urineretentie |
|
Zwangerschap, perinatale periode en puerperium |
|
|
|
| geneesmiddelontwenningsverschijnselensyndroom, neonataal (zie rubriek 4.6) |
Voortplantingsstel-sel- en borstaandoeningen |
| amenorroe | erectiele disfunctie, ejaculatiestoornis, menstruatiestoornise, gynaecomastie, galactorroe, seksuele disfunctie, borstpijn | priapisme, gevoelige borsten, bloedaandrang in de borsten, borstvergroting, vaginale afscheiding |
|
Algemene aandoeningen en toedieningsplaats-stoornissen |
| pyrexie, asthenie, vermoeidheid, injectieplaatsreactie | gezichtsoedeem, oedeeme, lichaams-temperatuur verhoogd, gangafwijking, borstkaspijn, ongemak op de borst, malaise, induratie | hypothermie, koude rillingen, dorst, geneesmiddel-ontwenningsverschijnselensyndroom, injectieplaatsabces, injectieplaats-cellulitis, injectieplaatscyste, injectieplaats-hematoom | lichaamstemperatuur verlaagd, injectieplaatsnecrose, injectieplaatsulcus |
Letsels, intoxicaties en verrichtingscomplicaties |
|
| vallen |
|
|
a De frequentie van bijwerkingen is gekwalificeerd als ‘niet bekend’, omdat ze niet werden waargenomen in klinische studies met paliperidonpalmitaat. Ze zijn afgeleid van ofwel spontane postmarketingmeldingen waarbij de frequentie niet kan worden vastgesteld, ofwel van gegevens van klinische studies met en/of postmarketingmeldingen van risperidon (alle formuleringen) of oraal paliperidon. | |||||
Bijwerkingen gezien bij formuleringen op basis van risperidon
Aangezien paliperidon de actieve metaboliet is van risperidon zijn de bijwerkingenprofielen van deze stoffen (waaronder zowel de orale als de injecteerbare formuleringen) relevant voor elkaar.
Beschrijving van geselecteerde bijwerkingen
Anafylactische reactie
Bij patiënten die eerder oraal risperidon of oraal paliperidon konden verdragen, zijn er tijdens postmarketingervaring zeldzame gevallen van anafylactische reactie gemeld na injectie met de éénmaandelijkse paliperidonpalmitaatinjectie (zie rubriek 4.4).
Reacties op de injectieplaats
In klinische studies met TREVICTA meldde 5,3% van de deelnemers een toedieningsplaatsreactie. Geen van deze voorvallen was ernstig of leidde tot stoppen. Op basis van de beoordeling door de onderzoekers waren induratie, roodheid en zwelling bij ≥ 95% van de beoordelingen afwezig of mild. De pijn op de injectieplaats beoordeeld door de patiënt, met behulp van een visuele analoge schaal, was gering en nam in de loop van de tijd in intensiteit af.
Extrapiramidale symptomen (EPS)
In de klinische studies met TREVICTA werden acathisie, dyskinesie, dystonie, parkinsonisme en tremor gemeld bij respectievelijk 3,9%, 0,8%, 0,9%, 3,6% en 1,4% van de deelnemers.
Extrapiramidale symptomen (EPS) omvatten een gepoolde analyse van de volgende termen: parkinsonisme (omvat extrapiramidale stoornis, extrapiramidale symptomen, aan-uit-fenomeen, ziekte van Parkinson, parkinsoncrisis, speekselhypersecretie, skeletspierstijfheid, parkinsonisme, kwijlen, tandradfenomeen, bradykinesie, hypokinesie, maskergelaat, gespannen spieren, akinesie, nekstijfheid, spierrigiditeit, parkinsonachtige gang, abnormale glabellareflex en parkinsonachtige rusttremor), acathisie (omvat acathisie, rusteloosheid, hyperkinesie en restless legs‑syndroom), dyskinesie (dyskinesie, chorea, bewegingsstoornis, spiertrekkingen, choreoathetose, athetose en myoclonus), dystonie (omvat dystonie, cervicaal spasme, emprosthotonus, oculogyrische crisis, oromandibulaire dystonie, risus sardonicus, tetanie, hypertonie, torticollis, onwillekeurige spiersamentrekkingen, spiercontracturen, blefarospasme, oculogyratie, tongverlamming, gezichtsspasme, laryngospasme, myotonie, opisthotonus, orofaryngeaal spasme, pleurothotonus, tongspasme en trismus) en tremor.
Gewichtstoename
In de langlopende gerandomiseerde discontinueringsstudie werd voor 10% van de personen in de TREVICTA‑groep en 1% van de personen in de placebogroep een ongewone toename in lichaamsgewicht van ≥ 7% van de dubbelblinde baseline tot het dubbelblinde eindpunt gemeld. Daarentegen werd een ongewone afname in lichaamsgewicht (≥ 7%) van de dubbelblinde baseline tot het dubbelblinde eindpunt gemeld voor 1% van de personen in de TREVICTA‑groep en 8% van de personen in de placebogroep. De gemiddelde veranderingen in lichaamsgewicht van de dubbelblinde baseline tot het dubbelblinde eindpunt waren respectievelijk +0,94 kg voor de TREVICTA‑groep en ‑1,28 kg voor de placebogroep.
Hyperprolactinemie
Tijdens de dubbelblinde fase van de langlopende gerandomiseerde discontinueringsstudie werden bij een hoger percentage mannen en vrouwen in de TREVICTA‑groep dan in de placebogroep verhogingen van prolactine tot boven het referentiebereik (> 13,13 ng/ml bij mannen en > 26,72 ng/ml bij vrouwen) opgemerkt (respectievelijk 9% vs. 3% en 5% vs. 1%). In de TREVICTA‑groep was de gemiddelde verandering van de dubbelblinde baseline tot het dubbelblinde eindpunt +2,90 ng/ml bij mannen (vs. ‑10,26 ng/ml in de placebogroep) en +7,48 ng/ml bij vrouwen (vs. ‑32,93 ng/ml in de placebogroep). Eén vrouw (2,4%) in de TREVICTA‑groep had de bijwerking amenorroe, terwijl er geen mogelijk prolactinegerelateerde bijwerkingen werden opgemerkt bij vrouwen in de placebogroep. In geen van beide groepen waren er mogelijk prolactinegerelateerde bijwerkingen bij mannen.
Klasse‑effecten
QT‑verlenging, ventriculaire aritmieën (ventrikelfibrillatie, ventriculaire tachycardie), plotseling onverklaarbaar overlijden, hartstilstand en torsade de pointes kunnen optreden met antipsychotica.
Gevallen van veneuze trombo-embolie, waaronder gevallen van longembolie en gevallen van diep‑veneuze trombose, zijn gemeld met antipsychotica (frequentie niet bekend).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten, Afdeling Vigilantie
Postbus 97
1000 BRUSSEL Madou
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
Nederland
Nederlands Bijwerkingen Centrum Lareb
Website: www.lareb.nl
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Janssen‑Cilag International NV
Turnhoutseweg 30
B‑2340 Beerse
België
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/14/971/007
EU/1/14/971/008
EU/1/14/971/009
EU/1/14/971/010
10. DATUM VAN HERZIENING VAN DE TEKST
25/05/2023
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3432150 | TREVICTA 175MG VERL.AFGIFTE VOORGEV.SPUIT 1+2 NLD | N05AX13 | € 286,05 | - | Ja | € 12,5 | € 8,3 |
| 3432168 | TREVICTA 263MG VERL.AFGIFTE VOORGEV.SPUIT 1+2 NLD | N05AX13 | € 375,79 | - | Ja | € 12,5 | € 8,3 |
| 3432176 | TREVICTA 350MG VERL.AFGIFTE VOORGEV.SPUIT 1+2 NLD | N05AX13 | € 450,21 | - | Ja | € 12,5 | € 8,3 |
| 3432184 | TREVICTA 525MG VERL.AFGIFTE VOORGEV.SPUIT 1+2 NLD | N05AX13 | € 651,14 | - | Ja | € 12,5 | € 8,3 |