1. NAAM VAN HET GENEESMIDDEL
Entresto 24 mg/26 mg filmomhulde tabletten
Entresto 49 mg/51 mg filmomhulde tabletten
Entresto 97 mg/103 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Entresto 24 mg/26 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 24,3 mg sacubitril en 25,7 mg valsartan (als sacubitril valsartan natriumzoutcomplex).
Entresto 49 mg/51 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 48,6 mg sacubitril en 51,4 mg valsartan (als sacubitril valsartan natriumzoutcomplex).
Entresto 97 mg/103 mg filmomhulde tabletten
Elke filmomhulde tablet bevat 97,2 mg sacubitril en 102,8 mg valsartan (als sacubitril valsartan natriumzoutcomplex).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet (tablet)
Entresto 24 mg/26 mg filmomhulde tabletten
Paarswitte ovale biconvexe filmomhulde tablet met schuine rand, zonder breukstreep, met de inscriptie ‘NVR’ op de ene zijde en ‘LZ’ op de andere zijde. Geschatte tabletafmetingen 13,1 mm x 5,2 mm.
Entresto 49 mg/51 mg filmomhulde tabletten
Lichtgele ovale biconvexe filmomhulde tablet met schuine rand, zonder breukstreep, met de inscriptie ‘NVR’ op de ene zijde en ‘L1’ op de andere zijde. Geschatte tabletafmetingen 13,1 mm x 5,2 mm.
Entresto 97 mg/103 mg filmomhulde tabletten
Lichtroze ovale biconvexe filmomhulde tablet met schuine rand, zonder breukstreep, met de inscriptie ‘NVR’ op de ene zijde en ‘L11’ op de andere zijde. Geschatte tabletafmetingen 15,1 mm x 6,0 mm.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Hartfalen bij volwassenen
Entresto is geïndiceerd bij volwassen patiënten voor de behandeling van symptomatisch chronisch hartfalen met verminderde ejectiefractie (zie rubriek 5.1).
Hartfalen bij kinderen
Entresto is geïndiceerd bij kinderen en adolescenten van één jaar of ouder voor de behandeling van symptomatisch chronisch hartfalen met systolische functiestoornis van de linkerventrikel (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Dosering
Algemene overwegingen
Entresto moet niet tegelijk met een angiotensine-converting enzym (ACE)-remmer of een angiotensine-II-receptorblokker (ARB) worden gebruikt. Vanwege het mogelijke risico op angio‑oedeem bij gelijktijdig gebruik met een ACE‑remmer, mag het niet worden gestart gedurende ten minste 36 uur na het stopzetten van de behandeling met een ACE‑remmer (zie rubriek 4.3, 4.4 en 4.5).
Het valsartan aanwezig in Entresto heeft een hogere biologische beschikbaarheid dan het valsartan in andere tabletformuleringen die op de markt zijn (zie rubriek 5.2).
Als een dosis wordt vergeten, moet de patiënt de volgende dosis innemen op het geplande tijdstip.
Hartfalen bij volwassenen
De aanbevolen startdosis van Entresto is één tablet van 49 mg/51 mg tweemaal daags, behalve in de situaties zoals hieronder beschreven. De dosis dient na 2 tot 4 weken verdubbeld te worden tot de doeldosering van 97 mg/103 mg tweemaal daags, indien verdragen door de patiënt (zie rubriek 5.1).
Als patiënten verdraagbaarheidsproblemen (systolische bloeddruk [SBD] ≤ 95 mmHg, symptomatische hypotensie, hyperkaliëmie, nierdisfunctie) krijgen, wordt aanpassing van gelijktijdig gebruikte geneesmiddelen, tijdelijke dosisverlaging of stopzetting van Entresto aanbevolen (zie rubriek 4.4).
In de PARADIGM-HF-studie werd Entresto toegediend in combinatie met andere therapieën voor hartfalen, in plaats van een ACE-remmer of andere ARB (zie rubriek 5.1). Er is beperkte ervaring bij patiënten die momenteel geen ACE‑remmer of een ARB gebruiken, of lage doses van ACE-remmers of ARB’s gebruiken. Daarom wordt een startdosis van 24 mg/26 mg tweemaal daags en langzame dosistitratie (verdubbeling iedere 3-4 weken) aanbevolen bij deze patiënten (zie “TITRATION” in rubriek 5.1).
De behandeling dient niet te worden gestart bij patiënten met een serumkaliumniveau > 5,4 mmol/l of met een SBD < 100 mmHg (zie rubriek 4.4). Een startdosis van 24 mg/26 mg tweemaal daags moet overwogen worden voor patiënten met een SBD ≥ 100 tot 110 mmHg.
Hartfalen bij kinderen
Tabel 1 toont de aanbevolen dosis voor pediatrische patiënten. De aanbevolen dosis moet tweemaal daags oraal worden ingenomen. De dosis moet om de 2-4 weken worden verhoogd tot de streefdosis, zoals die door de patiënt wordt verdragen.
Entresto filmomhulde tabletten zijn niet geschikt voor kinderen die minder dan 40 kg wegen. Voor deze patiënten is Entresto granulaat beschikbaar.
Tabel 1 Aanbevolen dosistitratie
Gewicht patiënt | Tweemaal daags te geven | |||
Helft van de startdosis* | Startdosis | Tussenliggende dosis | Streefdosis | |
Pediatrische patiënten van minder dan 40 kg | 0,8 mg/kg# | 1,6 mg/kg# | 2,3 mg/kg# | 3,1 mg/kg# |
Pediatrische patiënten van minstens 40 kg, minder dan 50 kg | 0,8 mg/kg# | 24 mg/26 mg | 49 mg/51 mg | 72 mg/78 mg |
Pediatrische patiënten van minstens 50 kg | 24 mg/26 mg | 49 mg/51 mg | 72 mg/78 mg | 97 mg/103 mg |
* De helft van de startdosis wordt aanbevolen bij patiënten die geen ACE-remmer of een ARB hebben gebruikt of lage doses van deze geneesmiddelen hebben gebruikt, patiënten met een verminderde nierfunctie (geschatte glomerulaire filtratiesnelheid (Estimated Glomerular Filtration Rate) [eGFR] < 60 ml/min/1,73 m2) en patiënten met een matig verminderde leverfunctie (zie speciale patiëntengroepen).
#0,8 mg/kg, 1,6 mg/kg, 2,3 mg/kg en 3,1 mg/kg verwijzen naar de gecombineerde hoeveelheid van sacubitril en valsartan en moeten worden toegediend met behulp van granulaat.
Bij patiënten die momenteel geen ACE-remmer of ARB gebruiken of die lage doses van deze geneesmiddelen gebruiken, wordt de helft van de startdosis aanbevolen. Voor pediatrische patiënten met een gewicht van 40 kg tot minder dan 50 kg wordt een startdosis van 0,8 mg/kg tweemaal daags (gegeven als granulaat) aanbevolen. Na de start moet de dosis worden verhoogd tot de standaard startdosis volgens de aanbevolen dosistitratie in tabel 1 en om de 3-4 weken worden aangepast.
Bijvoorbeeld, een pediatrische patiënt van 25 kg die niet eerder een ACE-remmer heeft gebruikt, moet beginnen met de helft van de standaard startdosis, wat overeenkomt met 20 mg (25 kg × 0,8 mg/kg) tweemaal daags, gegeven als granulaat. Na afronding naar het dichtstbijzijnde aantal volledige capsules komt dit overeen met tweemaal daags 2 capsules van 6 mg/6 mg sacubitril/valsartan.
De behandeling mag niet worden gestart bij patiënten met een serumkaliumgehalte > 5,3 mmol/l of met een SBD < 5e percentiel voor de leeftijd van de patiënt. Indien patiënten verdraagbaarheidsproblemen ondervinden (SBD < 5e percentiel voor de leeftijd van de patiënt, symptomatische hypotensie, hyperkaliëmie, verminderde nierfunctie), wordt aanpassing van bijkomende geneesmiddelen, tijdelijke neertitratie of stopzetting van Entresto aanbevolen (zie rubriek 4.4).
Speciale patiëntengroepen
Ouderen
De dosis moet in overeenstemming zijn met de nierfunctie van de oudere patiënt.
Verminderde nierfunctie
Er is geen dosisaanpassing nodig bij patiënten met een licht (eGFR 60‑90 ml/min/1,73 m2) verminderde nierfunctie.
De helft van de startdosis moet overwogen worden voor patiënten met een matig verminderde nierfunctie (eGFR 30-60 ml/min/1,73 m2) Aangezien er zeer beperkte klinische ervaring is bij patiënten met een ernstig verminderde nierfunctie (eGFR < 30 ml/min/1,73 m2) (zie rubriek 5.1) moet Entresto met voorzichtigheid worden gebruikt en wordt de helft van de startdosis aanbevolen. Bij pediatrische patiënten met een gewicht van 40 kg tot minder dan 50 kg wordt een startdosis van 0,8 mg/kg tweemaal daags (gegeven als granulaat) aanbevolen. Na de start moet de dosis worden verhoogd volgens de aanbevolen dosistitratie om de 2-4 weken.
Er is geen ervaring bij patiënten met eindstadium nierfalen en gebruik van Entresto wordt niet aanbevolen.
Verminderde leverfunctie
Er is geen dosisaanpassing vereist bij het toedienen van Entresto aan patiënten met een licht verminderde leverfunctie (Child‑Pugh‑klasse A).
Er is beperkte klinische ervaring bij patiënten met een matig verminderde leverfunctie (Child‑Pugh‑klasse B) of met aspartaataminotransferase (ASAT)/alanineaminotransferase (ALAT)-waardes meer dan tweemaal de bovenlimiet van het normale bereik. Entresto moet met voorzichtigheid worden gebruikt bij deze patiënten en de helft van de startdosis is aanbevolen (zie rubriek 4.4 en 5.2). Bij pediatrische patiënten met een gewicht van 40 kg tot minder dan 50 kg wordt een startdosis van 0,8 mg/kg tweemaal daags (gegeven als granulaat) aanbevolen. Na de start moet de dosis worden verhoogd volgens de aanbevolen dosistitratie om de 2-4 weken.
Entresto is gecontra-indiceerd bij patiënten met een ernstig verminderde leverfunctie, biliaire cirrose of cholestase (Child‑Pugh‑klasse C) (zie rubriek 4.3).
Pediatrische patiënten
De veiligheid en werkzaamheid van Entresto bij kinderen jonger dan 1 jaar is niet vastgesteld. De momenteel beschikbare gegevens worden beschreven in rubriek 5.1, maar er kan geen doseringsadvies worden gegeven.
Wijze van toediening
Oraal gebruik.
Entresto kan met of zonder voedsel worden toegediend (zie rubriek 5.2). De tabletten moeten met een glas water worden ingenomen. Het wordt niet aanbevolen de tabletten te breken of fijn te maken.
4.3 Contra‑indicaties
- Overgevoeligheid voor de werkzame stoffen of voor een van de in rubriek 6.1 vermelde hulpstoffen.
- Gelijktijdig gebruik met ACE‑remmers (zie rubriek 4.4 en 4.5). Entresto mag pas 36 uur na stopzetting van de behandeling met een ACE‑remmer worden toegediend.
- Bekende voorgeschiedenis van angio‑oedeem die verband houdt met eerdere behandeling met een ACE‑remmer of ARB (zie rubriek 4.4).
- Erfelijk of idiopathisch angio-oedeem (zie rubriek 4.4)
- Gelijktijdig gebruik met aliskiren-bevattende geneesmiddelen bij patiënten met diabetes mellitus of bij patiënten met een verminderde nierfunctie (eGFR < 60 ml/min/1,73 m2) (zie rubriek 4.4 en 4.5).
- Ernstig verminderde leverfunctie, biliaire cirrose of cholestase (zie rubriek 4.2).
- Tweede en derde trimesters van de zwangerschap (zie rubriek 4.6).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De vaakst gemelde bijwerkingen bij volwassenen tijdens de behandeling met sacubitril/valsartan waren hypotensie (17,6%), hyperkaliëmie (11,6%) en nierfunctiestoornissen (10,1%) (zie rubriek 4.4). Angio-oedeem werd gemeld bij patiënten behandeld met sacubitril/valsartan (0,5%) (zie beschrijving van geselecteerde bijwerkingen).
Overzicht van de bijwerkingen in tabelvorm
Bijwerkingen worden gerangschikt volgens systeem/orgaanklasse waarbij de frequentst voorkomende eerst worden genoemd volgens de volgende conventie: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000), niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen elke frequentiegroep worden de bijwerkingen gerangschikt in volgorde van afnemende ernst.
Tabel 2 Lijst van bijwerkingen
Systeem/orgaanklasse | Voorkeursterm | Frequentiecategorie |
Bloed- en lymfestelselaandoeningen | Anemie | Vaak |
Immuunsysteemaandoeningen | Overgevoeligheid | Soms |
Voedings‑ en stofwisselingsstoornissen | Hyperkaliëmie* | Zeer vaak |
Hypokaliëmie | Vaak | |
Hypoglykemie | Vaak | |
Hyponatriëmie | Soms | |
Psychische stoornissen | Hallucinaties** | Zelden |
Slaapstoornissen | Zelden | |
Paranoia | Zeer zelden | |
Zenuwstelselaandoeningen | Duizeligheid | Vaak |
Hoofdpijn | Vaak | |
Syncope | Vaak | |
Duizeligheid houdingsafhankelijk | Soms | |
Myoclonus | Niet bekend | |
Evenwichtsorgaan‑ en ooraandoeningen | Vertigo | Vaak |
Bloedvataandoeningen | Hypotensie* | Zeer vaak |
Orthostatische hypotensie | Vaak | |
Ademhalingsstelsel‑, borstkas‑ en mediastinumaandoeningen | Hoesten | Vaak |
Maagdarmstelselaandoeningen | Diarree | Vaak |
Misselijkheid | Vaak | |
Gastritis | Vaak | |
Intestinaal angio-oedeem | Zeer zelden | |
Huid‑ en onderhuidaandoeningen | Pruritus | Soms |
Huiduitslag | Soms | |
Angio‑oedeem* | Soms | |
Nier‑ en urinewegaandoeningen | Verminderde nierfunctie* | Zeer vaak |
Nierfalen (nierfalen, acuut nierfalen) | Vaak | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Vermoeidheid | Vaak |
Asthenie | Vaak |
*Zie beschrijving van geselecteerde bijwerkingen.
** Inclusief auditieve en visuele hallucinaties
Beschrijving van geselecteerde bijwerkingen
Angio-oedeem
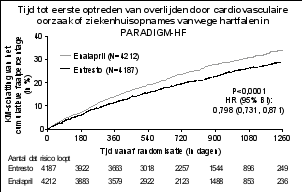
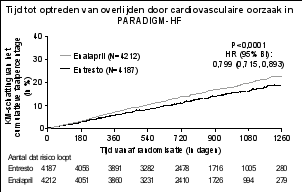
Angio-oedeem is gemeld bij patiënten die behandeld werden met sacubitril/valsartan. In PARADIGM-HF werd angio-oedeem gemeld bij 0,5% van de patiënten die behandeld werden met sacubitril/valsartan, tegen 0,2% van de patiënten die behandeld werden met enalapril. Een hogere incidentie van angio-oedeem werd waargenomen bij negroïde patiënten die behandeld werden met sacubitril/valsartan (2,4%) en enalapril (0,5%) (zie rubriek 4.4).
Hyperkaliëmie en serumkalium
In PARADIGM-HF werden hyperkaliëmie en serumkaliumconcentraties > 5,4 mmol/l gemeld bij respectievelijk 11,6% en 19,7% van de patiënten die behandeld werden met sacubitril/valsartan en 14,0% en 21,1% van de patiënten die behandeld werden met enalapril.
Bloeddruk
In PARADIGM-HF werden hypotensie en klinisch relevante lage systolische bloeddruk (< 90 mmHg en daling vanaf baseline van > 20 mmHg) gemeld bij respectievelijk 17,6% en 4,76% van de patiënten die behandeld werden met sacubitril/valsartan en 11,9% en 2,67% van de patiënten die behandeld werden met enalapril.
Verminderde nierfunctie
In PARADIGM-HF werd verminderde nierfunctie gemeld bij 10,1% van de patiënten die behandeld werden met sacubitril/valsartan en 11,5% van de patiënten die behandeld werden met enalapril.
Pediatrische patiënten
In het PANORAMA-HF-onderzoek werd de veiligheid van sacubitril/valsartan beoordeeld in een gerandomiseerd onderzoek met actief controlemiddel van 52 weken bij 375 pediatrische patiënten met hartfalen (HF) in de leeftijd van 1 maand tot < 18 jaar in vergelijking met enalapril. De 215 patiënten die doorgingen in het langlopende open-label vervolgonderzoek (PANORAMA-HF OLE) werden behandeld gedurende een mediane periode van 2,5 jaar, tot maximaal 4,5 jaar. Het veiligheidsprofiel dat werd waargenomen in beide onderzoeken was vergelijkbaar met dat van volwassen patiënten. Veiligheidsgegevens bij patiënten in de leeftijd van 1 maand tot < 1 jaar waren beperkt.
Er zijn beperkte veiligheidsgegevens beschikbaar bij pediatrische patiënten met matig verminderde leverfunctie of matig tot ernstig verminderde nierfunctie.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novartis Europharm Limited
Vista Building
Elm Park, Merrion Road
Dublin 4
Ierland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Entresto 24 mg/26 mg filmomhulde tabletten
EU/1/15/1058/001
EU/1/15/1058/008-010
EU/1/15/1058/017-018
Entresto 49 mg/51 mg filmomhulde tabletten
EU/1/15/1058/002‑004
EU/1/15/1058/011-013
EU/1/15/1058/019-020
Entresto 97 mg/103 mg filmomhulde tabletten
EU/1/15/1058/005‑007
EU/1/15/1058/014-016
EU/1/15/1058/021-022
10. DATUM VAN HERZIENING VAN DE TEKST
02.05.2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3277076 | ENTRESTO 24MG/ 26MG FILMOMH TABL 28 | C09DX04 | € 69,13 | - | Ja | € 12,5 | € 8,3 |
| 3277084 | ENTRESTO 49MG/ 51MG FILMOMH TABL 56 | C09DX04 | € 128,11 | - | Ja | € 12,5 | € 8,3 |
| 3277092 | ENTRESTO 97MG/103MG FILMOMH TABL 56 | C09DX04 | € 128,11 | - | Ja | € 12,5 | € 8,3 |
| 4160099 | ENTRESTO 97MG/103MG FILMOMH TABL 168 | C09DX04 | € 362,64 | - | Ja | € 15,5 | € 10,2 |
| 4160107 | ENTRESTO 49MG/ 51MG FILMOMH TABL 168 | C09DX04 | € 362,64 | - | Ja | € 15,5 | € 10,2 |