1. NAAM VAN HET GENEESMIDDEL
Saxenda 6 mg/ml oplossing voor injectie in een voorgevulde pen
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
1 ml oplossing bevat 6 mg liraglutide*. Een voorgevulde pen bevat 18 mg liraglutide in 3 ml.
*humaan ‘glucagon-like’ peptide-1-analoog (GLP-1-analoog), geproduceerd met behulp van recombinant-DNA-technologie in Saccharomyces cerevisiae.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie.
Heldere en kleurloze of nagenoeg kleurloze, isotone oplossing; pH=8,15.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Volwassenen
Saxenda is geïndiceerd als aanvulling op een caloriearm dieet en verhoogde lichamelijke activiteit ten behoeve van gewichtsbeheersing bij volwassen patiënten met een aanvankelijke BMI (Body Mass Index) van:
- ≥ 30 kg/m² (obesitas), of
- ≥ 27 kg/m² tot < 30 kg/m² (overgewicht) die ten minste één gewichtsgerelateerde comorbiditeit hebben, zoals dysglykemie (prediabetes of diabetes mellitus type 2), hypertensie, dyslipidemie of obstructieve slaapapneu.
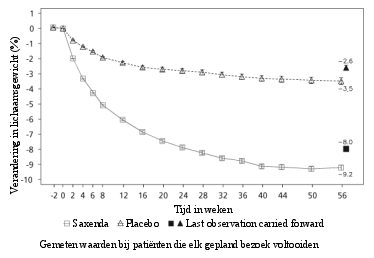
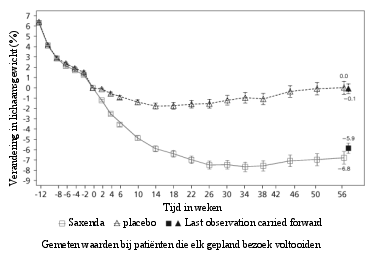
Behandeling met Saxenda moet worden gestaakt als de patiënt na 12 weken gebruik van de dagdosering van 3,0 mg niet ten minste 5% van zijn aanvankelijke lichaamsgewicht is kwijtgeraakt.
Adolescenten (≥ 12 jaar)
Saxenda kan worden gebruikt als toevoeging aan gezonde voeding en verhoogde lichamelijke activiteit ten behoeve van gewichtsbeheersing bij adolescente patiënten van 12 jaar en ouder met:
- obesitas (BMI overeenkomend met ≥ 30 kg/m² voor volwassenen volgens internationale grenswaarden)* en
- lichaamsgewicht boven 60 kg.
Behandeling met Saxenda moet worden gestaakt en heroverwogen als de patiënt na 12 weken gebruik van de dagdosering van 3,0 mg of de maximaal verdraagbare dosis niet ten minste 4% van zijn BMI of van de BMI z-score is kwijtgeraakt.
* IOTF (International Obesity Task Force) BMI-grenswaarden voor obesitas naar geslacht tussen 12-18 jaar (zie tabel 1), in overeenstemming met de studieopzet van studie 4180, zie rubriek 5.1.
Tabel 1. IOTF BMI-grenswaarden voor obesitas naar geslacht tussen 12–18 jaar
Leeftijd | BMI komt overeen met 30 kg/m2 voor volwassenen volgens internationale grenswaarden. | |
Mannen | Vrouwen | |
12 | 26,02 | 26,67 |
12,5 | 26,43 | 27,24 |
13 | 26,84 | 27,76 |
13,5 | 27,25 | 28,20 |
14 | 27,63 | 28,57 |
14,5 | 27,98 | 28,87 |
15 | 28,30 | 29,11 |
15,5 | 28,60 | 29,29 |
16 | 28,88 | 29,43 |
16,5 | 29,14 | 29,56 |
17 | 29,41 | 29,69 |
17,5 | 29,70 | 29,84 |
18 | 30,00 | 30,00 |
Kinderen (6 tot < 12 jaar)
Saxenda is geïndiceerd als toevoeging aan gezonde voeding en verhoogde lichamelijke activiteit ten behoeve van gewichtsbeheersing bij kinderen van 6 tot < 12 jaar met:
- obesitas (BMI ≥ 95e percentiel)* en
- lichaamsgewicht ≥ 45 kg.
Behandeling met Saxenda moet worden gestaakt en heroverwogen als de patiënt na 12 weken gebruik van de dagdosering van 3,0 mg of de maximaal verdraagbare dosis niet ten minste 4% van zijn BMI of van de BMI z-score is kwijtgeraakt.
*CDC BMI-grenswaarden voor obesitas (≥ 95e percentiel) naar geslacht bij 6 tot < 12-jarigen (zie tabel 2), in overeenstemming met de studieopzet van studie 4392, zie rubriek 5.1.
Tabel 2. BMI-grenswaarden (gewicht in kg/lengte in m2) voor obesitas (≥ 95e percentiel) naar geslacht bij kinderen van 6 tot < 12 jaar
Leeftijd (jaren) | Obesitas | |
Mannen | Vrouwen | |
6 | 18,41 | 18,84 |
6,5 | 18,76 | 19,23 |
7 | 19,15 | 19,68 |
7,5 | 19,59 | 20,17 |
8 | 20,07 | 20,70 |
8,5 | 20,57 | 21,25 |
9 | 21,09 | 21,82 |
9,5 | 21,62 | 22,40 |
10 | 22,15 | 22,98 |
10,5 | 22,69 | 23,57 |
11 | 23,21 | 24,14 |
11,5 | 23,73 | 24,71 |
4.2 Dosering en wijze van toediening
Dosering
Volwassenen
De startdosis is 0,6 mg eenmaal daags. De dosis moet worden verhoogd naar 3,0 mg eenmaal daags in stappen van 0,6 mg met tussenpozen van ten minste één week om de gastro-intestinale verdraagbaarheid te verbeteren (zie tabel 3). Als verhoging naar de volgende dosisstap gedurende twee opeenvolgende weken niet wordt verdragen, moet worden overwogen de behandeling te staken. Doseringen hoger dan 3,0 mg per dag worden niet aanbevolen.
Tabel 3. Schema voor dosisverhoging
| Dosis | Weken |
Dosisverhoging | 0,6 mg | 1 |
1,2 mg | 1 | |
1,8 mg | 1 | |
2,4 mg | 1 | |
Onderhoudsdosis | 3,0 mg | |
Adolescenten (≥ 12 jaar)
Voor adolescenten in de leeftijd van 12 tot 18 jaar dient een vergelijkbaar schema voor dosisverhoging te worden toegepast als voor volwassenen (zie tabel 3). De dosis moet worden verhoogd tot 3,0 mg (onderhoudsdosis) of tot de maximaal verdraagbare dosis is bereikt. Doseringen hoger dan 3,0 mg per dag worden niet aanbevolen.
Kinderen (6 tot < 12 jaar)
Bij kinderen in de leeftijd van 6 tot < 12 jaar dient een vergelijkbaar schema voor dosisverhoging te worden toegepast als voor volwassenen (zie tabel 3). De dosis moet worden verhoogd tot 3,0 mg (onderhoudsdosis) of tot de maximaal verdraagbare dosis is bereikt. Doseringen hoger dan 3,0 mg per dag worden niet aanbevolen. Liraglutide bij kinderen moet worden geïnitieerd door een arts met ervaring met het behandelen van obesitas bij kinderen.
Gemiste doses
Indien een dosis binnen 12 uur van de gebruikelijke toedieningstijd wordt gemist, moet de patiënt de dosis alsnog zo spoedig mogelijk toedienen. Indien er minder dan 12 uur resteert tot de volgende dosis, moet de patiënt de gemiste dosering niet toedienen en het eenmaaldaagse doseerschema hervatten bij de eerstvolgende geplande dosis. Een gemiste dosering mag niet gecompenseerd worden met de toediening van een extra dosis of met verhoging van de dosering.
Patiënten met diabetes mellitus type 2
Saxenda mag niet worden gebruikt in combinatie met een andere GLP-1-receptoragonist.
Bij het instellen van de behandeling met Saxenda, dient een dosisverlaging van gelijktijdig gebruikte insuline of insulinesecretagogen (zoals sulfonylureumderivaten) te worden overwogen om het risico op hypoglykemie te verlagen. Zelfcontrole van de bloedglucose is nodig om de dosis van de insuline of insulinesecretagogen aan te passen (zie rubriek 4.4).
Specifieke doelgroepen
Ouderen (≥ 65 jaar)
Er is geen dosisaanpassing nodig op basis van leeftijd. De therapeutische ervaring bij patiënten van ≥ 75 jaar is beperkt en het gebruik bij deze patiënten wordt niet aanbevolen (zie rubriek 4.4 en 5.2).
Nierinsufficiëntie
Er is geen dosisaanpassing nodig bij patiënten met lichte of matig ernstige nierinsufficiëntie (creatinineklaring ≥ 30 ml/min). Saxenda wordt niet aanbevolen voor gebruik bij patiënten met ernstige nierinsufficiëntie (creatinineklaring < 30 ml/min), waaronder patiënten met ‘End-Stage’ nierziekte (zie rubriek 4.4, 4.8 en 5.2).
Leverinsufficiëntie
Dosisaanpassing wordt niet aanbevolen voor patiënten met lichte of matig ernstige leverinsufficiëntie. Saxenda wordt niet aanbevolen voor gebruik bij patiënten met ernstige leverinsufficiëntie en moet met voorzichtigheid gebruikt worden bij patiënten met lichte of matig ernstige leverinsufficiëntie (zie rubriek 4.4 en 5.2).
Pediatrische patiënten
Er is geen dosisaanpassing nodig voor adolescenten en kinderen van 6 jaar en ouder.
De veiligheid en werkzaamheid van Saxenda bij kinderen onder de 6 jaar is nog niet vastgesteld (zie rubriek 5.1).
Wijze van toediening
Saxenda is uitsluitend bestemd voor subcutaan gebruik. Het mag niet intraveneus of intramusculair worden toegediend.
Saxenda wordt eenmaal daags toegediend op een willekeurig tijdstip, onafhankelijk van de maaltijden. Het moet worden geïnjecteerd in de buik, de dij of de bovenarm. De injectieplaats en het injectietijdstip kunnen zonder aanpassing van de dosis worden gewijzigd. Heeft de patiënt het beste tijdstip van de dag eenmaal bepaald dan heeft het echter de voorkeur dat Saxenda op ongeveer hetzelfde tijdstip van de dag wordt geïnjecteerd. De injectieplaatsen dienen altijd te worden afgewisseld om de kans op amyloïdafzettingen op de injectieplaats te verminderen (zie rubriek 4.8).
Zie rubriek 6.6 voor verdere instructies voor de toediening.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel:
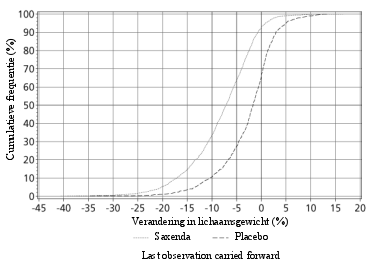
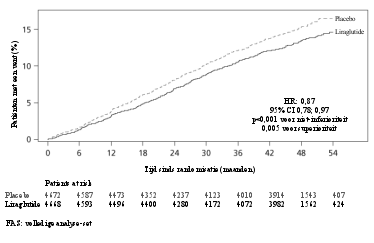
Saxenda werd op veiligheid geëvalueerd in 5 dubbelblinde, placebogecontroleerde studies bij 5.813 volwassen patiënten met overgewicht of obesitas en ten minste één gewichtsgerelateerde comorbiditeit. Gastro-intestinale bijwerkingen waren de meest frequent gemelde bijwerkingen tijdens de behandeling (67,9%) (zie rubriek ‘Beschrijving van een geselecteerd aantal bijwerkingen’).
Tabel met lijst van de bijwerkingen
In tabel 4 staan de bijwerkingen die zijn gemeld bij volwassenen. De bijwerkingen zijn onderverdeeld naar systeem/orgaanklasse en frequentie. De frequenties zijn gedefinieerd als: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen iedere frequentiegroep zijn de bijwerkingen gerangschikt in volgorde van afnemende ernst.
Tabel 4. Bijwerkingen gemeld bij volwassenen
MedDRA systeem/orgaan-klasse | Zeer vaak | Vaak | Soms | Zelden | Niet bekend |
Immuunsysteem-aandoeningen |
|
|
| anafylac-tische reactie |
|
Voedings- en stofwisselings-stoornissen |
| hypoglykemie* | dehydratie |
|
|
Psychische stoornissen |
| insomnia** |
|
|
|
Zenuwstelsel- | hoofdpijn | duizeligheid |
|
|
|
Hartaandoeningen |
|
| tachycardie |
|
|
Maagdarmstelsel-aandoeningen | misselijkheid | droge mond | pancreatitis*** |
| Ingewanden-obstructie† |
Lever- en galaandoeningen |
| cholelithiase*** | cholecystitis*** |
|
|
Huid- en onderhuid-aandoeningen |
| rash | urticaria |
| huidamy-loïdose |
Nier- en urineweg-aandoeningen |
|
|
| acuut nierfalen |
|
Algemene aandoeningen en toedieningsplaats-stoornissen |
| reacties op de injectieplaats | malaise |
|
|
Onderzoeken |
| verhoogde lipase |
|
|
|
*Hypoglykemie (op basis van zelf gemelde symptomen door patiënten en niet bevestigd door meting van bloedglucose) gemeld bij patiënten zonder diabetes mellitus type 2 en behandeld met Saxenda in combinatie met dieet en lichaamsbeweging. Zie rubriek ‘Beschrijving van een geselecteerd aantal bijwerkingen’ voor meer informatie.
**Insomnia werd voornamelijk gezien tijdens de eerste 3 maanden van behandeling.
***Zie rubriek 4.4.
****Uit gecontroleerde klinische fase 2-, 3a- en 3b-studies.
†ADR (Adverse Drug Reaction) afkomstig van postmarketingbronnen.
Beschrijving van een geselecteerd aantal bijwerkingen
Hypoglykemie bij patiënten zonder diabetes mellitus type 2
In klinische studies bij patiënten met obesitas of overgewicht zonder diabetes mellitus type 2 die werden behandeld met Saxenda in combinatie met dieet en lichaamsbeweging, zijn geen ernstige hypoglykemische episoden gemeld (waarbij hulp van derden nodig was). Symptomen van hypoglykemische episoden werden gemeld door 1,6% van de patiënten behandeld met Saxenda en door 1,1% van de patiënten behandeld met placebo; deze episoden werden echter niet bevestigd door bloedglucosemetingen. De meeste episoden waren mild van aard.
Hypoglykemie bij patiënten met diabetes mellitus type 2
In een klinische studie bij patiënten met obesitas of overgewicht in combinatie met diabetes mellitus type 2 die werden behandeld met Saxenda in combinatie met dieet en lichaamsbeweging, werd ernstige hypoglykemie (waarbij hulp van derden nodig was) gemeld door 0,7% van de patiënten behandeld met Saxenda en alléén bij patiënten die tegelijkertijd werden behandeld met sulfonylureumderivaten. Bij deze patiënten werd ook gedocumenteerde symptomatische hypoglykemie gemeld door 43,6% van de patiënten behandeld met Saxenda en 27,3% van de patiënten behandeld met placebo. Van de patiënten die niet gelijktijdig met sulfonylureumderivaten werden behandeld, maakte 15,7% van de patiënten behandeld met Saxenda en 7,6% van de patiënten behandeld met een placebo melding van gedocumenteerde symptomatische hypoglykemische episoden (gedefinieerd als plasmaglucose ≤ 3,9 mmol/l in combinatie met symptomen).
Hypoglykemie bij patiënten met diabetes mellitus type 2 behandeld met insuline
In een klinische studie bij patiënten met obesitas of overgewicht in combinatie met diabetes mellitus type 2 die werden behandeld met insuline en liraglutide 3,0 mg/dag in combinatie met dieet en lichaamsbeweging en maximaal 2 OAD’s was ernstige hypoglykemie gemeld (waarbij hulp van derden nodig was) bij 1,5% van de patiënten behandeld met liraglutide 3,0 mg/dag. In deze studie werd bij 47,2% van de patiënten die behandeld werden met liraglutide 3,0 mg/dag en bij 51,8% van de patiënten die behandeld werden met placebo gedocumenteerde symptomatische hypoglykemie (gedefinieerd als plasmaglucose ≤ 3,9 mmol/l in combinatie met symptomen) gemeld. Van de patiënten die gelijktijdig met sulfonylureumderivaten werden behandeld, maakte 60,9% van de patiënten behandeld met liraglutide 3,0 mg/dag en 60,0% van de patiënten behandeld met een placebo melding van gedocumenteerde symptomatische hypoglykemische episoden.
Gastro-intestinale bijwerkingen
De meeste gastro-intestinale bijwerkingen waren mild tot matig ernstig en voorbijgaand van aard, en de meeste leidden niet tot staken van de behandeling. De bijwerkingen deden zich meestal voor tijdens de eerste weken van behandeling en namen bij voortzetting van de behandeling binnen enkele dagen of weken af.
Patiënten ≥ 65 jaar ondervinden mogelijk meer gastro-intestinale klachten bij behandeling met Saxenda.
Patiënten met lichte of matig ernstige nierinsufficiëntie (creatinineklaring ≥ 30 ml/min) ondervinden mogelijk meer gastro-intestinale klachten bij behandeling met Saxenda.
Acuut nierfalen
Bij patiënten behandeld met GLP-1-receptoragonisten zijn gevallen van acuut nierfalen gemeld. De meeste meldingen betroffen patiënten die last hadden van misselijkheid, braken of diarree met volumedepletie als gevolg (zie rubriek 4.4).
Allergische reacties
Een klein aantal gevallen van anafylactische reacties met symptomen zoals hypotensie, palpitaties, dyspneu en oedeem zijn gemeld na het in de handel brengen van liraglutide. Anafylactische reacties zijn potentieel levensbedreigend. Als het vermoeden bestaat van een anafylactische reactie moet de behandeling met liraglutide worden gestaakt en niet opnieuw worden gestart (zie rubriek 4.3)
Reacties op de injectieplaats
Reacties op de injectieplaats zijn gemeld bij patiënten die behandeld werden met Saxenda. Deze reacties waren meestal mild en voorbijgaand van aard en de meeste verdwenen tijdens het voortzetten van de behandeling.
Tachycardie
In klinische studies werd tachycardie gemeld bij 0,6% van de patiënten behandeld met Saxenda en bij 0,1% van de patiënten behandeld met placebo. De meeste episoden waren mild of matig ernstig van aard. De episoden stonden op zichzelf en de meeste verdwenen tijdens het voortzetten van de behandeling vanzelf.
Huidamyloïdose
Huidamyloïdose kan optreden op de injectieplaats (zie rubriek 4.2).
Pediatrische patiënten
In een klinische studie uitgevoerd bij adolescenten van 12 tot 18 jaar met obesitas werden 125 patiënten blootgesteld aan Saxenda gedurende 56 weken.
Over het algemeen waren de frequentie, het type en de ernst van de bijwerkingen bij de adolescenten met obesitas vergelijkbaar met die waargenomen bij de volwassen populatie. Braken kwam tweemaal zo vaak voor bij adolescenten in vergelijking met volwassenen.
Het percentage patiënten dat ten minste één episode van klinisch significante hypoglykemie meldde, was hoger met liraglutide (1,6%) vergeleken met placebo (0,8%). Tijdens het onderzoek traden geen ernstige hypoglykemische episodes op.
In een klinische studie uitgevoerd bij kinderen van 6 tot < 12 jaar met obesitas (studie 4392) werden 56 patiënten blootgesteld aan Saxenda gedurende 56 weken.
Over het algemeen waren de frequentie, het type en de ernst van de bijwerkingen bij de kinderen met obesitas vergelijkbaar met die waargenomen bij de adolescente en volwassen populatie.
Kinderen rapporteerden meer gastro-intestinale bijwerkingen in zowel de liraglutide- als de placebogroepen in vergelijking met adolescenten en volwassenen. Daarbij werd een tweevoudige toename van braken gezien bij kinderen in vergelijking met adolescenten.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
E-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novo Nordisk A/S
Novo Alle 1
DK-2880 Bagsværd
Denemarken
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/15/992/001-003
10. DATUM VAN HERZIENING VAN DE TEKST
06/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3384401 | SAXENDA 6MG/ML OPL INJ VOORGEVULDE PEN 5X3ML | A10BJ02 | € 244,99 | - | Ja | - | - |