1. NAAM VAN HET GENEESMIDDEL
Jardiance® 10 mg filmomhulde tabletten
Jardiance® 25 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Jardiance 10 mg filmomhulde tabletten
Elke tablet bevat 10 mg empagliflozine.
Hulpstoffen met bekend effect
Elke tablet bevat lactosemonohydraat equivalent aan 154,3 mg watervrije lactose.
Jardiance 25 mg filmomhulde tabletten
Elke tablet bevat 25 mg empagliflozine.
Hulpstoffen met bekend effect
Elke tablet bevat lactosemonohydraat equivalent aan 107,4 mg watervrije lactose.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet (tablet).
Jardiance 10 mg filmomhulde tabletten
Ronde, lichtgele, biconvexe, filmomhulde tablet met afgeschuinde rand, met de inscriptie 'S10' aan de ene kant en het logo van Boehringer Ingelheim aan de andere kant (tabletdiameter: 9,1 mm).
Jardiance 25 mg filmomhulde tabletten
Ovale, lichtgele, biconvexe, filmomhulde tablet met de inscriptie 'S25' aan de ene kant en het logo van Boehringer Ingelheim aan de andere kant (tabletlengte: 11,1 mm, tabletbreedte: 5,6 mm).
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Diabetes mellitus type 2
Jardiance is geïndiceerd voor gebruik bij volwassenen en kinderen in de leeftijd van 10 jaar en ouder voor de behandeling van onvoldoende gereguleerde diabetes mellitus type 2 als aanvulling op dieet en lichaamsbeweging
- als monotherapie als metformine niet geschikt geacht wordt vanwege intolerantie
- als aanvulling op andere geneesmiddelen voor de behandeling van diabetes
Voor studieresultaten met betrekking tot combinatie van behandelingen, werkzaamheid op bloedglucoseregulatie, cardiovasculaire en renale gebeurtenissen, en de onderzochte populaties, zie rubrieken 4.4, 4.5 en 5.1.
Hartfalen
Jardiance is geïndiceerd voor de behandeling van volwassenen met symptomatisch chronisch hartfalen.
Chronische nierschade
Jardiance is geïndiceerd voor de behandeling van volwassenen met chronische nierschade.
4.2 Dosering en wijze van toediening
Dosering
Diabetes mellitus type 2
De aanbevolen aanvangsdosering is 10 mg empagliflozine eenmaal daags voor monotherapie en aanvullende combinatietherapie met andere geneesmiddelen voor de behandeling van diabetes. Bij patiënten die empagliflozine 10 mg eenmaal daags verdragen en die een eGFR ≥ 60 ml/min/1,73 m2 hebben en bij wie een strakkere bloedglucoseregulatie nodig is, kan de dosis worden verhoogd naar 25 mg eenmaal daags. De maximale dagelijkse dosis is 25 mg (zie hieronder en rubriek 4.4).
Hartfalen
De aanbevolen dosering is 10 mg empagliflozine eenmaal daags.
Chronische nierschade
De aanbevolen dosering is 10 mg empagliflozine eenmaal daags.
Alle indicaties
Als empagliflozine wordt gebruikt in combinatie met een sulfonylureumderivaat of met insuline, kan worden overwogen om de dosering van het sulfonylureumderivaat of de insuline te verlagen om de kans op hypoglykemie te verminderen (zie rubrieken 4.5 en 4.8).
Als een dosis wordt overgeslagen, moet deze worden ingenomen zodra de patiënt dit beseft. Er mag geen dubbele dosis op dezelfde dag worden ingenomen.
Speciale patiëntgroepen
Nierinsufficiëntie
Vanwege beperkte ervaring wordt het afgeraden om een behandeling met empagliflozine te starten bij patiënten met een eGFR van < 20 ml/min/1,73 m2.
Bij patiënten met een eGFR van < 60 ml/min/1,73 m2 is de dagelijkse dosis empagliflozine 10 mg.
Bij patiënten met diabetes mellitus type 2 is de glucoseverlagende werkzaamheid van empagliflozine verminderd bij patiënten met een eGFR van < 45 ml/min/1,73 m2 en waarschijnlijk afwezig bij patiënten met een eGFR van < 30 ml/min/1,73 m2. Daarom dient bij een eGFR van minder dan 45 ml/min/1,73 m2 zo nodig een aanvullende glucoseverlagende behandeling te worden overwogen (zie rubriek 4.4, 4.8, 5.1 en 5.2).
Leverinsufficiëntie
Er is geen dosisaanpassing nodig bij patiënten met een leverinsufficiëntie. Blootstelling aan empagliflozine is verhoogd bij patiënten met ernstige leverinsufficiëntie. Therapeutische ervaring bij patiënten met ernstige leverfunctiestoornis is beperkt en daarom wordt gebruik in deze populatie niet aanbevolen (zie rubriek 5.2).
Ouderen
Er wordt geen dosisaanpassing aanbevolen op basis van leeftijd. Bij patiënten van 75 jaar en ouder moet rekening worden gehouden met een verhoogd risico op volumedepletie (zie rubrieken 4.4 en 4.8).
Pediatrische patiënten
De aanbevolen aanvangsdosering is 10 mg empagliflozine eenmaal daags. Bij patiënten die empagliflozine 10 mg eenmaal daags verdragen en aanvullende glykemische regulering nodig hebben, kan de dosis worden verhoogd naar 25 mg eenmaal daags (zie rubriek 5.1 en 5.2). Er zijn geen gegevens beschikbaar voor kinderen die een eGFR < 60 ml/min/1,73 m2 hebben en kinderen jonger dan 10 jaar.
De veiligheid en werkzaamheid van empagliflozine voor de behandeling van hartfalen of voor de behandeling van chronische nierschade bij kinderen jonger dan 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
De tabletten kunnen met of zonder voedsel worden ingenomen, en in hun geheel worden doorgeslikt met water.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor (een van de) in rubriek 6.1 vermelde hulpstof(fen).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Diabetes mellitus type 2
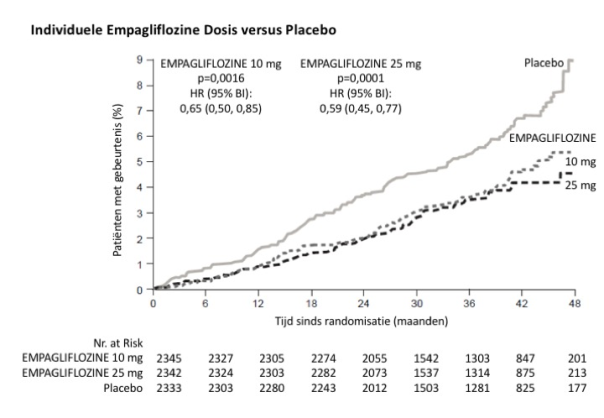
Een totaal van 15 582 patiënten met diabetes type 2 werd geïncludeerd in klinische studies om de veiligheid van empagliflozine te evalueren, van wie 10 004 patiënten empagliflozine ontvingen, hetzij als monotherapie of in combinatie met metformine, een sulfonylureumderivaat, DPP-4-remmers of insuline.
In 6 placebogecontroleerde studies van 18 tot 24 weken werden 3 534 patiënten geïncludeerd van wie er 1 183 werden behandeld met placebo en 2 351 met empagliflozine. De totale incidentie van bijwerkingen bij patiënten behandeld met empagliflozine was gelijk aan die bij placebopatiënten. De meest frequent gemelde bijwerking was hypoglykemie wanneer er gelijktijdig een sulfonylureumderivaat of insuline was gebruikt (zie beschrijving van geselecteerde bijwerkingen).
Hartfalen
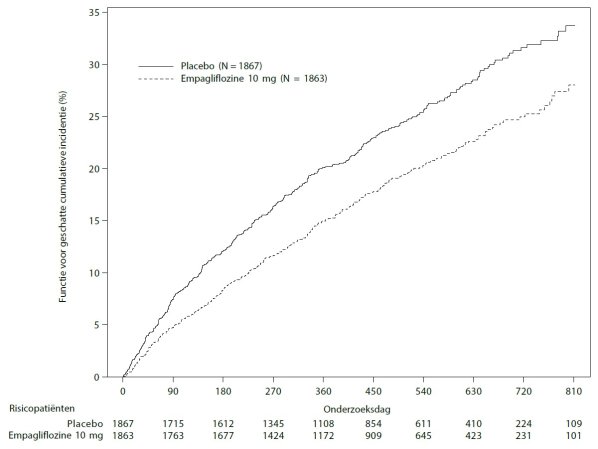
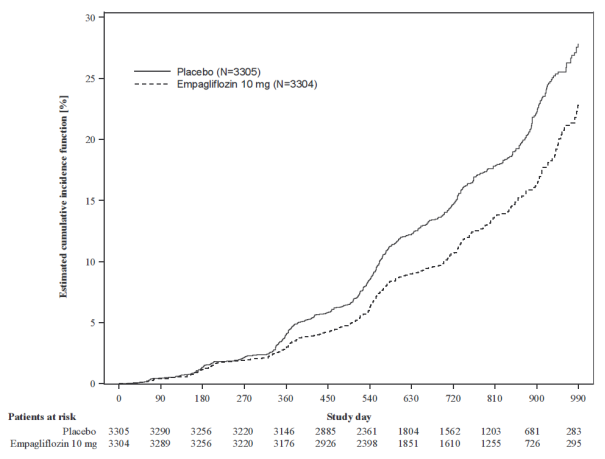
De EMPEROR‑studies omvatten patiënten met hartfalen met ofwel verminderde ejectiefractie (N=3 726) dan wel behouden ejectiefractie (N=5 985), die werden behandeld met empagliflozine 10 mg of placebo. Ongeveer de helft van de patiënten had diabetes mellitus type 2. De meest frequente bijwerking van de EMPEROR‑Reduced- en EMPEROR‑Preserved-studies samen was volumedepletie (empagliflozine 10 mg: 11,4%; placebo: 9,7%).
Chronische nierschade
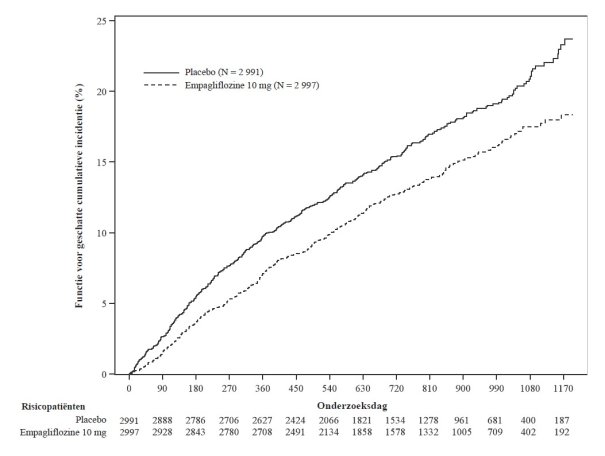
De EMPA‑KIDNEY‑studie omvatte patiënten met chronische nierschade (N = 6 609) die werden behandeld met 10 mg empagliflozine of placebo. Ongeveer 44% van de patiënten had diabetes mellitus type 2. De meest frequente bijwerkingen in de EMPA‑KIDNEY‑studie waren jicht (empagliflozine 7,0% versus placebo 8,0%) en acuut nierletsel (empagliflozine 2,8% versus placebo 3,5%), die vaker werden gemeld bij met placebo behandelde patiënten.
Over het geheel genomen was het veiligheidsprofiel van empagliflozine in het algemeen consistent over de bestudeerde indicaties.
Bijwerkingen in tabelvorm
Bijwerkingen, geclassificeerd per systeem/orgaanklasse en volgens voorkeurstermen van MedDRA, die gemeld zijn bij patiënten die empagliflozine kregen in placebogecontroleerde studies, worden in onderstaande tabel weergegeven (tabel 1).
De bijwerkingen worden gerangschikt per absolute frequentie. Frequenties worden gedefinieerd als zeer vaak (≥1/10), vaak (≥1/100, <1/10), soms (≥1/1 000, <1/100), zelden (≥1/10 000, <1/1 000) of zeer zelden (<1/10 000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1: Lijst met bijwerkingen (MedDRA) in tabelvorm gerapporteerd in placebogecontroleerde studies en gegevens die zijn verkregen uit postmarketingervaring
Systeem/ | Zeer vaak | Vaak | Soms | Zelden | Zeer zelden |
Infecties en parasitaire aandoeningen |
| Vaginale candidiasis, vulvovaginitis, balanitis en andere genitale infectiesa |
| Necrotiserende fasciitis van het perineum (fournier-gangreen)* |
|
Voedings- en stofwisselings-stoornissen | Hypoglykemie (wanneer gebruikt met sulfonylureumderivaat of insuline)a | Dorst | Ketoacidose* |
|
|
Maagdarmstelselaandoeningen |
| Constipatie |
|
|
|
Huid- en onderhuid-aandoeningen |
| Pruritis (gegenerali-seerd) | Urticaria |
|
|
Bloedvat- | Volumedepletiea |
|
|
|
|
Nier- en urineweg |
| Vaker plassena | Dysurie |
| Tubulo-interstitiële nefritis |
Onderzoeken |
| Serum lipiden verhoogda | Bloed-creatinine verhoogd/ glomerulaire filtratie-snelheid verlaagda |
|
|
a zie paragrafen hieronder voor aanvullende informatie
* zie rubriek 4.4
Beschrijving van geselecteerde bijwerkingen
Hypoglykemie
De frequentie van hypoglykemie was afhankelijk van de achtergrondtherapie in de respectieve studies en was gelijk voor empagliflozine en placebo als monotherapie, als aanvullende therapie op metformine, als aanvullende therapie op pioglitazon met of zonder metformine, als aanvullende therapie op linagliptine en metformine, en als aanvulling op standaard ondersteunende behandeling en voor de combinatie van empagliflozine met metformine bij geneesmiddelnaïeve patiënten in vergelijking met degenen die behandeld werden met empagliflozine en metformine als individuele bestanddelen. Een verhoogde frequentie werd waargenomen wanneer gegeven als een aanvullende therapie op metformine en een sulfonylureumderivaat (empagliflozine 10 mg: 16,1%, empagliflozine 25 mg: 11,5%, placebo: 8,4%), aanvullende therapie op basale insuline met of zonder metformine en met of zonder een sulfonylureumderivaat (empagliflozine 10 mg: 19,5%, empagliflozine 25 mg: 28,4%, placebo: 20,6% tijdens de eerste 18 weken behandeling wanneer insuline niet kon worden aangepast; empagliflozine 10 mg en 25 mg: 36,1%, placebo 35,3% gedurende de studie van 78 weken) en als aanvulling op MDI-insuline met of zonder metformine (empagliflozine 10 mg: 39,8%, empagliflozine 25 mg: 41,3%, placebo: 37,2% tijdens de eerste 18 weken behandeling toen insuline niet kon worden aangepast; emagliflozine 10 mg: 51,1%, empagliflozine 25 mg: 57,7%, placebo: 58% gedurende de studie van 52 weken).
In de EMPEROR‑studies naar hartfalen werden vergelijkbare frequenties van hypoglykemie waargenomen bij gebruik als aanvulling op sulfonylureum of insuline (empagliflozine 10 mg: 6,5%; placebo: 6,7%).
Ernstige hypoglykemie (gebeurtenissen die hulp vereisen)
Er werd geen toename in ernstige hypoglykemie waargenomen bij empagliflozine vergeleken met placebo als monotherapie, als aanvullende therapie op metformine, als aanvullende therapie op metformine en een sulfonylureumderivaat, als aanvullende therapie op pioglitazon met of zonder metformine, aanvullende therapie op linagliptine en metformine, als aanvulling op standaard ondersteunende behandeling en voor de combinatie van empagliflozine met metformine bij geneesmiddelnaïeve patiënten in vergelijking met degenen die behandeld werden met empagliflozine en metformine als individuele bestanddelen. Een verhoogde frequentie werd waargenomen wanneer gegeven als een aanvullende therapie op basale insuline met of zonder metformine en met of zonder een sulfonylureumderivaat (empagliflozine 10 mg: 0%, empagliflozine 25 mg: 1,3%, placebo: 0% tijdens de eerste 18 weken behandeling wanneer insuline niet kon worden aangepast; empagliflozine 10 mg: 0%, empagliflozine 25 mg: 1,3%, placebo 0% gedurende de studie van 78 weken) en aanvullende op MDI-insuline met of zonder metformine (empagliflozine 10 mg: 0,5%, empagliflozine 25 mg: 0,5%, placebo: 0,5% tijdens de eerste 18 weken behandeling toen insuline niet kon worden aangepast; empagliflozine 10 mg: 1,6%, empagliflozine 25 mg: 0,5%, placebo: 1,6% gedurende de studie van 52 weken).
In de EMPEROR‑studies naar hartfalen werden vergelijkbare frequenties van ernstige hypoglykemie waargenomen bij patiënten met diabetes mellitus bij behandeling met empagliflozine en placebo als aanvulling op sulfonylureum of insuline (empagliflozine 10 mg: 2,2%; placebo: 1,9%).
Vaginale candidiasis, vulvovaginitis, balanitis en andere genitale infecties
Vaginale candidiasis, vulvovaginitis, balanitis en andere genitale infecties werden vaker gemeld bij patiënten behandeld met empagliflozine (empagliflozine 10 mg: 4,0%, empagliflozine 25 mg: 3,9%) vergeleken met placebopatiënten (1,0%). Deze infecties werden vaker gemeld bij vrouwen behandeld met empagliflozine vergeleken met placebopatiënten, en het verschil in frequentie was minder uitgesproken bij mannen. De genitale infecties waren mild of matig in intensiteit.
In de EMPEROR‑studies naar hartfalen was de frequentie van deze infecties beduidend hoger bij patiënten met diabetes mellitus (empagliflozine 10 mg: 2,3%; placebo: 0,8%) dan bij patiënten zonder diabetes mellitus (empagliflozine10 mg: 1,7%; placebo: 0,7%) bij vergelijking tussen behandeling met empagliflozine of met placebo.
Er zijn gevallen van fimose/verworven fimose gelijktijdig met genitale infecties gemeld en in sommige gevallen was circumcisie nodig.
Vaker plassen
Vaker plassen (met inbegrip van de vooraf gedefinieerde termen pollakisurie, polyurie en nycturie) werd met hogere frequentie waargenomen bij patiënten behandeld met empagliflozine (empagliflozine 10 mg: 3,5%, empagliflozine 25 mg: 3,3%) vergeleken met placebopatiënten (1,4%). Vaker plassen was meestal mild of matig in intensiteit. De frequentie van de gemelde nycturie was vergelijkbaar voor placebo en empagliflozine (< 1%).
In de EMPEROR‑studies naar hartfalen werden vergelijkbare frequenties van vaker plassen waargenomen bij patiënten die werden behandeld met empagliflozine en met placebo (empagliflozine 10 mg: 0,9%; placebo: 0,5%).
Urineweginfectie
De totale frequentie van urineweginfectie gemeld als bijwerking was vergelijkbaar bij patiënten behandeld met empagliflozine 25 mg en placebo (7,0% en 7,2%) en hoger met empagliflozine 10 mg (8,8%). Vergelijkbaar met placebo werd urineweginfectie vaker gemeld voor empagliflozine bij patiënten met een geschiedenis van chronische of terugkerende urineweginfecties. De intensiteit (mild, matig, ernstig) van urineweginfecties was vergelijkbaar bij patiënten behandeld met empagliflozine en placebo. Urineweginfecties werden vaker gemeld bij vrouwen behandeld met empagliflozine vergeleken met placebo; er was geen verschil bij mannen.
Volumedepletie
De totale frequentie van volumedepletie (met inbegrip van de vooraf gedefinieerde termen verlaagde bloeddruk (ambulant), verlaagde systolische bloeddruk, dehydratie, hypotensie, hypovolemie, orthostatische hypotensie en syncope) was vergelijkbaar bij patiënten behandeld met empagliflozine (empagliflozine 10 mg: 0,6%, empagliflozine 25 mg: 0,4%) en placebo (0,3%). De frequentie van voorvallen van volumedepletie was toegenomen bij patiënten van 75 jaar en ouder behandeld met empagliflozine 10 mg (2,3%) of empagliflozine 25 mg (4,3%) vergeleken met placebo (2,1%).
Bloedcreatinine verhoogd/glomerulaire filtratiesnelheid verlaagd
De totale frequentie van patiënten met verhoogd bloedcreatinine en verlaagde glomerulaire filtratiesnelheid was gelijk voor empagliflozine en placebo (bloedcreatinine verhoogd: empagliflozine 10 mg 0,6%, empagliflozine 25 mg 0,1%, placebo 0,5%; glomerulaire filtratiesnelheid verlaagd: empagliflozine 10 mg 0,1%, empagliflozine 25 mg 0%, placebo 0,3%).
Aanvankelijke stijgingen van creatinine en aanvankelijke dalingen van geschatte glomerulaire filtratiesnelheden bij patiënten behandeld met empagliflozine waren over het algemeen voorbijgaand bij voortgezette behandeling of reversibel na staken van de behandeling met het geneesmiddel.
In overeenkomst met andere studies was er in de EMPA‑REG OUTCOME studie bij patiënten behandeld met empagliflozine sprake van een aanvankelijke daling van de eGFR (gemiddeld: 3 ml/min/1,73 m2). Daarna bleef de eGFR gehandhaafd bij het voortzetten van de behandeling. De gemiddelde eGFR keerde terug naar baseline na staken van de behandeling, wat erop kan duiden dat acute hemodynamische veranderingen een rol kunnen spelen bij deze veranderingen van de nierfunctie. Dit fenomeen is ook waargenomen in de EMPEROR‑studies naar hartfalen en de EMPA‑KIDNEY‑studie.
Serumlipiden verhoogd
Gemiddelde verhogingen vanaf baseline bij empagliflozine 10 mg en 25 mg versus placebo waren voor totaal cholesterol respectievelijk 4,9% en 5,7% versus 3,5%; voor HDL‑cholesterol 3,3% en 3,6% versus 0,4%; voor LDL‑cholesterol 9,5% en 10,0% versus 7,5% en voor triglyceriden 9,2% en 9,9% versus 10,5%.
Haematocriet verhoogd
Gemiddelde veranderingen in hematocriet vanaf baseline bij empagliflozine 10 mg en 25 mg waren respectievelijk 3,4% en 3,6%, in vergelijking met 0,1% voor placebo. In het onderzoek EMPA‑REG Outcome keerden de hematocrietwaarden terug naar de baselinewaarden na een follow‑up periode van 30 dagen na het stopzetten van de behandeling.
Pediatrische patiënten
In de DINAMO‑studie werden 157 kinderen van 10 jaar en ouder met diabetes type 2 behandeld. Van hen kregen 52 patiënten empagliflozine, 52 linagliptine en 53 placebo (zie rubriek 5.1).
Tijdens de placebogecontroleerde fase was hypoglykemie de meest voorkomende bijwerking met hogere totale percentages voor patiënten behandeld met empagliflozine in vergelijking met de placebogroep (empagliflozine 10 mg en 25 mg samen: 23,1%; placebo: 9,4%). Geen van deze voorvallen was ernstig en directe hulp was niet nodig.
Over het geheel genomen was het veiligheidsprofiel bij kinderen vergelijkbaar met het veiligheidsprofiel bij volwassenen met diabetes mellitus type 2.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal agentschap voor geneesmiddelen en gezondheidsproducten - www.fagg.be - Afdeling Vigilantie.
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Boehringer Ingelheim International GmbH
Binger Str. 173
55216 Ingelheim am Rhein
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Jardiance 10 mg filmomhulde tabletten
EU/1/14/930/010
EU/1/14/930/011
EU/1/14/930/012
EU/1/14/930/013
EU/1/14/930/014
EU/1/14/930/015
EU/1/14/930/016
EU/1/14/930/017
EU/1/14/930/018
Jardiance 25 mg filmomhulde tabletten
EU/1/14/930/001
EU/1/14/930/002
EU/1/14/930/003
EU/1/14/930/004
EU/1/14/930/005
EU/1/14/930/006
EU/1/14/930/007
EU/1/14/930/008
EU/1/14/930/009
10. DATUM VAN HERZIENING VAN DE TEKST
10/02/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3153657 | JARDIANCE 10 MG FILMOMH TABL 30 | A10BK03 | € 51 | - | Ja | € 12,5 | € 7,55 |
| 3153665 | JARDIANCE 10 MG FILMOMH TABL 100 | A10BK03 | € 148,75 | - | Ja | € 15,5 | € 10,2 |
| 3153673 | JARDIANCE 25 MG FILMOMH TABL 30 | A10BK03 | € 51 | - | Ja | - | - |
| 3153681 | JARDIANCE 25 MG FILMOMH TABL 100 | A10BK03 | € 148,75 | - | Ja | - | - |