1. NAAM VAN HET GENEESMIDDEL
ORALAIR 100 IR & 300 IR tabletten voor sublinguaal gebruik
Startbehandeling
ORALAIR 300 IR tabletten voor sublinguaal gebruik
Vervolgbehandeling
Startbehandeling
ORALAIR 300 IR tabletten voor sublinguaal gebruik
Vervolgbehandeling
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Allergeenextract van graspollen van: kropaar (Dactylis glomerata L.), gewoon reukgras (Anthoxanthum odoratum L.), Engels raaigras (Lolium perenne L.), veldbeemdgras (Poa pratensis L.) en Timotheegras (Phleum pratense L.).
100 IR* of 300 IR* per tablet voor sublinguaal gebruik
* IR (reactiviteitsindex): De eenheid IR drukt de activiteit van een allergeenextract uit. Het allergeenextract bevat 100 IR/ml wanneer het bij een huidpriktest met een Stallerpoint®, een cirkeldiameter van 7 mm (geometrisch gemiddelde) induceert bij 30 patiënten die gesensibiliseerd zijn voor dit allergeen. De cutane reactiviteit van deze patiënten wordt gelijktijdig aangetoond door een positieve huidpriktest op ofwel 9% codeïnefosfaat of 10 mg/ml histamine. De IR-eenheid van Stallergenes is niet vergelijkbaar met de eenheden van andere allergeenfabrikanten.
Hulpstof met bekend effect: lactosemonohydraat.
Een 100 IR tablet voor sublinguaal gebruik bevat 83,1 - 83,6 mg lactosemonohydraat.
Een 300 IR tablet voor sublinguaal gebruik bevat 81,8 - 83,1 mg lactosemonohydraat.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
100 IR* of 300 IR* per tablet voor sublinguaal gebruik
* IR (reactiviteitsindex): De eenheid IR drukt de activiteit van een allergeenextract uit. Het allergeenextract bevat 100 IR/ml wanneer het bij een huidpriktest met een Stallerpoint®, een cirkeldiameter van 7 mm (geometrisch gemiddelde) induceert bij 30 patiënten die gesensibiliseerd zijn voor dit allergeen. De cutane reactiviteit van deze patiënten wordt gelijktijdig aangetoond door een positieve huidpriktest op ofwel 9% codeïnefosfaat of 10 mg/ml histamine. De IR-eenheid van Stallergenes is niet vergelijkbaar met de eenheden van andere allergeenfabrikanten.
Hulpstof met bekend effect: lactosemonohydraat.
Een 100 IR tablet voor sublinguaal gebruik bevat 83,1 - 83,6 mg lactosemonohydraat.
Een 300 IR tablet voor sublinguaal gebruik bevat 81,8 - 83,1 mg lactosemonohydraat.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Tablet voor sublinguaal gebruik.
De tabletten van 100 IR zijn licht gespikkeld wit tot beige met “100” gegraveerd aan beide kanten.
De tabletten van 300 IR zijn licht gespikkeld wit tot beige met “300” gegraveerd aan beide kanten.
De tabletten van 100 IR zijn licht gespikkeld wit tot beige met “100” gegraveerd aan beide kanten.
De tabletten van 300 IR zijn licht gespikkeld wit tot beige met “300” gegraveerd aan beide kanten.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
ORALAIR is geïndiceerd voor de behandeling van graspollengeïnduceerde rhinitis met of zonder conjunctivitis bij volwassenen, adolescenten en kinderen (ouder dan 5 jaar) met klinisch relevante symptomen, bevestigd door middel van een positieve cutane test en/of een positieve titer van specifiek IgE voor graspollen.
4.2 Dosering en wijze van toediening
Behandeling met ORALAIR dient uitsluitend te worden voorgeschreven en gestart door artsen met voldoende training en ervaring in de behandeling van allergische ziekten. Als ORALAIR wordt voorgeschreven aan kinderen, dient de arts overeenkomstige training en ervaring in de behandeling van kinderen te hebben.
De eerste tablet ORALAIR dient te worden ingenomen onder medisch toezicht en de patiënt dient gedurende 30 minuten te worden gecontroleerd.
Dosering
De therapie bestaat uit een startbehandeling (waaronder een 3-daagse oplopende dosering) en een vervolgbehandeling.
De startbehandeling komt overeen met de eerste maand van behandeling met ORALAIR 100 IR & 300 IR tabletten voor sublinguaal gebruik:
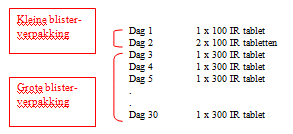
Vanaf de tweede maand dient de behandeling vervolgd te worden met één ORALAIR 300 IR tablet voor sublinguaal gebruik per dag tot het einde van het pollenseizoen.
De behandeling moet ongeveer 4 maanden voor het verwachte begin van het pollenseizoen worden gestart en moet tot het einde van het pollenseizoen worden voortgezet.
Indien geen relevante verbetering optreedt van de symptomen tijdens het eerste pollenseizoen, bestaat geen indicatie voor voortzetting van de behandeling.
In het algemeen geldt dat wanneer de behandeling minder dan 7 dagen wordt onderbroken deze kan worden voortgezet. Als de onderbreking langer duurt dan 7 dagen wordt aangeraden de behandeling onder medisch toezicht te vervolgen.
Speciale patiëntenpopulaties
Klinische ervaring met immunotherapie met ORALAIR bij patiënten ouder dan 50 jaar ontbreekt.
Pediatrische patiënten
De veiligheid en werkzaamheid van ORALAIR bij kinderen jonger dan 5 jaar zijn niet vastgesteld. Gegevens over behandeling met ORALAIR langer dan één graspollenseizoen zijn niet beschikbaar voor kinderen.
De dosering voor adolescenten en kinderen vanaf 5 jaar is hetzelfde als voor volwassenen.
Wijze van toediening
Tabletten moeten onder de tong worden gehouden totdat ze volledig zijn opgelost (gedurende tenminste 1 minuut) en dan worden doorgeslikt.
Aangeraden wordt de tabletten overdag in te nemen, in een lege mond.
De eerste tablet ORALAIR dient te worden ingenomen onder medisch toezicht en de patiënt dient gedurende 30 minuten te worden gecontroleerd.
Dosering
De therapie bestaat uit een startbehandeling (waaronder een 3-daagse oplopende dosering) en een vervolgbehandeling.
De startbehandeling komt overeen met de eerste maand van behandeling met ORALAIR 100 IR & 300 IR tabletten voor sublinguaal gebruik:

Vanaf de tweede maand dient de behandeling vervolgd te worden met één ORALAIR 300 IR tablet voor sublinguaal gebruik per dag tot het einde van het pollenseizoen.
De behandeling moet ongeveer 4 maanden voor het verwachte begin van het pollenseizoen worden gestart en moet tot het einde van het pollenseizoen worden voortgezet.
Indien geen relevante verbetering optreedt van de symptomen tijdens het eerste pollenseizoen, bestaat geen indicatie voor voortzetting van de behandeling.
In het algemeen geldt dat wanneer de behandeling minder dan 7 dagen wordt onderbroken deze kan worden voortgezet. Als de onderbreking langer duurt dan 7 dagen wordt aangeraden de behandeling onder medisch toezicht te vervolgen.
Speciale patiëntenpopulaties
Klinische ervaring met immunotherapie met ORALAIR bij patiënten ouder dan 50 jaar ontbreekt.
Pediatrische patiënten
De veiligheid en werkzaamheid van ORALAIR bij kinderen jonger dan 5 jaar zijn niet vastgesteld. Gegevens over behandeling met ORALAIR langer dan één graspollenseizoen zijn niet beschikbaar voor kinderen.
De dosering voor adolescenten en kinderen vanaf 5 jaar is hetzelfde als voor volwassenen.
Wijze van toediening
Tabletten moeten onder de tong worden gehouden totdat ze volledig zijn opgelost (gedurende tenminste 1 minuut) en dan worden doorgeslikt.
Aangeraden wordt de tabletten overdag in te nemen, in een lege mond.
4.3 Contra-indicaties
• Overgevoeligheid voor één van de in rubriek 6.1 vermelde hulpstoffen;
• Ernstige en/ofof instabiele astma (FEV1 < 70 % voorspelde waarde);
• Ernstige immuundeficiëntie of auto-immuunziekte;
• Maligne ziekten (bijv. kanker);
• Orale ontstekingen (zoals orale lichen planus, orale ulceraties of orale mycose).
• Ernstige en/ofof instabiele astma (FEV1 < 70 % voorspelde waarde);
• Ernstige immuundeficiëntie of auto-immuunziekte;
• Maligne ziekten (bijv. kanker);
• Orale ontstekingen (zoals orale lichen planus, orale ulceraties of orale mycose).
4.8 Bijwerkingen
Tijdens de behandeling met ORALAIR worden patiënten blootgesteld aan allergenen die reacties op de plaats van inname en/of systemische allergische symptomen kunnen veroorzaken.
Reacties op de plaats van inname (zoals bijvoorbeeld jeuk in de mond en keelirritatie) kunnen daarom verwacht worden tijdens de behandelperiode. Indien een patiënt een reactie op de plaats van inname ondervindt, kan symptomatische behandeling (bijv. met antihistaminica) worden overwogen.
Zoals bij elke allergeen immunotherapie, kunnen ernstige allergische reacties optreden waaronder ernstige laryngofaryngeale aandoeningen of systemische allergische reacties (d.w.z. acute ontwikkeling van een ziekte gekenmerkt door klachten van de huid, de slijmvliezen, of beide, ademhalingsproblemen, persistente gastrointestinale symptomen, of verminderde bloeddruk en/of geassocieerde symptomen). Informeer patiënten over de bijbehorende signalen en symptomen en laat hen onmiddellijk medische hulp zoeken en beëindig de behandeling, indien deze voorkomen. De behandeling dient alleen te worden hervat op aanwijzing van een arts.
Samenvatting van het veiligheidsprofiel
Tijdens klinische studies, zijn in totaal 1038 volwassenen en 154 pediatrische patiënten met graspollen-geassocieerde allergische rhinoconjunctivitis zijn behandeld met ORALAIR 300 IR eenmaal daags in placebo-gecontroleerde klinische studies. De ongewenste effecten die in een grotere frequentie zijn gemeld door deze patiënten dan door patiënten die placebo ontvingen zijn samengevat in de onderstaande tabel.
Het merendeel van de bijwerkingen die tot voortijdige terugtrekking uit de studie leidden, waren reacties op de plaats van inname. Deze waren mild of matig in hevigheid en waren niet-ernstig.
Tabel met bijwerkingen
Samenvatting in tabelvorm van bijwerkingen per orgaansysteem en frequentie [zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zeldzaam (≥1/10.000, <1/1.000)]. Binnen elke frequentie categorie worden de ernstige reacties als eerste aangegeven.
In vergelijking met bijwerkingen gemeld tijdens de eerste behandelperiode, werden minder typen en met een lagere frequentie bijwerkingen gemeld tijdens de tweede en derde behandelperiodes door volwassenen die werden behandeld met ORALAIR gedurende drie opeenvolgende graspollenseizoenen in een klinische studie.
Omschrijving van enkele bijwerkingen
Tijdens de behandeling met ORALAIR worden patiënten blootgesteld aan allergenen die reacties op de plaats van inname en/of systemische allergische symptomen kunnen veroorzaken.
Reacties op de plaats van inname (zoals bijvoorbeeld jeuk in de mond en keelirritatie) kunnen daarom verwacht worden tijdens de behandelperiode. Indien een patiënt een reactie op de plaats van inname ondervindt, kan symptomatische behandeling (bijv. met antihistaminica) worden overwogen.
Zoals bij elke allergeen immunotherapie, kunnen ernstige allergische reacties optreden waaronder ernstige laryngofaryngeale aandoeningen of systemische allergische reacties (d.w.z. acute ontwikkeling van een ziekte gekenmerkt door klachten van de huid, de slijmvliezen, of beide, ademhalingsproblemen, persistente gastrointestinale symptomen, of verminderde bloeddruk en/of geassocieerde symptomen). Informeer patiënten over de bijbehorende signalen en symptomen en laat hen onmiddellijk medische hulp zoeken en beëindig de behandeling, indien deze voorkomen. De behandeling dient alleen te worden hervat op aanwijzing van een arts.
Pediatrische patiënten
Over het algemeen is het veiligheidsprofiel bij kinderen vergelijkbaar met dat bij volwassenen. De volgende reacties genoemd in de samenvatting in tabelvorm werden door kinderen met een hogere incidentie gerapporteerd dan door volwassenen: hoest, nasofaryngitis, oedeem van de mond (zeer vaak), oraal allergie syndroom, cheilitis, glossitis, gevoel van brok in de keel, onaangenaam gevoel in het oor (vaak).
In aanvulling op de samenvatting in tabelvorm werden de volgende reacties door kinderen en jongeren die ORALAIR ontvingen gemeld: tonsilitis, bronchitis (vaak), pijn op de borst (soms).
Post-marketing
Verder zijn de volgende bijwerkingen gerapporteerd gedurende post-marketing onderzoek bij volwassenen, adolescenten en kinderen: astma exacerbatie, systemische allergische reactie, eosinofiele oesofagitis.
De frequentie van deze reacties bij behandeling met ORALAIR is niet bekend.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
Federaal agentschap voor geneesmiddelen en gezondheidsproducten
Afdeling Vigilantie
EUROSTATION II
Victor Hortaplein, 40/ 40
B-1060 Brussel
Website: www.fagg.be
e-mail: adversedrugreactions@fagg-afmps.be
Reacties op de plaats van inname (zoals bijvoorbeeld jeuk in de mond en keelirritatie) kunnen daarom verwacht worden tijdens de behandelperiode. Indien een patiënt een reactie op de plaats van inname ondervindt, kan symptomatische behandeling (bijv. met antihistaminica) worden overwogen.
Zoals bij elke allergeen immunotherapie, kunnen ernstige allergische reacties optreden waaronder ernstige laryngofaryngeale aandoeningen of systemische allergische reacties (d.w.z. acute ontwikkeling van een ziekte gekenmerkt door klachten van de huid, de slijmvliezen, of beide, ademhalingsproblemen, persistente gastrointestinale symptomen, of verminderde bloeddruk en/of geassocieerde symptomen). Informeer patiënten over de bijbehorende signalen en symptomen en laat hen onmiddellijk medische hulp zoeken en beëindig de behandeling, indien deze voorkomen. De behandeling dient alleen te worden hervat op aanwijzing van een arts.
Samenvatting van het veiligheidsprofiel
Tijdens klinische studies, zijn in totaal 1038 volwassenen en 154 pediatrische patiënten met graspollen-geassocieerde allergische rhinoconjunctivitis zijn behandeld met ORALAIR 300 IR eenmaal daags in placebo-gecontroleerde klinische studies. De ongewenste effecten die in een grotere frequentie zijn gemeld door deze patiënten dan door patiënten die placebo ontvingen zijn samengevat in de onderstaande tabel.
Het merendeel van de bijwerkingen die tot voortijdige terugtrekking uit de studie leidden, waren reacties op de plaats van inname. Deze waren mild of matig in hevigheid en waren niet-ernstig.
Tabel met bijwerkingen
Samenvatting in tabelvorm van bijwerkingen per orgaansysteem en frequentie [zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zeldzaam (≥1/10.000, <1/1.000)]. Binnen elke frequentie categorie worden de ernstige reacties als eerste aangegeven.
| Orgaansysteemklasse / Frequentie / Bijwerkingen | |||
| Infecties en parasitaire aandoeningen | |||
| Vaak | Nasofaryngitis, rhinitis | ||
| Soms | Koortslip, otitis | ||
| Bloed- en lymfestelselaandoeningen | |||
| Soms | Lymfadenopathie | ||
| Immuunsysteemaandoeningen | |||
| Soms | Overgevoeligheid, oraal allergie syndroom | ||
| Psychische stoornissen | |||
| Soms | Depressie | ||
| Zenuwstelselaandoeningen | |||
| Zeer vaak Soms | Hoofdpijn Dysgeusie, slaperigheid, duizeligheid | ||
| Zeldzaam | Angst | ||
| Oogaandoeningen | |||
| Vaak | Jeukende ogen, conjunctivitis, tranende ogen | ||
| Soms | Roodheid van de ogen, oedeem van de ogen, droogheid van de ogen | ||
| Oor- en evenwichtsorgaanaandoeningen | |||
| Vaak | Jeukende oren | ||
| Soms | Onaangenaam gevoel in het oor | ||
| Vasculaire aandoeningen | |||
| Zeldzaam | Blozen | ||
| Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | |||
| Zeer vaak | Keelirritatie | ||
| Vaak | Astma, allergische rhinitis (neusverstopping, niezen, rinorroe, ongemak aan de neus), hoest, orofaryngeale pijn, faryngeaal oedeem, verstopping van de sinussen, dyspnoea, dysfonie, droge keel, orofaryngeale blaar, orofaryngeaal ongemak | ||
| Soms | Faryngeale hypo-esthesie, gevoel van beklemming van de keel, piepende ademhaling, laryngeaal oedeem | ||
| Maagdarmstelselaandoeningen | |||
| Zeer vaak | Jeuk in de mond | ||
| Vaak | Buikpijn, diarree, braken, oedeem van de mond, Jeuk aan de tong, oedeem van de lippen, paresthesie aan de mond, dyspepsie, oedeem van de tong, hypo-esthesie in de mond, stomatitis, jeuk aan de lippen, onaangenaam gevoel in de mond, misselijkheid, glossodynie, droge mond, dysfagie | ||
| Soms | Pijn aan de mond, gingivitis, cheilitis, gastritis, glossitis, vergroting van de speekselklieren, gastroesofagale reflux, tongaandoening, speeksel hypersecretie, mond ulceratie, oesofagale pijn, oedeem van het gehemelte, aandoening van de mond, odynofagie, oprisping | ||
| Huid en onderhuidaandoeningen | |||
| Vaak | Urticaria, jeuk, atopische dermatitis | ||
| Soms Zelden | Angio-oedeem, huiduitslag, acne Oedeem van het gelaat | ||
| Algemene aandoeningen en toedieningsplaatsstoornissen | |||
| Vaak | Onaangenaam gevoel op de borst | ||
| Soms | Gevoel van brok in de keel, athenie, grieperige aandoening | ||
| Onderzoeken | |||
| Zeldzaam | Toename van eosininofiele telling | ||
| Letsels, intoxicaties en verrichtingscomplicaties | |||
| Soms | Ontvelling | ||
In vergelijking met bijwerkingen gemeld tijdens de eerste behandelperiode, werden minder typen en met een lagere frequentie bijwerkingen gemeld tijdens de tweede en derde behandelperiodes door volwassenen die werden behandeld met ORALAIR gedurende drie opeenvolgende graspollenseizoenen in een klinische studie.
Omschrijving van enkele bijwerkingen
Tijdens de behandeling met ORALAIR worden patiënten blootgesteld aan allergenen die reacties op de plaats van inname en/of systemische allergische symptomen kunnen veroorzaken.
Reacties op de plaats van inname (zoals bijvoorbeeld jeuk in de mond en keelirritatie) kunnen daarom verwacht worden tijdens de behandelperiode. Indien een patiënt een reactie op de plaats van inname ondervindt, kan symptomatische behandeling (bijv. met antihistaminica) worden overwogen.
Zoals bij elke allergeen immunotherapie, kunnen ernstige allergische reacties optreden waaronder ernstige laryngofaryngeale aandoeningen of systemische allergische reacties (d.w.z. acute ontwikkeling van een ziekte gekenmerkt door klachten van de huid, de slijmvliezen, of beide, ademhalingsproblemen, persistente gastrointestinale symptomen, of verminderde bloeddruk en/of geassocieerde symptomen). Informeer patiënten over de bijbehorende signalen en symptomen en laat hen onmiddellijk medische hulp zoeken en beëindig de behandeling, indien deze voorkomen. De behandeling dient alleen te worden hervat op aanwijzing van een arts.
Pediatrische patiënten
Over het algemeen is het veiligheidsprofiel bij kinderen vergelijkbaar met dat bij volwassenen. De volgende reacties genoemd in de samenvatting in tabelvorm werden door kinderen met een hogere incidentie gerapporteerd dan door volwassenen: hoest, nasofaryngitis, oedeem van de mond (zeer vaak), oraal allergie syndroom, cheilitis, glossitis, gevoel van brok in de keel, onaangenaam gevoel in het oor (vaak).
In aanvulling op de samenvatting in tabelvorm werden de volgende reacties door kinderen en jongeren die ORALAIR ontvingen gemeld: tonsilitis, bronchitis (vaak), pijn op de borst (soms).
Post-marketing
Verder zijn de volgende bijwerkingen gerapporteerd gedurende post-marketing onderzoek bij volwassenen, adolescenten en kinderen: astma exacerbatie, systemische allergische reactie, eosinofiele oesofagitis.
De frequentie van deze reacties bij behandeling met ORALAIR is niet bekend.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
Federaal agentschap voor geneesmiddelen en gezondheidsproducten
Afdeling Vigilantie
EUROSTATION II
Victor Hortaplein, 40/ 40
B-1060 Brussel
Website: www.fagg.be
e-mail: adversedrugreactions@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
STALLERGENES
6 rue Alexis de Tocqueville
92160 ANTONY
Frankrijk
Tel. 0033 (0) 1 55 59 20 00
Fax 0033 (0) 1 55 59 21 68
6 rue Alexis de Tocqueville
92160 ANTONY
Frankrijk
Tel. 0033 (0) 1 55 59 20 00
Fax 0033 (0) 1 55 59 21 68
8. NUMMERS VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
ORALAIR 100 IR & 300 IR: BE364515
ORALAIR 300 IR: BE364524
ORALAIR 300 IR: BE364524
10. DATUM VAN HERZIENING VAN DE TEKST
Goedkeuringsdatum: 06/2016
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2803898 | ORALAIR 300 IR COMP SUBL 90X300 IR | V01AA02 | € 258,01 | - | Ja | - | - |
| 2803922 | ORALAIR 100IR-300IR 3COMP SUBL 3X100 IR 28X300 IR | V01AA02 | € 92,8 | - | Ja | - | - |
| 2803948 | ORALAIR 300 IR COMP SUBL 30X300 IR | V01AA02 | € 92,8 | - | Ja | - | - |