SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Onglyza 2,5 mg, filmomhulde tabletten
Onglyza 5 mg, filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Onglyza 2,5 mg, filmomhulde tabletten
Iedere tablet bevat 2,5 mg saxagliptine (als hydrochloride).
Onglyza 5 mg, filmomhulde tabletten
Iedere tablet bevat 5 mg saxagliptine (als hydrochloride).
Hulpstof met bekend effect
Iedere tablet bevat 99 mg lactose (als monohydraat).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet (tablet).
Onglyza 2,5 mg, filmomhulde tabletten
Onglyza 2,5 mg tabletten zijn vaalgele tot lichtgele, biconvexe, ronde, filmomhulde tabletten, met hierop in blauwe inkt aan de ene kant “2.5” en aan de andere kant “4214” gedrukt.
Onglyza 5 mg, filmomhulde tabletten
Onglyza 5 mg tabletten zijn roze, biconvexe, ronde, filmomhulde tabletten, met hierop in blauwe inkt aan de ene kant een “5” en aan de andere kant “4215” gedrukt.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Onglyza is geïndiceerd bij volwassen patiënten met diabetes mellitus type 2 als aanvulling op dieet en lichaamsbeweging om de bloedglucoseregulatie te verbeteren:
- als monotherapie indien metformine niet geschikt is vanwege onverdraagbaarheid of contra-indicaties.
- in combinatie met andere geneesmiddelen voor de behandeling van diabetes, met inbegrip van insuline, wanneer deze geen adequate verbetering van de bloedglucoseregulatie geven (zie rubrieken 4.4, 4.5 en 5.1 voor beschikbare data aangaande de verschillende combinaties).
4.2 Dosering en wijze van toediening
Dosering
De aanbevolen dosering van Onglyza is 5 mg eenmaal daags. Wanneer Onglyza wordt gebruikt in combinatie met insuline of een sulfonylureumderivaat kan een lagere dosering insuline of sulfonylureumderivaat nodig zijn om het risico op hypoglykemie te verkleinen (zie rubriek 4.4).
De veiligheid en werkzaamheid van saxagliptine zijn niet vastgesteld in orale triple-therapie in combinatie met metformine en een thiazolidinedion.
Speciale populaties
Ouderen (≥ 65 jaar)
Er wordt geen dosisaanpassing aanbevolen alleen gebaseerd op leeftijd. (zie ook rubrieken 5.1 en 5.2).
Nierfunctiestoornissen
Er wordt geen dosisaanpassing aanbevolen voor patiënten met milde nierfunctiestoornissen of voor patiënten met matige nierfunctiestoornissen met GFR ≥ 45 ml/min.
Bij patiënten met matige nierfunctiestoornissen met GFR < 45 ml/min en bij patiënten met ernstige nierfunctiestoornissen dient de dosering te worden gereduceerd tot 2,5 mg eenmaal daags.
Het gebruik van Onglyza wordt niet aanbevolen bij patiënten met end-stage nierfalen (ESRD) waarbij hemodialyse is vereist (zie rubriek 4.4).
Omdat op basis van de nierfunctie de dosering moet worden beperkt tot 2,5 mg, wordt geadviseerd om voor aanvang van de therapie de nierfunctie te beoordelen. Hierna dient de nierfunctie, als onderdeel van routinematige zorg, periodiek te worden gecontroleerd (zie rubrieken 4.4 en 5.2).
Leverfunctiestoornissen
Er is geen dosisaanpassing noodzakelijk bij patiënten met milde of matige leverfunctiestoornissen (zie rubriek 5.2). Saxagliptine dient met voorzichtigheid te worden gebruikt bij patiënten met matige leverfunctiestoornissen en wordt niet aanbevolen voor gebruik bij patiënten met ernstige leverfunctiestoornissen (zie rubriek 4.4).
Pediatrische patiënten
De werkzaamheid van Onglyza bij kinderen in de leeftijd van 10 tot 18 jaar is nog niet vastgesteld. Daarom wordt behandeling van kinderen en adolescenten met saxagliptine niet aanbevolen. De huidige beschikbare gegevens worden in rubriek 5.1 en 5.2 beschreven. Onglyza is niet onderzocht bij kinderen jonger dan 10 jaar.
Wijze van toediening
De tabletten kunnen tijdens de maaltijd of tussen maaltijden door op elk moment van de dag worden ingenomen. De tabletten mogen niet worden gebroken of gedeeld.
Een vergeten dosis moet worden ingenomen zodra de patiënt eraan denkt. Een dubbele dosis mag niet op dezelfde dag worden ingenomen.
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen of een voorgeschiedenis van ernstige overgevoeligheid (waaronder anafylactische reactie, anafylactische shock en angio-oedeem) na gebruik van een dipeptidyl peptidase-4 (DPP-4)-remmer (zie rubrieken 4.4 en 4.8).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest gemelde bijwerkingen tijdens placebogecontroleerde klinische studies, gerapporteerd bij ≥ 5% van de patiënten die werden behandeld met Onglyza 5 mg en vaker dan bij patiënten die werden behandeld met placebo, zijn: luchtweginfectie (7,7%), urineweginfectie (6,8%) en hoofdpijn (6,5%).
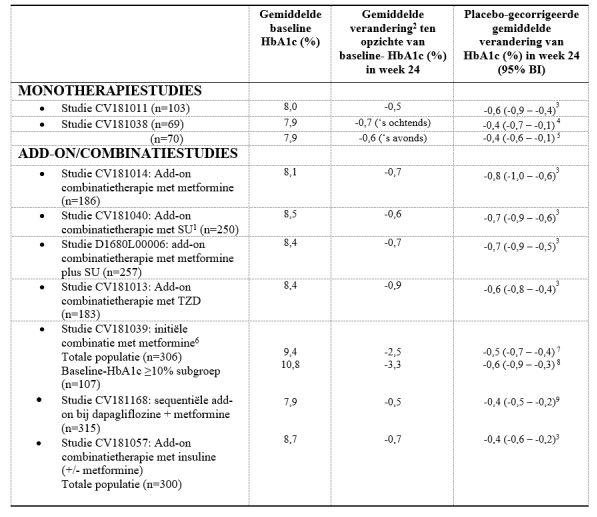
Er zijn 4.148 patiënten met diabetes type 2, waaronder 3.021 patiënten die zijn behandeld met Onglyza, gerandomiseerd in zes dubbelblinde, gecontroleerde klinische veiligheids‑ en werkzaamheidsstudies om het effect van saxagliptine op de bloedglucoseregulatie te evalueren. In gerandomiseerde, gecontroleerde, dubbelblinde klinische studies (inclusief ervaring opgedaan tijdens de ontwikkeling en postmarketing) werden meer dan 17.000 patiënten met diabetes type 2 behandeld met Onglyza.
In een gepoolde analyse van 1.681 patiënten met diabetes type 2, inclusief 882 patiënten die werden behandeld met Onglyza 5 mg, gerandomiseerd in vijf dubbelblinde, placebogecontroleerde klinische veiligheids- en werkzaamheidsstudies om het effect van saxagliptine op de bloedglucoseregulatie te evalueren, was de totale incidentie van bijwerkingen bij patiënten die met saxagliptine 5 mg werden behandeld vergelijkbaar met placebo. Het staken van de behandeling als gevolg van bijwerkingen vond vaker plaats bij patiënten die saxagliptine 5 mg kregen toegediend in vergelijking met placebo (3,3% vergeleken met 1,8%).
Bijwerkingen, weergegeven in tabelvorm
De bijwerkingen die gerapporteerd werden bij ≥ 5% van de patiënten die behandeld werden met saxagliptine 5 mg en die vaker voorkomen dan bij patiënten die behandeld werden met placebo of die werden gerapporteerd bij ≥ 2% van de patiënten die werden behandeld met saxagliptine 5 mg en ≥ 1% vaker in vergelijking met placebo tijdens de gepoolde analyse van vijf studies naar de glucoseregulatie, plus een aanvullende actief-gecontroleerde studie met de initiële combinatie met metformine, worden vermeld in tabel 1.
De bijwerkingen zijn gerangschikt op systeem/orgaanklasse en absolute frequentie. De frequenties worden gedefinieerd als zeer vaak ( 1/10), vaak ( 1/100, <1/10); soms ( 1/1.000, < 1/100); zelden ( 1/10.000, <1/1.000); zeer zelden (<1/10.000) of niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1 Frequentie van bijwerkingen per systeem/orgaanklasse uit klinische studies en postmarketingervaring
Systeem/orgaanklasse | Frequentie van bijwerkingen per behandelregime | ||||
| Saxagliptine monotherapie | Saxagliptine met metformine1 | Saxagliptine met een sulfonylureumderivaat (glibenclamide) | Saxagliptine met een thia-zolidinedion | Saxagliptine als add-on bij metformine plus een sulfonyl-ureumderivaat |
Infecties en parasitaire aandoeningen |
|
|
|
|
|
Bovenste luchtweginfectie | Vaak | Vaak | Vaak | Vaak |
|
Urineweginfectie | Vaak | Vaak | Vaak | Vaak |
|
Gastro-enteritis | Vaak | Vaak | Vaak | Vaak |
|
Sinusitis | Vaak | Vaak | Vaak | Vaak |
|
Nasofaryngitis |
| Vaak2 |
|
|
|
Immuunsysteem aandoeningen |
|
|
|
|
|
Overgevoeligheidsreacties †‡ | Soms | Soms | Soms | Soms |
|
Anafylactische reacties inclusief anafylactische shock †‡ | Zelden | Zelden | Zelden | Zelden |
|
Voedings‑ en stofwisselingsstoornissen |
|
|
|
|
|
Hypoglykemie |
|
| Zeer vaak3 |
|
|
Dyslipidemie |
|
| Soms |
|
|
Hypertriglyceridemie |
|
| Soms |
|
|
Zenuwstelselaandoeningen |
|
|
|
|
|
Duizeligheid | Vaak |
|
|
| Vaak |
Hoofdpijn | Vaak | Vaak | Vaak | Vaak |
|
Maagdarmstelselaandoeningen |
|
|
|
|
|
Abdominale pijn† | Vaak | Vaak | Vaak | Vaak |
|
Diarree4 | Vaak | Vaak | Vaak | Vaak |
|
Dyspepsie |
| Vaak |
|
|
|
Flatulentie |
|
|
|
| Vaak |
Gastritis |
| Vaak |
|
|
|
Misselijkheid† | Vaak | Vaak | Vaak | Vaak |
|
Braken | Vaak | Vaak | Vaak | Vaak |
|
Pancreatitis† | Soms | Soms | Soms | Soms |
|
Constipatie† | Niet bekend | Niet bekend | Niet bekend | Niet bekend | Niet bekend |
Huid- en onderhuid-aandoeningen |
|
|
|
|
|
Huiduitslag† | Vaak | Vaak | Vaak |
|
|
Dermatitis† | Soms | Soms | Soms | Soms |
|
Pruritus† | Soms | Soms | Soms | Soms |
|
Urticaria† | Soms | Soms | Soms | Soms |
|
Angio-oedeem†‡ | Zelden | Zelden | Zelden | Zelden |
|
Bulleus pemfigoïd† | Niet bekend | Niet bekend | Niet bekend | Niet bekend | Niet bekend |
Skeletspierstelsel- en bindweefsel-aandoeningen |
|
|
|
|
|
Artralgie* |
| Soms |
|
|
|
Myalgie5 |
| Vaak |
|
|
|
Voortplantingsstelsel- en borstaandoeningen |
|
|
|
|
|
Erectiele disfunctie |
| Soms |
|
|
|
Algemene aandoeningen en toedieningsplaats-stoornissen |
|
|
|
|
|
Vermoeidheid | Vaak |
| Soms |
| Vaak |
Perifeer oedeem |
|
|
| Vaak |
|
1 Met inbegrip van saxagliptine als add‑on combinatietherapie met metformine en initiële combinatietherapie met metformine
2 Alleen in de initiële combinatietherapie
3 Er was geen statistisch significant verschil vergeleken met placebo. De incidentie van bevestigde hypoglykemieën was ‘soms’ voor Onglyza 5 mg (0,8%) en placebo (0,7%).
4 De incidentie van diarree was 4,1% (36/882) in de saxagliptine 5mg groep en 6,1% (49/799) in de placebogroep.
5 Als initiële combinatietherapie met metformine werd myalgie gerapporteerd als ‘soms’.
† Bijwerkingen werden geïdentificeerd door postmarketingsurveillance
‡ Zie rubrieken 4.3 en 4.4
* Ook gemeld tijdens postmarketingsurveillance (zie rubriek 4.4).
Resultaten uit de SAVOR-studie
In de SAVOR-studie werden 8.240 patiënten behandeld met Onglyza 5 mg of 2,5 mg eenmaal daags en 8.173 patiënten met placebo. De totale incidentie van bijwerkingen bij patiënten die werden behandeld met Onglyza was in deze studie vergelijkbaar met placebo (respectievelijk 72,5% versus 72,2%).
De incidentie van gevallen van bevestigde pancreatitis was 0,3%, zowel bij patiënten die met Onglyza werden behandeld als bij patiënten die behandeld werden met placebo in de intent-to-treat populatie.
De incidentie van overgevoeligheidsreacties was 1,1%, zowel bij patiënten die met Onglyza werden behandeld als bij patiënten die met placebo behandeld werden.
De totale incidentie van gerapporteerde hypoglykemie (genoteerd in patiëntendagboeken) was 17,1% bij proefpersonen die met Onglyza werden behandeld en 14,8% bij patiënten die werden behandeld met placebo. Het percentage proefpersonen met gerapporteerde ernstige gevallen van hypoglykemie (gedefinieerd als een voorval waarbij assistentie van een andere persoon nodig was) tijdens de behandeling was groter in de saxagliptinegroep dan in de placebogroep (respectievelijk 2,1% en 1,6%). Het verhoogde risico op totale hypoglykemie en ernstige hypoglykemie dat werd waargenomen in de saxagliptine-behandelgroep trad voornamelijk op bij proefpersonen die werden behandeld met SU bij aanvang en niet bij proefpersonen die werden behandeld met insuline of metformine- monotherapie bij aanvang. Het verhoogde risico op totale hypoglykemie en ernstige hypoglykemie werd voornamelijk waargenomen bij patiënten met A1C < 7% bij aanvang.
Een verminderd aantal lymfocyten werd gerapporteerd bij 0,5% van de patiënten behandeld met Onglyza en bij 0,4% van de met placebo behandelde patiënten.
Ziekenhuisopname ten gevolge van hartfalen vond vaker plaats in de saxagliptinegroep (3,5%) ten opzichte van de placebogroep (2,8%), met nominale statistische significantie in het voordeel van placebo (HR = 1,27; 95% BI: 1,07; 1,51); P = 0,007. Zie ook rubriek 5.1.
Beschrijving van geselecteerde bijwerkingen
Hypoglykemie
Bijwerkingen van hypoglykemie zijn gebaseerd op alle meldingen van hypoglykemie; een meting van het glucosegehalte werd niet vereist.
Bij gebruik als add-on combinatietherapie met metformine plus een sulfonylureumderivaat was de totale incidentie van gerapporteerde hypoglykemie 10,1% voor Onglyza 5 mg en 6,3% voor placebo.
Bij gebruik als add-on combinatietherapie met insuline (met of zonder metformine) was de totale incidentie van gerapporteerde hypoglykemie 18,4% voor Onglyza 5 mg en 19,9% voor placebo.
Laboratoriumonderzoeken
De incidentie van bijwerkingen gerelateerd aan laboratoriumuitslagen was, over verschillende klinische studies gezien, vergelijkbaar voor patiënten die behandeld werden met saxagliptine 5 mg en patiënten die behandeld werden met placebo. Een kleine verlaging van het absolute aantal lymfocyten is waargenomen. Ten opzichte van het gemiddelde absolute aantal lymfocyten bij aanvang van ongeveer 2.200 cellen/μl is een gemiddelde verlaging van ongeveer 100 cellen/μl waargenomen in vergelijking met placebo in de placebo‑gecontroleerde gepoolde analyse. De gemiddelde absolute aantallen lymfocyten bleven stabiel bij dagelijkse dosering gedurende maximaal 102 weken. De afnames van het aantal lymfocyten werden niet in verband gebracht met klinisch relevante bijwerkingen. De klinische significantie van deze afname in het aantal lymfocyten ten opzichte van placebo is niet bekend.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
AstraZeneca AB
SE-151 85 Södertälje
Zweden
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Onglyza 2,5 mg, filmomhulde tabletten
EU/1/09/545/011 14 filmomhulde tabletten (kalenderblisterverpakking)
EU/1/09/545/012 28 filmomhulde tabletten (kalenderblisterverpakking)
EU/1/09/545/013 98 filmomhulde tabletten (kalenderblisterverpakking)
EU/1/09/545/014 30x1 filmomhulde tabletten (eenheidsblisterverpakking)
EU/1/09/545/015 90x1 filmomhulde tabletten (eenheidsblisterverpakking)
Onglyza 5 mg, filmomhulde tabletten
EU/1/09/545/001 14 filmomhulde tabletten
EU/1/09/545/002 28 filmomhulde tabletten
EU/1/09/545/003 56 filmomhulde tabletten
EU/1/09/545/004 98 filmomhulde tabletten
EU/1/09/545/005 14 filmomhulde tabletten (kalenderblisterverpakking)
EU/1/09/545/006 28 filmomhulde tabletten (kalenderblisterverpakking)
EU/1/09/545/007 56 filmomhulde tabletten (kalenderblisterverpakking)
EU/1/09/545/008 98 filmomhulde tabletten (kalenderblisterverpakking)
EU/1/09/545/009 30x1 filmomhulde tabletten (eenheidsblisterverpakking)
EU/1/09/545/010 90x1 filmomhulde tabletten (eenheidsblisterverpakking)
10. DATUM VAN HERZIENING VAN DE TEKST
04/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2677284 | ONGLYZA 5 MG FILMOMH TABL 28 X 5 MG | A10BH03 | € 48,19 | - | Ja | - | - |
| 2677326 | ONGLYZA 5 MG FILMOMH TABL 98 X 5 MG | A10BH03 | € 106,74 | - | Ja | - | - |
| 2806263 | ONGLYZA 2,5 MG FILMOMH TABL 28 X 2,5 MG | A10BH03 | € 49,37 | - | Ja | - | - |