1. NAAM VAN HET GENEESMIDDEL
FIRMAGON 80 mg poeder en oplosmiddel voor oplossing voor injectie
FIRMAGON 120 mg poeder en oplosmiddel voor oplossing voor injectie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
FIRMAGON 80 mg poeder en oplosmiddel voor oplossing voor injectie
Elke flacon bevat 80 mg degarelix (als acetaat). Na reconstitutie bevat elke ml oplossing 20 mg degarelix.
FIRMAGON 120 mg poeder en oplosmiddel voor oplossing voor injectie
Elke flacon bevat 120 mg degarelix (als acetaat). Na reconstitutie bevat elke ml oplossing 40 mg degarelix.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder en oplosmiddel voor oplossing voor injectie.
Poeder: wit tot gebroken wit poeder.
Oplosmiddel: heldere, kleurloze oplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
FIRMAGON is een gonadotrophin releasing hormone (GnRH)-antagonist en geïndiceerd:
- voor de behandeling van volwassen mannelijke patiënten met hormoonafhankelijke prostaatkanker in een vergevorderd stadium.
- voor de behandeling van hoog-risico gelokaliseerde en lokaal gevorderde hormoonafhankelijke prostaatkanker in combinatie met radiotherapie.
- als neo-adjuvante behandeling voorafgaand aan radiotherapie bij patiënten met hoog-risico gelokaliseerde of lokaal gevorderde hormoonafhankelijke prostaatkanker.
4.2 Dosering en wijze van toediening
Dosering
Aanvangsdosis | Onderhoudsdosis – maandelijkse toediening |
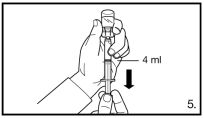
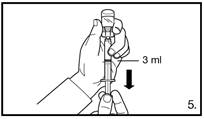
240 mg toe te dienen door middel van twee opeenvolgende subcutane injecties van elk 120 mg | 80 mg toe te dienen door middel van één subcutane injectie |
De eerste onderhoudsdosis dient één maand na de aanvangsdosis toegediend te worden.
FIRMAGON kan worden gebruikt als neo-adjuvante of adjuvante behandeling in combinatie met radiotherapie bij hoog-risico gelokaliseerde prostaatkanker en lokaal gevorderde prostaatkanker.
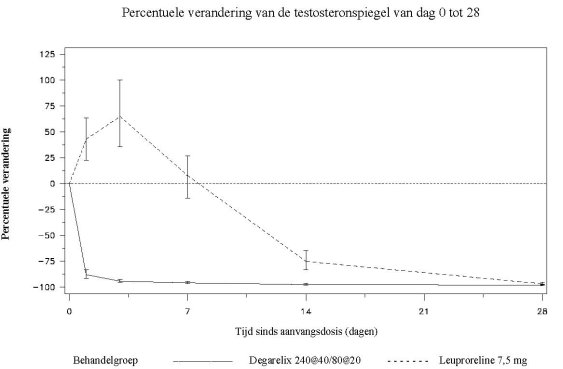
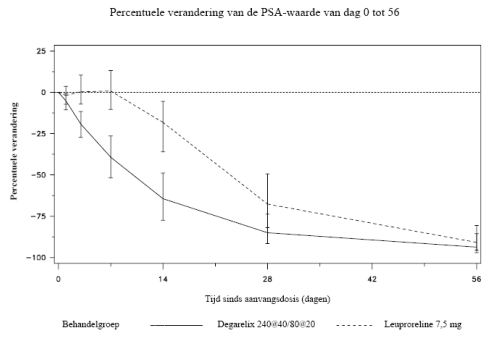
Het therapeutisch effect van degarelix dient gemonitord te worden op basis van klinische parameters en de serumspiegel van het prostaatspecifiek antigeen (PSA). Klinisch onderzoek heeft aangetoond dat er direct na toediening van de aanvangsdosis onderdrukking van testosteron (T) optreedt. Bij 96% van de patiënten is de serumtestosteronspiegel na drie dagen zodanig dat er sprake is van medische castratie (T ≤ 0,5 ng/ml). Na één maand is dit 100%. Bij langetermijnbehandeling met de onderhoudsdosering gedurende maximaal één jaar is gebleken dat de testosteronspiegel bij 97% van de patiënten laag blijft (T ≤ 0,5 ng/ml).
Indien de klinische respons van de patiënt suboptimaal is, dient bevestigd te worden dat de serumspiegels van testosteron voldoende onderdrukt worden.
Aangezien degarelix geen testosteronpieken veroorzaakt, is het niet nodig om bij aanvang van de behandeling een preventief anti-androgeen te gebruiken.
Speciale patiëntgroepen
Ouderen, lever- en nierpatiënten
Het is niet nodig de dosering aan te passen voor ouderen of voor patiënten met een lichte of matige lever- of nieraandoening (zie rubriek 5.2). Er is geen onderzoek verricht naar patiënten met ernstige lever- of nieraandoeningen. Bij deze patiënten is daarom voorzichtigheid geboden (zie rubriek 4.4).
Pediatrische patiënten
Er is geen relevante toepassing van FIRMAGON bij kinderen en adolescenten voor de behandeling van volwassen mannelijke patiënten met hormoonafhankelijke prostaatkanker in een vergevorderd stadium.
Wijze van toediening
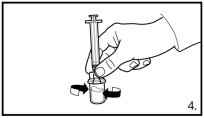
FIRMAGON dient vóór toediening te worden gereconstitueerd. Voor instructies over reconstitutie en toediening, zie rubriek 6.6.
FIRMAGON is UITSLUITEND voor subcutaan gebruik, niet voor intraveneuze toediening.
Intramusculaire toediening wordt niet aangeraden omdat daarnaar geen onderzoek is verricht.
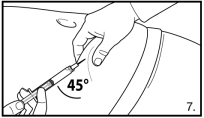
FIRMAGON wordt toegediend door middel van een subcutane injectie in de buikstreek. De plaats van injectie dient periodiek te variëren. De injecties dienen te worden toegediend op een plek waar de patiënt geen druk ervaart, bijvoorbeeld niet te dicht bij de tailleband of riem, en niet te dicht bij de ribben.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De meest voorkomende bijwerkingen tijdens de behandeling met degarelix die naar voren kwamen in het fase III-bevestigingsonderzoek (N = 409), waren te wijten aan de verwachte fysiologische effecten van de onderdrukking van testosteron, waaronder opvliegers, gewichtstoename (gemeld bij respectievelijk 25% en 7% van de patiënten die gedurende één jaar behandeld werden), of bijwerkingen op de plaats van injectie. Enkele uren na toediening werd melding gemaakt van voorbijgaande rillingen, koorts en griepachtige ziekte (bij respectievelijk 3%, 2% en 1% van de patiënten).
De gemelde bijwerkingen op de plaats van injectie waren met name pijn en erytheem, gemeld bij respectievelijk 28% en 17% van de patiënten. Minder vaak werd er melding gemaakt van zwelling (6%), plaatselijke verharding (4%) en knobbels (3%). Van deze bijwerkingen was vooral sprake bij de aanvangsdosis. Tijdens de onderhoudsbehandeling met de 80 mg dosis was de incidentie van deze bijwerkingen per 100 injecties: 3 voor pijn en < 1 voor erytheem, zwelling, knobbels en verharding. De gemelde bijwerkingen waren grotendeels tijdelijk, van lichte tot matige intensiteit en leidden nauwelijks tot het beëindigen van de behandeling (< 1%). Ernstige reacties op de plaats van injectie, zoals injectieplaatsinfectie, injectieplaatsabces of injectieplaatsnecrose waarvoor chirurgisch ingrijpen of drainage nodig kan zijn, zijn zeer zelden gemeld.
Bijwerkingentabel
De frequentie van onderstaande bijwerkingen is gemeten volgens de volgende conventie:
zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000) en zeer zelden (< 1/10.000). Binnen iedere frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Tabel 1: Frequentie van bijwerkingen zoals gerapporteerd bij 1259 patiënten behandeld gedurende een totaal van 1781 patiëntenjaren (fase II- en III-onderzoeken) en uit postmarketingrapportages
Systeem/orgaanklassen volgens MedDRA | Zeer vaak | Vaak | Soms | Zelden |
Bloed- en lymfestelsel-aandoeningen |
| anemie* |
| neutropene koorts |
Immuunsysteem-aandoeningen |
|
| overgevoeligheid | anafylactische reactie |
Voedings- en stofwisselingsstoornissen |
| gewichtstoename* | hyperglykemie/diabetes mellitus, verhoogd cholesterol, gewichtsafname, verminderde eetlust, veranderingen in bloedcalcium |
|
Psychische stoornissen |
| insomnia | depressie, verminderd libido* |
|
Zenuwstelselaandoeningen |
| duizeligheid, hoofdpijn | mentale stoornissen, hypo-esthesie |
|
Oogaandoeningen |
|
| troebel zicht |
|
Hartaandoeningen |
|
| hartritmestoornissen (incl. atriumfibrilleren), hartkloppingen, QT-verlenging* (zie rubrieken 4.4 en 4.5) | myocardinfarct, hartfalen |
Bloedvataandoeningen | opvliegers* |
| hypertensie, vasovagale reactie (incl. hypotensie) |
|
Ademhalingsstelsel-, borstkas- en mediastinum-aandoeningen |
|
| dyspneu |
|
Maagdarmstelsel-aandoeningen |
| diarree, misselijkheid | obstipatie, braken, buikpijn, buikklachten, droge mond |
|
Lever- en galaandoeningen |
| verhoogde levertransaminase | verhoogd bilirubine, verhoogd alkalisch fosfatase |
|
Huid- en onderhuid-aandoeningen |
| hyperhidrose (incl. nachtelijk zweten)*, uitslag | urticaria, huidknobbels, alopecia, pruritus, erytheem |
|
Skeletspierstelsel- en bindweefselaandoeningen |
| pijn en ongemak van het bewegingsapparaat | osteoporose/osteopenie, artralgie, spierzwakte, spierspasmen, zwelling/stijfheid van de gewrichten | rabdomyolyse |
Nier- en urineweg-aandoeningen |
|
| pollakisurie, mictiedrang, dysurie, nycturie, nierfunctiestoornissen, incontinentie |
|
Voortplantingsstelsel- en borstaandoeningen |
| gynaecomastie*, testiculaire atrofie*, impotentie* | testiculaire pijn, pijnlijke borsten, bekkenpijn, irritatie van de genitaliën, uitblijven van de ejaculatie |
|
Algemene aandoeningen en toedieningsplaats-stoornissen | bijwerkingen rond injectieplaats | rillingen, pyrexie, vermoeidheid*, griepachtige ziekte | malaise, perifeer oedeem |
|
* Bekende fysiologische gevolgen van testosterononderdrukking
Beschrijving van geselecteerde bijwerkingen
Veranderingen in laboratoriumparameters
Veranderingen in de laboratoriumwaarden die tijdens één behandeljaar tijdens het fase III bevestigingsonderzoek (N = 409) werden geconstateerd waren vergelijkbaar voor degarelix en een GnRH-agonist (leuproreline) die als comparator werd gebruikt. Bij 2 – 6% van de patiënten die vóór de behandeling normale waarden hadden en met beide geneesmiddelen behandeld zijn, werden aanzienlijk afwijkende levertransaminasewaarden (ALT, AST en GGT) geconstateerd (> 3*ULN). Een aanzienlijke afname werd na behandeling met beide geneesmiddelen geconstateerd in de hematologische waarden hematocriet (≤ 0,37) en hemoglobine (≤ 115 g/l) bij respectievelijk 40% en 13 – 15% van de patiënten die voorafgaand aan de behandeling normale waarden hadden. Het is onbekend in hoeverre deze afname van hematologische waarden veroorzaakt wordt door de onderliggende prostaatkanker en in hoeverre het een gevolg is van de androgeendeprivatietherapie. Bij respectievelijk 6%, 2% en 15% van met degarelix behandelde patiënten en respectievelijk 3%, 2% en 14% van de patiënten die met leuproreline waren behandeld, werden duidelijk afwijkende waarden van kalium (≥ 5,8 mmol/l), creatinine (≥ 177 μmol/l) en BUN (≥ 10,7 mmol/l) gezien bij patiënten die voorafgaand aan de behandeling normale waarden hadden.
Veranderingen in ECG metingen
Veranderingen in de ECG metingen die tijdens één behandeljaar tijdens het fase III-bevestigingsonderzoek (N = 409) werden geconstateerd waren vergelijkbaar voor degarelix en een GnRH-agonist (leuproreline) die als comparator werd gebruikt. Drie (< 1%) van de 409 patiënten in de degarelix groep en vier (2%) van 201 patiënten in de leuproreline 7,5 mg groep, hadden een QTcF ≥ 500 msec. Van het begin tot het eind van het onderzoek bedroeg de gemiddelde verandering van QTcF 12,0 msec voor degarelix en 16,7 msec voor leuproreline.
Het ontbreken van een intrinsiek effect van degarelix op cardiale repolarisatie (QTcF), hartslag, AV-geleiding, cardiale depolarisatie, of T of U golf morfologie is bevestigd in een gedetailleerd QT-onderzoek bij gezonde vrijwilligers (N = 80). Er werd gedurende 60 minuten een i.v. infuus met degarelix gegeven, waarbij een gemiddelde Cmax van 222 ng/ml werd bereikt, wat ongeveer 3-4 keer de Cmax is die tijdens behandeling van prostaatkanker wordt bereikt.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten, Afdeling Vigilantie
Galileelaan 5/03 | Postbus 97 |
website: www.eenbijwerkingmelden.be – e-mail: adr@fagg.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Ferring Pharmaceuticals A/S, Amager Strandvej 405, 2770 Kastrup, Denemarken
Tel: +45 88 33 88 34
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
FIRMAGON 80 mg poeder en oplosmiddel voor oplossing voor injectie
EU/1/08/504/001
EU/1/08/504/003
FIRMAGON 120 mg poeder en oplosmiddel voor oplossing voor injectie
EU/1/08/504/002
10. DATUM VAN HERZIENING VAN DE TEKST
03/2022.
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau (http://www.ema.europa.eu).
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2691202 | FIRMAGON 120 MG 2 FL INJ PULV + SER INJ SOL | L02BX02 | € 253,15 | - | Ja | - | - |