SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Brilique 90 mg, filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke filmomhulde tablet bevat 90 mg ticagrelor.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet (tablet).
Ronde, biconvexe, gele tabletten, aan één zijde gemarkeerd met ‘ 90’ boven ‘T’ en een effen andere zijde.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Brilique, in combinatie met acetylsalicylzuur (ASA) is geïndiceerd voor de preventie van atherotrombotische voorvallen bij volwassen patiënten met
- een acuut coronair syndroom (ACS) of
- een doorgemaakt myocardinfarct (MI) in de voorgeschiedenis en een hoog risico op het ontwikkelen van een atherotrombotisch voorval (zie rubriek 4.2 en 5.1).
4.2 Dosering en wijze van toediening
Dosering
Patiënten die Brilique gebruiken, dienen ook dagelijks een onderhoudsdosering van 75‑150 mg acetylsalicylzuur (ASA) te gebruiken, tenzij dit nadrukkelijk is gecontra-indiceerd.
Acuut coronair syndroom
De behandeling met Brilique dient gestart te worden met een eenmalige oplaaddosis van 180 mg (twee tabletten van 90 mg) en daarna te worden voortgezet met 90 mg, tweemaal daags. Bij patiënten met ACS wordt geadviseerd om de behandeling met Brilique 90 mg 12 maanden voort te zetten, tenzij een onderbreking van de therapie klinisch is geïndiceerd (zie rubriek 5.1).
Stoppen met ASA kan na 3 maanden worden overwogen bij patiënten met ACS die een percutane coronaire interventie (PCI) hebben ondergaan en een verhoogd risico op bloedingen hebben. In dat geval moet ticagrelor als enkelvoudige plaatjesaggregatieremmende behandeling gedurende 9 maanden worden voortgezet (zie rubriek 4.4).
Myocardinfarct in de voorgeschiedenis
Voor patiënten met een myocardinfarct in de voorgeschiedenis, ten minste 1 jaar geleden, en een hoog risico op een atherotrombotisch voorval (zie rubriek 5.1) is de aanbevolen dosering voor de voortgezette behandeling tweemaal daags 60 mg. De behandeling kan bij ACS-patiënten met een hoog risico op een atherotrombotisch voorval, zonder onderbrekingen worden gestart, direct volgend op de initiële behandeling van een jaar met Brilique 90 mg of een andere adenosinedifosfaat (ADP) receptorblokker. De behandeling mag ook worden gestart tot 2 jaar na het doorgemaakte myocardinfarct, of binnen 1 jaar nadat gestopt is met een eerdere behandeling met een ADP-receptorblokker. Er zijn beperkte gegevens beschikbaar over de werkzaamheid en veiligheid van ticagrelor wanneer de voortgezette behandeling langer duurt dan 3 jaar.
Wanneer het nodig is om een patiënt om te zetten naar Brilique dan dient de eerste dosis Brilique 24 uur na de laatste dosis van een andere plaatjesaggregatieremmer te worden toegediend.
Gemiste dosis
Onderbrekingen in de behandeling dienen vermeden te worden. Patiënten die een dosis Brilique zijn vergeten, dienen slechts één tablet (de volgende dosis) te nemen op het eerstvolgende vaste tijdstip.
Bijzondere patiëntengroepen
Ouderen
Er is geen aangepaste dosering nodig bij ouderen (zie rubriek 5.2).
Verminderde nierfunctie
Er is geen aangepaste dosering nodig bij patiënten met een verminderde nierfunctie (zie rubriek 5.2).
Verminderde leverfunctie
Ticagrelor is niet onderzocht bij patiënten met een ernstig verminderde leverfunctie en het gebruik is daarom gecontra-indiceerd bij deze patiënten (zie rubriek 4.3). De beschikbare informatie over het gebruik bij patiënten met een matig verminderde leverfunctie is beperkt. Een aanpassing van de dosering wordt niet aanbevolen, maar ticagrelor dient met voorzichtigheid te worden gebruikt (zie rubriek 4.4 en 5.2). Er is geen aangepaste dosering nodig bij patiënten met een licht verminderde leverfunctie (zie rubriek 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van ticagrelor zijn niet vastgesteld bij kinderen onder de 18 jaar. Er is geen relevant gebruik van ticagrelor bij kinderen met sikkelcelziekte (zie rubriek 5.1 en 5.2).
Wijze van toediening
Voor oraal gebruik. Brilique kan worden ingenomen met of zonder voedsel. Voor patiënten die de tablet(ten) niet in zijn (hun) geheel kunnen doorslikken, kunnen de tabletten verpulverd worden tot een fijn poeder. Dit poeder kan gemengd worden met een half glas water en moet direct worden opgedronken. Het glas moet gespoeld worden met nog een half glas water en de inhoud moet ook worden opgedronken. Het mengsel kan ook worden toegediend via een nasogastrische sonde (CH8 of groter). Het is belangrijk om de nasogastrische sonde na toediening van het mengsel door te spoelen met water.
4.3 Contra-indicaties
- Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstof(fen) (zie rubriek 4.8).
- Actieve pathologische bloedingen.
- Voorgeschiedenis van intracraniale bloedingen (zie rubriek 4.8).
- Ernstig verminderde leverfunctie (zie rubriek 4.2, 4.4 en 5.2).
- Gelijktijdig gebruik van ticagrelor met sterke CYP3A4 remmers (zoals bijv. ketoconazol, clarithromycine, nefazodon, ritonavir en atazanavir). Gelijktijdig gebruik kan leiden tot een aanmerkelijk verhoogde blootstelling aan ticagrelor (zie rubriek 4.5).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Het veiligheidsprofiel van ticagrelor is onderzocht in twee grote fase 3 eindpuntstudies (PLATO en PEGASUS) waarin meer dan 39000 patiënten werden ingesloten (zie rubriek 5.1).
In de PLATO studie stopten patiënten die ticagrelor kregen vaker als gevolg van bijwerkingen dan patiënten die clopidogrel kregen (7,4% vs 5,4%). In de PEGASUS studie stopten patiënten die ticagrelor kregen vaker als gevolg van bijwerkingen dan patiënten die alleen werden behandeld met ASA (16,1% voor ticagrelor 60 mg met ASA vs 8,5% voor behandeling met alleen ASA). De meest frequent gemelde bijwerkingen bij patiënten die werden behandeld met ticagrelor waren bloedingen en dyspneu (zie rubriek 4.4).
Bijwerkingen in tabel
De volgende bijwerkingen werden waargenomen met ticagrelor na studies of zijn gemeld na het in de handel brengen (tabel 1).
De bijwerkingen worden weergegeven op basis van MedDRA systeem orgaan klasse (SOK). Binnen iedere SOK worden de bijwerkingen gerangschikt op basis van frequentie en weergegeven in volgorde van afnemende ernst. De frequenties zijn als volgt gedefinieerd: zeer vaak (≥1/10), vaak (≥1/100 tot <1/10), soms (≥1/1000 tot <1/100), zelden (≥1/10.000 tot <1/1000), zeer zelden (<1/10.000), niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 1 – Bijwerkingen gerangschikt naar frequentie en Systeem Orgaan Klasse (SOK).
SOK | Zeer vaak | Vaak | Soms | Onbekend |
Neoplasmata, benigne, maligne en niet-gespecificeerd (inclusief cysten en poliepen) |
|
| Tumorbloedingen a |
|
Bloed- en lymfestelsel aandoeningen | Bloedaandoening bloedingenb |
|
| Trombotische trombocyto-penische purpurac |
Immuunsysteem- aandoeningen |
|
| Overgevoeligheid inclusief angio-oedeem c |
|
Voedings en stofwisselingsstoor-nissen | Hyperurikemied | Jicht / artritis |
|
|
Psychische stoornissen |
|
| Verwardheid |
|
Zenuwstelsel aandoeningen |
| Duizeligheid, Syncope, Hoofdpijn | Intracraniale bloedingm |
|
Oogaandoeningen |
|
| Oogbloedinge |
|
Evenwichtsorgaan- en ooraandoeningen |
| Vertigo | Oorbloeding |
|
Hartaandoeningen |
|
|
| Bradyaritmie, AV-blokc |
Bloedvat-aandoeningen |
| Hypotensie |
|
|
Ademhalingsstelsel-, borstkas- en mediastinum- aandoeningen | Dyspneu | Ademhalingsy-steem bloedingenf |
|
|
Maagdarmstelsel-aandoeningen |
| Gastro-intestinale bloedingg, | Retroperitoneale bloeding |
|
Huid- en onderhuid-aandoeningen |
| Dermale of onderhuidse bloeding h, Uitslag, Jeuk |
|
|
Skeletspierstelsel- en bindweefsel- aandoeningen |
|
| Spierbloedingeni |
|
Nier en urineweg-aandoeningen |
| Urinewegbloe-dingenj |
|
|
Voortplantingsstelsel en borstaandoeningen |
|
| Voortplantingsstel-sel bloedingenk |
|
Onderzoeken |
| Verhoogd creatinine in bloed d |
|
|
Letsels, intoxicaties en verrichtingscomplicaties |
| Postprocedurele bloeding, traumabloedingl |
|
|
a e.g. bloeding van blaaskanker, maagkanker, darmkanker
b e.g. verhoogde neiging tot kneuzen, spontane hematomen, haemorrhagische diathesis
c Geïdentificeerd tijdens post-marketing ervaring
d Frequenties afgeleid uit lab waarnemingen (Urinezuur verhogingen tot > boven limiet van normaal ten opzichte van de baseline er onder of binnen het referentiebereik. Creatinine verhogingen > 50% ten opzichte van baseline). en niet de onbewerkte frequentie van bijwerkingenrapportage.
e e.g. conjunctivale, retina, intraoculaire bloeding
f e.g. epistaxis, hemoptoë
g e.g. gingivale bloeding, rectale bloeding, maagulcer bloeding
h e.g. ecchymosis, huidbloeding, petechiae
i e.g. hemartrose, hematomen
j e.g. hematurie, cyste bloeding
k e.g. vaginaal bloedverlies, hematospermie, postmenopauzaal bloedverlies
l e.g. kneuzing, trauma hematomen, trauma bloeding
m i.e. spontane, procedurele of traumatische intracraniale bloeding
Beschrijving van geselecteerde bijwerkingen
Bloedingen
PLATO resultaten m.b.t. bloedingen
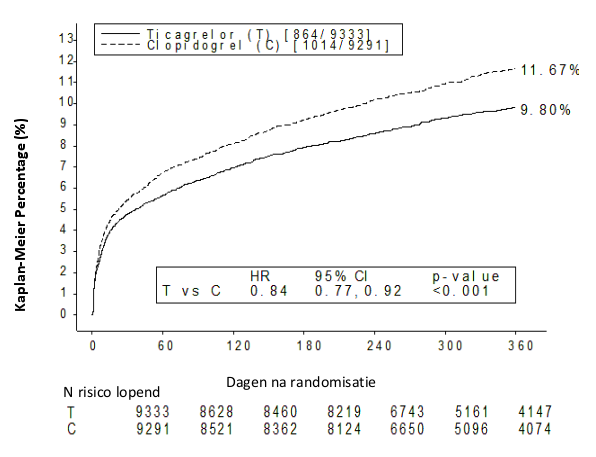
In tabel 2 wordt het totaal overzicht van het aantal bloedingen, waargenomen tijdens de PLATO studie weergegeven.
Tabel 2- Analyse van het totaal overzicht van het aantal bloedingen, Kaplan-Meier inschatting na 12 maanden (PLATO)
| Ticagrelor 90 mg tweemaal daags | Clopidogrel | |
PLATO Total Major | | | |
PLATO Major Fatal/life-threatening | 5,8 | | 0,6988 |
Non-CABG PLATO Major | 4,5 | 3,8 | 0,0264 |
Non-Procedural PLATO Major | 3,1 | 2,3 | 0,0058 |
| | | |
Non-Procedural PLATO Major + Minor | | | |
TIMI-defined Major | 7,9 | 7,7 | 0,5669 |
TIMI-defined Major + Minor | | | |
Bloedingscategorie definities:
Major Fatal/life-threathening: Klinisch waargenomen met >50 g/L afname van het hemoglobine of ≥ 4 eenheden rode bloedcellen transfusie gegeven; of fataal; of intracraniaal; of intrapericardiaal met harttamponnade; of met hypovolemische shock of ernstige hypotensie waarbij toediening van vasopressoren of chirurgie noodzakelijk is.
Major Other: Klinisch waargenomen met 30‑50 g/L afname van het hemoglobine of 2‑3 eenheden rode bloedcellen transfusie gegeven of ernstig invaliderend.
Minor Bleed: Vereist medische interventie om de bloeding te stoppen of te behandelen.
TIMI Major Bleed: Klinisch waargenomen met > 50 g/L afname van het hemoglobine of intracraniale bloeding.
TIMI Minor Bleed: Klinisch waargenomen met 30‑50 g/L afname van het hemoglobine.
* p-waarde berekend uitgaande van Cox proportional hazards model met de behandelgroep als de enige verklarende variabele
Er werd geen verschil waargenomen tussen ticagrelor en clopidogrel in het aantal ‘PLATO Major Fatal/Life-Threatening’, ‘PLATO Total Major’, ‘TIMI Major’ en ‘TIMI Minor’ bloedingen (zie Tabel 2). Echter, er werden meer ‘PLATO combined Major + Minor’ bloedingen waargenomen bij ticagrelor dan bij clopidogrel. Tijdens de PLATO studie ondervond een klein aantal patiënten een fatale bloeding: 20 (0,2 %) op ticagrelor en 23 (0,3%) op clopidogrel (zie rubriek 4.4).
Leeftijd, geslacht, gewicht, ras, geografische oorsprong, gelijktijdig optredende factoren, bijkomende therapieën en medische voorgeschiedenis (inclusief een eerdere beroerte of transiënte ischemische aanval) werden onderzocht. Geen van deze parameters had een voorspellende waarde voor het totaal aantal, of het aantal ‘Non-Procedural PLATO Major’ bloedingen. Er werd geen uitgesproken risicogroep vastgesteld voor enige subcategorie bloedingen.
CABG-gerelateerde bloedingen:
Tijdens de PLATO studie werd bij 42% van de 1584 patiënten (12% van het cohort) die een ‘coronary artery bypass graft’ (CABG) ondergingen, een ‘PLATO Major Fatal/Life-Threatening’ bloeding waargenomen. Er werd geen verschil in frequentie waargenomen tussen de twee patiëntengroepen. Een fatale CABG-gerelateerde bloeding vond plaats bij 6 patiënten in iedere behandelgroep (zie rubriek 4.4).
Niet-CABG-gerelateerde en niet-procedure gerelateerde bloedingen:
Er werd geen verschil waargenomen tussen ticagrelor en clopidogrel qua aantal niet-CABG gerelateerde PLATO-gedefinieerde ‘Major Fatal/Life-Threatening’ bloedingen. Echter, PLATO-gedefinieerde ‘Total Major’, ‘TIMI Major’ en ‘TIMI Major + Minor’ bloedingen werden vaker waargenomen bij ticagrelor. Wanneer procedure gerelateerde bloedingen buiten beschouwing worden gelaten, werden voor ticagrelor meer bloedingen waargenomen dan voor clopidogrel (zie Tabel 2). De behandeling met ticagrelor werd vaker gestaakt (2.9%) als gevolg van een niet-procedure gerelateerde bloeding dan de behandeling met clopidogrel (1.2%; p< 0.001).
Intracraniale bloedingen:
Er werden meer intracraniale, niet-procedure gerelateerde bloedingen waargenomen bij ticagrelor (n=27 bloedingen bij 26 patiënten, 0.3 %) dan bij clopidogrel (n=14 bloedingen, 0.2%), hiervan waren 11 bloedingen bij ticagrelor en 1 bloeding bij clopidogrel fataal. Er werd geen verschil waargenomen in het totaal aantal fatale bloedingen.
PEGASUS resultaten m.b.t. bloedingen
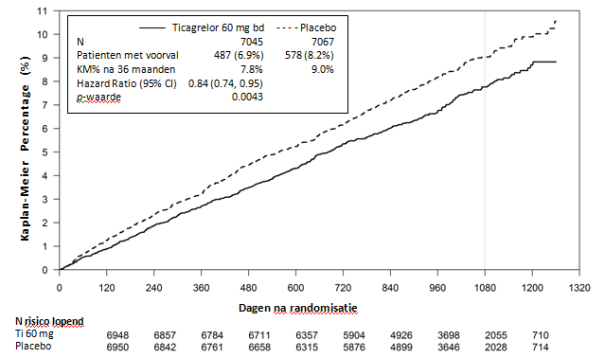
In tabel 3 wordt het totaal overzicht van het aantal bloedingen, waargenomen tijdens de PEGASUS studie weergegeven.
Tabel 3- Analyse van het totaal overzicht van het aantal bloedingen, Kaplan-Meier inschatting na 36 maanden (PEGASUS)
| Ticagrelor 60 mg tweemaal daags + ASA | Alleen ASA | | |
Eindpunten op veiligheid | KM % | Hazard Ratio (95% CI) | KM % | p-waarde |
TIMI gedefinieerde bloedingscategorieën | ||||
´TIMI Major´ | 2,3 | 2,32 | 1,1 | <0,0001 |
´Fatal´ | 0,3 | 1,00 | 0,3 | 1,0000 |
´ICH´ | 0,6 | 1,33 | 0,5 | 0,3130 |
´Other TIMI Major´ | 1,6 | 3,61 | 0,5 | <0,0001 |
´TIMI Major or Minor´ | 3,4 | 2,54 | 1,4 | <0,0001 |
´TIMI Major or Minor or requiring medical attention´ | 16,6 | 2,64 | 7,0 | <0,0001 |
|
|
|
|
|
PLATO gedefinieerde bloedingscategorieën | ||||
´PLATO Major´ | 3,5 | 2,57 | 1,4 | <0,0001 |
´Fatal-Life/threatening´ | 2,4 | 2,38 | 1,1 | <0,0001 |
´Other PLATO Major´ | 1,1 | 3,37 | 0,3 | <0,0001 |
´PLATO Major or Minor´ | 15,2 | 2,71 | 6,2 | <0,0001 |
Bloedingscategorie definities:
TIMI Major: Fatale bloeding, OF iedere intracraniale bloeding, OF klinisch openlijk waargenomen signalen van een bloeding met een afname van het hemoglobine (Hgb) van ≥ 50 g/l of indien Hgb niet beschikbaar een daling van het hematocriet (Hct) van 15%.
Fatal: Een bloedingsvoorval dat direct heeft geleid tot overlijden binnen 7 dagen.
ICH: Intracraniale bloeding.
Other TIMI Major: Niet-fatale, niet-ICH, TIMI Major bloeding.
TIMI Minor: Klinisch waargenomen met 30‑50 g/l afname van het hemoglobine.
TIMI Requiring medical attention: Vereist medische interventie, OF leidend tot hospitalisatie, OF lokt evaluatie uit.
PLATO Major Fatal/life-threathening: Fatale bloeding, OF iedere intracraniale bloeding, OF intrapericardiaal met harttamponnade, OF met hypovolemische shock of ernstige hypotensie waarbij toediening van vasopressoren of chirurgie noodzakelijk is, OF klinisch waargenomen met >50 g/l afname van het hemoglobine of ≥ 4 eenheden rode bloedcellen transfusie gegeven.
PLATO Major Other: Ernstig invaliderend, OF klinisch waargenomen met 30‑50 g/l afname van het hemoglobine of 2‑3 eenheden rode bloedcellen transfusie gegeven.
PLATO Minor: Vereist medische interventie om de bloeding te stoppen of te behandelen.
Tijdens de PEGASUS studie werden vaker TIMI Major bloedingen waargenomen bij ticagrelor 60 mg tweemaal daags dan bij alleen ASA. Er werd geen verhoogd risico waargenomen voor fatale bloedingen en er werd alleen een kleine toename waargenomen in intracraniale bloedingen ten opzichte van een behandeling met alleen ASA. Er waren weinig voorvallen van fatale bloedingen tijdens de studie; 11 (0,3%) voor ticagrelor 60 mg tweemaal daags en 12 (0,3%) voor alleen ASA therapie. Het waargenomen verhoogde risico van TIMI Major bloedingen bij ticagrelor 60 mg werd hoofdzakelijk veroorzaakt door een hogere frequentie van Other TIMI Major bloedingen, veroorzaakt door voorvallen in de gastro-intestinale SOK.
Verhoogde patronen van bloedingen, vergelijkbaar met TIMI Major werden waargenomen voor de categorieën TIMI Major or Minor, PLATO Major en PLATO Major or Minor (zie tabel 3). Er werd vaker gestopt met de behandeling als gevolg van bloedingen bij ticagrelor 60 mg dan bij een therapie met alleen ASA (respectievelijk 6,2% en 1,5%). Het grootste gedeelte van deze bloedingen was van een minder ernstige categorie (geclassificeerd als TIMI Requiring medical attention), bijvoorbeeld epistaxis, blauwe plekken en hematomen.
Het bloedingprofiel van ticagrelor 60 mg was consistent over meerdere vooraf-gedefinieerde subgroepen (bijvoorbeeld per leeftijd, geslacht, gewicht, ras, geografische regio, gelijktijdige aandoeningen, gelijktijdige therapie en medische geschiedenis) voor TIMI Major, TIMI Major or Minor en PLATO Major bloedingen.
Intracraniale bloeding:
Spontane intracraniale bloedingen werden gerapporteerd met vergelijkbare incidenties voor ticagrelor 60 mg en een therapie met alleen ASA (n=13; 0,2% in beide behandelgroepen). Trauma- en procedurele intracraniale bloedingen waren licht verhoogd bij de behandeling met ticagrelor 60 mg (n=15; 0,2%) ten opzichte van een therapie met alleen ASA (n=10; 0,1%). Er waren zes fatale intracraniale bloedingen met ticagrelor 60 mg en vijf fatale intracraniale bloedingen met alleen ASA behandeling. De incidentie van intracraniale bloedingen was laag in beide behandelgroepen, gezien de significante co-morbiditeit en cardiovasculaire risicofactoren van de bestudeerde studiepopulatie.
Dyspneu
Dyspneu, kortademigheid, is gemeld door patiënten die werden behandeld met ticagrelor. Wanneer alle dyspnoïsche bijwerkingen tijdens de PLATO studie gecombineerd worden (dyspneu, dyspneu bij rust, dyspneu bij inspanning, paradoxale nachtelijke dyspneu, nachtelijke dyspneu) werden deze gerapporteerd bij 13,8 % van de Brilique patiënten, versus 7,8 % van de clopidogrel patiënten. Bij 2,2% van de ticagrelor patiënten en bij 0,6% van de clopidogrel patiënten werden deze bijwerkingen causaal geacht door de onderzoekers en een klein aantal waren ernstig (0,14% ticagrelor; 0,02% clopidogrel), (zie rubriek 4.4). De meest frequent gerapporteerde dyspneu symptomen waren licht tot matig van intensiteit en de meeste werden gerapporteerd als een enkele episode, kort na aanvang van de therapie.
In vergelijking met clopidogrel, hebben astma/COPD patiënten die worden behandeld met ticagrelor mogelijk een verhoogd risico op het ontwikkelen van niet-ernstige dyspneu (3,29% ticagrelor versus 0,53% clopidogrel) en van ernstige dyspneu (0,38% ticagrelor versus 0,00% clopidogrel). In absolute getallen is het risico groter dan voor de totale PLATO populatie. Ticagrelor dient met voorzichtigheid te worden gebruikt bij patiënten met een voorgeschiedenis van astma of COPD (zie rubriek 4.4).
Ongeveer 30 % van alle dyspneu episodes waren binnen 7 dagen verdwenen. Voor de PLATO studie werden onder andere patiënten geïncludeerd met een baseline congestieve hartinsufficiëntie, COPD of astma en deze patiëntengroep, evenals oudere patiënten, hebben een grotere waarschijnlijkheid om dyspneu te rapporteren. In 0,9 % van de ticagrelor patiënten werd de behandeling gestaakt vanwege dyspneu, versus 0,1 % van de clopidogrel patiënten. De verhoogde incidentie van dyspneu bij ticagrelor wordt niet in verband gebracht met een nieuwe of verslechterende hart- of longziekte (zie rubriek 4.4). Ticagrelor heeft geen invloed op longfunctietests.
Tijdens de PEGASUS studie werd dyspneu gerapporteerd bij 14,2% van de patiënten die tweemaal daags ticagrelor 60 mg kregen en bij 5,5% van de patiënten die alleen ASA kregen. Overeenkomstig met de gegevens uit de PLATO studie, was de gerapporteerde dyspneu meestal licht tot matig in intensiteit (zie rubriek 4.4). Patiënten die dyspneu rapporteerden waren over het algemeen ouder en hadden vaker dyspneu, COPD of astma tijdens de start van de onderzoeken.
Onderzoeken
Verhoogd urinezuur: Tijdens de PLATO studie werd bij 22% van de patiënten in de ticagrelor groep een verhoogd urinezuurgehalte aangetoond in het serum, versus 13% van de patiënten in de clopidogrelgroep. De overeenkomstige percentages tijdens de PEGASUS studie waren 9,1%, 8,8% en 5,5% voor respectievelijk ticagrelor 90 mg, ticagrelor 60 mg en placebo. Het gemiddelde serum urinezuurgehalte nam toe met circa 15 % bij ticagrelor, versus circa 7,5% bij clopidogrel. Na het staken van de behandeling nam deze verhoging af tot circa 7% bij ticagrelor, echter bij clopidogrel werd geen afname waargenomen. Tijdens de PEGASUS studie werd een reversibele toename van het gemiddelde urinezuurgehalte in het serum gevonden van 6,3% en 5,6% voor respectievelijk ticagrelor 90 mg en ticagrelor 60 mg versus een afname van 1,5% in de placebogroep. Tijdens de PLATO studie was de frequentie van de bijwerking jicht 0,2% voor ticagrelor versus 0,1% voor clopidogrel. De overeenkomstige percentages voor jicht tijdens de PEGASUS studie waren 1,6%, 1,5% en 1,1% voor respectievelijk ticagrelor 90 mg, ticagrelor 60 mg en placebo.
Melden van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
AstraZeneca AB
SE-151 85
Södertälje
Zweden
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/10/655/001‑006
10. DATUM VAN HERZIENING VAN DE TEKST
09/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2789691 | BRILIQUE 90MG FILMOMH TABL 56 X 90MG | B01AC24 | € 51,75 | - | Ja | - | - |
| 2789717 | BRILIQUE 90MG FILMOMH TABL 168 X 90MG | B01AC24 | € 140 | - | Ja | - | - |