1. NAAM VAN HET GENEESMIDDEL
Victoza 6 mg/ml oplossing voor injectie in een voorgevulde pen
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
1 ml oplossing bevat 6 mg liraglutide*. Een voorgevulde pen bevat 18 mg liraglutide in 3 ml.
* humaan glucagon-achtig peptide-1 (GLP-1)-analoog, geproduceerd met behulp van recombinant-DNA-technologie in Saccharomyces cerevisiae.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie.
Heldere en kleurloze of nagenoeg kleurloze, isotone oplossing; pH=8,15.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Victoza is geïndiceerd voor de behandeling van volwassenen, adolescenten en kinderen van 10 jaar en ouder met onvoldoende gereguleerde diabetes mellitus type 2 als toevoeging aan dieet en lichaamsbeweging
• als monotherapie wanneer metformine ongeschikt wordt geacht als gevolg van intolerantie of contra-indicaties
• als aanvulling op andere geneesmiddelen voor de behandeling van diabetes.
Voor studieresultaten met betrekking tot combinaties, werkzaamheid op glykemische controle en cardiovasculaire events, en de onderzochte populaties, zie rubriek 4.4, 4.5 en 5.1.
4.2 Dosering en wijze van toediening
Dosering
Ter verbetering van de gastro-intestinale verdraagbaarheid is de startdosering 0,6 mg liraglutide per dag. Na ten minste één week moet de dosering worden verhoogd naar 1,2 mg. Enkele patiënten hebben naar verwachting baat bij een verhoging van de dosering van 1,2 mg naar 1,8 mg en op basis van klinische respons kan de dosering, na ten minste één week, worden verhoogd naar 1,8 mg om de glykemische controle verder te verbeteren. Doseringen hoger dan 1,8 mg per dag worden niet aanbevolen.
Als Victoza wordt toegevoegd aan een sulfonylureumderivaat of insuline, moet een verlaging van de dosis sulfonylureumderivaat of insuline worden overwogen om het risico op hypoglykemie te verlagen (zie rubriek 4.4). Combinatietherapie met sulfonylureumderivaat is alleen toepasbaar bij volwassen patiënten.
Zelfcontrole van bloedglucosewaarden is niet nodig om de dosering van Victoza aan te passen. Zelfcontrole van de bloedglucose is nodig om de dosis van het sulfonylureumderivaat of de insuline aan te passen, met name wanneer de behandeling met Victoza is gestart en de dosis insuline is verlaagd. Een stapsgewijze benadering van de verlaging van de insulinedosis wordt aanbevolen.
Specifieke doelgroepen
Oudere patiënten (> 65 jaar)
Er is geen dosisaanpassing nodig op basis van leeftijd (zie rubriek 5.2).
Nierinsufficiëntie
Er is geen dosisaanpassing nodig bij patiënten met lichte, matig ernstige of ernstige nierinsufficiëntie. Er is geen therapeutische ervaring bij patiënten met End stage-nierziekte (ESRD) en Victoza wordt daarom niet aanbevolen voor gebruik bij deze patiënten (zie rubriek 5.1 en 5.2).
Leverinsufficiëntie
Er wordt geen dosisaanpassing aanbevolen bij patiënten met lichte of matig ernstige leverinsufficiëntie. Victoza wordt niet aanbevolen voor gebruik bij patiënten met ernstige leverinsufficiëntie (zie rubriek 5.2).
Pediatrische patiënten
Er is geen dosisaanpassing nodig bij adolescenten en kinderen van 10 jaar en ouder. Er zijn geen gegevens beschikbaar voor kinderen jonger dan 10 jaar (zie rubriek 5.1 en 5.2).
Wijze van toediening
Victoza mag niet intraveneus of intramusculair worden toegediend.
Victoza wordt eenmaal daags toegediend op een willekeurig tijdstip, onafhankelijk van de maaltijden, en kan subcutaan in de buik, de dij of de bovenarm worden geïnjecteerd. De injectieplaats en het injectietijdstip kunnen zonder aanpassing van de dosis worden gewijzigd. Victoza moet echter bij voorkeur elke dag rond hetzelfde tijdstip worden geïnjecteerd, wanneer het meest geschikte tijdstip is gekozen. De injectieplaatsen dienen altijd te worden afgewisseld om de kans op amyloïdafzettingen op de injectieplaats te verminderen (zie rubriek 4.8). Zie rubriek 6.6 voor verdere instructies voor de toediening.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
In vijf grote klinische fase 3a-langetermijnstudies zijn meer dan 2.500 volwassen patiënten behandeld met alleen Victoza of met Victoza in combinatie met metformine, een sulfonylureumderivaat (met of zonder metformine) of metformine plus rosiglitazon.
De meest frequent gemelde bijwerkingen tijdens klinisch onderzoek waren aandoeningen van het gastro-intestinale systeem: misselijkheid en diarree kwamen zeer vaak voor, terwijl braken, obstipatie, abdominale pijn en dyspepsie vaak voorkwamen. Bij het begin van de behandeling kunnen deze gastro-intestinale bijwerkingen frequenter voorkomen. Bij voortzetting van de behandeling nemen deze bijwerkingen gewoonlijk binnen enkele dagen of weken af. Hoofdpijn en rinofaryngitis kwamen ook vaak voor. Daarnaast kwam hypoglykemie vaak voor, en zeer vaak als liraglutide wordt gebruikt in combinatie met een sulfonylureumderivaat. Ernstige hypoglykemie is voornamelijk waargenomen bij de combinatie met een sulfonylureumderivaat.
Tabel met een lijst van de bijwerkingen
In tabel 1 staan de bijwerkingen die zijn gemeld tijdens gecontroleerde fase 3a-langetermijnstudies, de LEADER-studie (een langetermijn cardiovasculaire uitkomstenstudie) en uit spontane meldingen (na het in de handel brengen).
Frequenties voor alle bijwerkingen zijn berekend op basis van hun incidentie in klinische fase 3a-studies.
Frequenties zijn gedefinieerd als: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000); niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen iedere frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Tabel 1 Bijwerkingen uit gecontroleerde fase 3a-langetermijnstudies, de langetermijn cardiovasculaire uitkomstenstudie (LEADER) en spontane meldingen (na het in de handel brengen)
MedDRA systeem/orgaanklasse | Zeer vaak | Vaak | Soms | Zelden | Zeer zelden | Niet bekend |
Infecties en parasitaire aandoeningen |
| Rinofaryngitis |
|
|
|
|
Immuunsysteem-aandoeningen |
|
|
| Anafylac-tische reacties |
|
|
Voedings- en stofwisselings-stoornissen |
| Hypoglykemie | Dehydratie |
|
|
|
Zenuwstelsel-aandoeningen |
| Hoofdpijn | Dysgeusie |
|
|
|
Hartaandoeningen |
| Verhoogde hartslag |
|
|
|
|
Maagdarmstelsel-aandoeningen | Misselijk-heid | Braken | Vertraagde maagledi-ging | Darm-obstructie | Pancreatitis (inclusief necrotiseren-de pancreatitis) |
|
Lever- en galaandoeningen |
|
| Cholelithiase |
|
|
|
Huid- en |
| Rash | Urticaria |
|
| huidamy-loïdose |
Nier- en |
|
| Nier-insufficiëntie |
|
|
|
Algemene aandoeningen en toedieningsplaats-stoornissen |
| Moeheid | Malaise |
|
|
|
Onderzoeken |
| Verhoogde lipase* |
|
|
|
|
* Uit gecontroleerde fase 3b- en 4-klinische studies alleen wanneer deze werden gemeten.
Beschrijving van een geselecteerd aantal bijwerkingen
In een klinische studie met liraglutide als monotherapie werd hypoglykemie minder gemeld bij liraglutide dan bij patiënten die werden behandeld met de actieve comparator (glimepiride). De meest frequent gemelde bijwerkingen waren maagdarmstelselaandoeningen, infecties en parasitaire aandoeningen.
Hypoglykemie
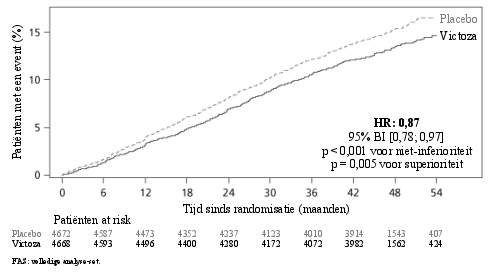
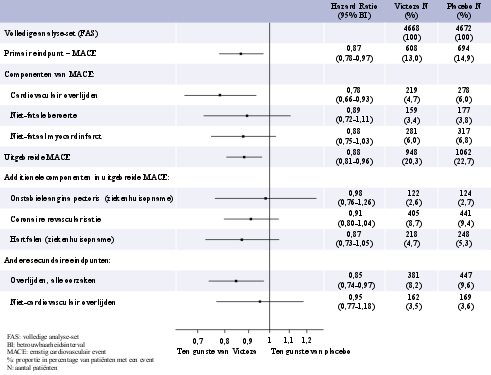
De meeste episoden van bevestigde hypoglykemie tijdens klinische studies waren mild. Er werden geen episoden van ernstige hypoglykemie waargenomen in het onderzoek waarin liraglutide werd gebruikt als monotherapie. Ernstige hypoglykemie kan soms voorkomen en is voornamelijk waargenomen als liraglutide wordt gecombineerd met een sulfonylureumderivaat (0,02 gevallen/patiëntjaar). Er werden zeer weinig episoden van hypoglykemie (0,001 gevallen/patiëntjaar) waargenomen bij de toediening van liraglutide in combinatie met andere orale bloedglucoseverlagende geneesmiddelen dan sulfonylureumderivaten. Het risico op hypoglykemie is laag bij gecombineerd gebruik van basale insuline en liraglutide (1,0 gevallen per patiëntjaar, zie rubriek 5.1). In de LEADER-studie werden episoden van ernstige hypoglykemie minder frequent gemeld bij liraglutide versus placebo (1,0 vs. 1,5 gevallen per 100 patiëntjaren; geschatte incidentieratio 0,69 [0,51 tot 0,93]) (zie rubriek 5.1). Voor patiënten die werden behandeld met mix-insuline bij de start van de studie en ten minste gedurende de volgende 26 weken was de frequentie van ernstige hypoglykemie, voor zowel liraglutide als placebo, 2,2 gevallen per 100 patiëntjaren.
Gastro-intestinale bijwerkingen
Wanneer liraglutide werd gecombineerd met metformine, maakte 20,7% van de patiënten melding van ten minste één episode van misselijkheid en maakte 12,6% van de patiënten melding van ten minste één episode van diarree. Wanneer liraglutide werd gecombineerd met een sulfonylureumderivaat, maakte 9,1% van de patiënten melding van ten minste één episode van misselijkheid en maakte 7,9% van de patiënten melding van ten minste één episode van diarree. De meeste episoden waren mild tot matig van aard en traden dosisafhankelijk op. Bij voortzetting van de behandeling namen bij de meeste patiënten die in eerste instantie last hadden van misselijkheid, de frequentie en ernst hiervan af.
Patiënten ouder dan 70 jaar ondervinden mogelijk meer gastro-intestinale klachten bij behandeling met liraglutide.
Patiënten met lichte en matig ernstige nierinsufficiëntie (respectievelijke creatinineklaring 60-90 ml/min en 30-59 ml/min) ondervinden mogelijk meer gastro-intestinale klachten bij behandeling met liraglutide.
Cholelithiase en Cholecystitis
Tijdens de gecontroleerde fase 3a-langetermijnstudies met liraglutide zijn enkele gevallen van cholelithiase (0,4%) en cholecystitis (0,1%) gemeld. In de LEADER-studie was de frequentie van cholelithiase en cholecystitis respectievelijk 1,5 % en 1,1% voor liraglutide en 1,1% en 0,7% voor placebo (zie rubriek 5.1).
Huidamyloïdose
Huidamyloïdose kan optreden op de injectieplaats (zie rubriek 4.2).
Terugtrekking uit de studies
De incidentie van terugtrekking uit de gecontroleerde langetermijnstudies (26 weken of langer) als gevolg van bijwerkingen was 7,8% voor patiënten behandeld met liraglutide en 3,4% voor patiënten behandeld met de comparator. De meest voorkomende bijwerkingen bij patiënten behandeld met liraglutide die leidden tot terugtrekking uit de studies waren misselijkheid (2,8% van de patiënten) en braken (1,5%).
Reacties op de injectieplaats
Reacties op de injectieplaats zijn gemeld bij ongeveer 2% van de patiënten die Victoza kregen in gecontroleerde langetermijnstudies (26 weken of langer). Deze reacties waren doorgaans mild van aard.
Pancreatitis
Tijdens de gecontroleerde fase 3a-langetermijnstudies met Victoza zijn enkele gevallen van acute pancreatitis (< 0,2%) gemeld. Pancreatitis is ook gemeld na het in de handel brengen. In de LEADER-studie was de frequentie van, door beoordeling bevestigde, acute pancreatitis 0,4% voor liraglutide en 0,5% voor placebo (zie rubriek 4.4 en 5.1).
Allergische reacties
Allergische reacties, waaronder urticaria, rash en pruritus zijn gemeld na het in de handel brengen van Victoza.
Een aantal gevallen van anafylactische reacties met bijkomende symptomen zoals hypotensie, palpitaties, dyspneu en oedeem zijn gemeld na het in de handel brengen van Victoza. Enkele gevallen (0,05%) van angio-oedeem zijn gemeld gedurende alle klinische langetermijnstudies met Victoza.
Pediatrische patiënten
In het algemeen was de frequentie, het type en de ernst van de bijwerkingen bij adolescenten en bij kinderen van 10 jaar en ouder vergelijkbaar met wat is waargenomen bij de volwassen patiënten. Het aantal bevestigde hypoglykemische episodes was hoger bij liraglutide (0,58 voorvallen/patiëntjaar) vergeleken met placebo (0,29 voorvallen/patiëntjaar). Bij patiënten behandeld met insuline voorafgaand aan een bevestigde hypoglykemische episode was het aantal hoger bij liraglutide (1,82 voorvallen/patiëntjaar) vergeleken met placebo (0,91 voorvallen/patiëntjaar). Er traden geen ernstige hypoglykemische episodes op in de met liraglutide behandelde groep.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
E-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Novo Nordisk A/S
Novo Allé
DK-2880 Bagsværd
Denemarken
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/09/529/001-005
10. DATUM VAN HERZIENING VAN DE TEKST
11/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2652121 | VICTOZA 6MG/ML OPL INJ VOORGEVULDE PEN 2 X 3ML | A10BJ02 | € 75,82 | - | Ja | - | - |