1. NAAM VAN HET GENEESMIDDEL
Cimzia 200 mg oplossing voor injectie in een voorgevulde spuit
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke voorgevulde spuit bevat 200 mg certolizumab pegol in één ml.
Certolizumab pegol is een recombinant, gehumaniseerd Fab'-fragment van een antilichaam tegen tumornecrosefactor-alfa (TNF-α) tot expressie gebracht in Escherichia coli en geconjugeerd met polyethyleenglycol (PEG).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie (injectie).
Heldere tot bijna doorschijnende, kleurloze tot geelachtige oplossing. De pH van de oplossing is ongeveer 4.7.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Reumatoïde artritis
Cimzia is, in combinatie met methotrexaat (MTX), geïndiceerd voor:
- de behandeling van matige tot ernstige, actieve reumatoïde artritis (RA) bij volwassen patiënten die onvoldoende reageren op disease-modifying antirheumatic drugs (DMARD’s) inclusief MTX. Cimzia kan als monotherapie worden gegeven in geval van intolerantie voor MTX of wanneer voortgezette behandeling met MTX ongewenst is.
- de behandeling van ernstige, actieve en progressieve RA bij volwassenen die niet eerder behandeld werden met MTX of andere DMARD’s.
Gebleken is dat Cimzia, gegeven in combinatie met MTX, een remmend effect heeft op de progressiesnelheid van gewrichtsschade, zoals gemeten door middel van röntgenonderzoek, en de fysieke functie verbetert.
Axiale spondyloartritis
Cimzia is geïndiceerd voor de behandeling van volwassen patiënten met ernstige actieve axiale spondyloartritis, met inbegrip van:
Spondylitis ankylopoetica (SA) (ook bekend als radiografische axiale spondyloartritis)
Volwassenen met ernstige actieve spondylitis ankylopoetica die onvoldoende reageren op of die intolerant zijn voor niet-steroïdale anti-inflammatoire geneesmiddelen (NSAID’s).
Axiale spondyloartritis zonder röntgenologisch bewijs van SA (ook bekend als niet-radiografische axiale spondyloartritis)
Volwassenen met ernstige actieve axiale spondyloartritis zonder röntgenologisch bewijs van SA, die onvoldoende reageren op of die intolerant zijn voor NSAID’s, maar met objectieve tekenen van ontsteking door een verhoogd C‑reactief proteïne (CRP) en/of positieve Magnetic Resonance Imaging (MRI).
Artritis psoriatica
Cimzia, in combinatie met MTX, is geïndiceerd voor de behandeling van actieve artritis psoriatica bij volwassenen die onvoldoende reageerden op eerdere therapie met DMARD’s.
Cimzia kan als monotherapie gegeven worden in geval van intolerantie voor methotrexaat of wanneer voortzetting van de behandeling met methotrexaat ongewenst is.
Plaque psoriasis
Cimzia is geïndiceerd voor de behandeling van matige tot ernstige plaque psoriasis bij volwassenen die in aanmerking komen voor systemische behandeling.
Voor details in verband met de therapeutische effecten, zie rubriek 5.1.
4.2 Dosering en wijze van toediening
De behandeling dient te worden gestart en plaats te vinden onder toezicht van medische specialisten met ervaring in het diagnosticeren en behandelen van aandoeningen waarvoor Cimzia is aangewezen. Aan patiënten dient de speciale patiëntenherinneringskaart te worden gegeven.
Dosering
Reumatoïde artritis, artritis psoriatica, axiale spondyloartritis, plaque psoriasis
Oplaaddosis
De aanbevolen startdosis van Cimzia voor volwassen patiënten is 400 mg (gegeven met 2 subcutane injecties van ieder 200 mg) in week 0, 2 en 4. Voor reumatoïde artritis en artritis psoriatica dient MTX, waar van toepassing, tijdens behandeling met Cimzia te worden voortgezet.
Onderhoudsdosis
Reumatoïde artritis
Na de startdosis is de aanbevolen onderhoudsdosis van Cimzia voor volwassen patiënten met reumatoïde artritis 200 mg om de 2 weken. Wanneer de klinische respons bevestigd is, kan een alternatieve onderhoudsdosering van 400 mg om de 4 weken overwogen worden. MTX dient, waar van toepassing, tijdens behandeling met Cimzia te worden voortgezet.
Axiale spondyloartritis
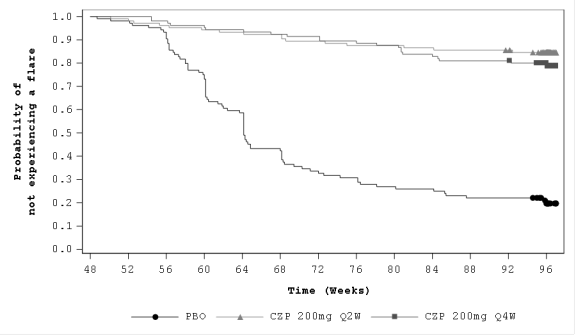
Na de startdosis is de aanbevolen onderhoudsdosis van Cimzia voor volwassen patiënten met axiale spondyloartritis 200 mg om de 2 weken of 400 mg om de 4 weken. Na ten minste 1 jaar behandeling met Cimzia kan, bij patiënten met aanhoudende remissie, een verlaagde onderhoudsdosis van 200 mg om de 4 weken worden overwogen (zie rubriek 5.1).
Artritis psoriatica
Na de startdosis is de aanbevolen onderhoudsdosis van Cimzia voor volwassen patiënten met artritis psoriatica 200 mg om de 2 weken. Wanneer de klinische respons bevestigd is, kan een alternatieve onderhoudsdosering van 400 mg om de 4 weken overwogen worden. MTX dient, waar van toepassing, tijdens de behandeling met Cimzia te worden voortgezet.
Voor alle bovenstaande indicaties duiden beschikbare gegevens erop dat klinische respons gewoonlijk binnen 12 weken behandeling wordt bereikt. Voortzetting van de therapie dient zorgvuldig te worden heroverwogen bij patiënten bij wie binnen de eerste 12 weken van de behandeling geen aanwijzingen voor therapeutisch voordeel worden gevonden.
Plaque psoriasis
Na de startdosis, is de onderhoudsdosis Cimzia voor volwassen patiënten met plaque psoriasis 200 mg om de 2 weken. Een dosis van 400 mg om de 2 weken kan overwogen worden bij patiënten die onvoldoende reageren (zie rubriek 5.1).
Beschikbare gegevens van volwassenen met plaque psoriasis duiden erop dat een klinische respons gewoonlijk binnen 16 weken behandeling wordt bereikt. Voortzetting van de behandeling dient zorgvuldig te worden heroverwogen bij patiënten bij wie binnen de eerste 16 weken van de behandeling geen aanwijzingen voor therapeutisch voordeel worden gevonden. Sommige patiënten met een initiële gedeeltelijke respons kunnen vervolgens verbetering tonen met voortzetting van behandeling na 16 weken.
Gemiste dosis
Patiënten die een dosis vergeten, moet worden geadviseerd de volgende dosis Cimzia te injecteren zodra ze zich dit herinneren en de daaropvolgende doses te injecteren zoals geïnstrueerd.
Speciale populaties
Pediatrische patiënten (< 18 jaar)
De veiligheid en werkzaamheid van Cimzia bij kinderen en adolescenten jonger dan 18 jaar is nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Oudere patiënten (≥ 65 jaar)
Dosisaanpassing is niet nodig. Farmacokinetische populatieanalyses toonden geen effect van leeftijd (zie rubriek 5.2).
Nier- en leverfunctiestoornis
Cimzia is niet onderzocht bij deze patiëntenpopulaties. Er kan geen doseringsadvies worden gegeven (zie rubriek 5.2).
Wijze van toediening
De totale inhoud (1 ml) van de voorgevulde spuit mag uitsluitend worden toegediend als subcutane injectie. Geschikte injectieplaatsen zijn het bovenbeen en de buik.
Na de injectietechniek goed te hebben geoefend, kunnen patiënten zelf Cimzia injecteren met de voorgevulde spuit als hun arts beslist dat hiertegen geen bezwaar is en indien nodig gevolgd door een medische nacontrole.
De voorgevulde spuit met naaldbeschermer mag enkel door beroepsbeoefenaren uit de gezondheidszorg worden gebruikt. De arts moet met de patiënt bespreken welke injectievorm het meest geschikt is.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor één van de in rubriek 6.1 vermelde hulpstoffen.
Actieve tuberculose of andere ernstige infecties, zoals sepsis of opportunistische infecties (zie rubriek 4.4).
Matig tot ernstig hartfalen (NYHA-klasse III/IV) (zie rubriek 4.4).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Reumatoïde artritis
Cimzia is tot maximaal 92 maanden in gecontroleerde onderzoeken en open‑label onderzoeken onderzocht bij 4049 patiënten met reumatoïde artritis.
In de placebogecontroleerde onderzoeken was de duur van het gebruik bij de patiënten die Cimzia kregen ongeveer 4 keer zo lang als bij de patiënten die placebo kregen. Dit verschil in blootstelling komt hoofdzakelijk doordat de kans op vroegtijdige terugtrekking uit het onderzoek bij patiënten op placebo groter is. Verder was in de onderzoeken RA‑I en RA‑II terugtrekking van niet‑responders in week 16 verplicht; de meerderheid hiervan kreeg placebo.
In de gecontroleerde onderzoeken was het relatieve aantal patiënten bij wie de behandeling vanwege bijwerkingen werd gestaakt 4,4% voor met Cimzia behandelde patiënten en 2,7% voor met placebo behandelde patiënten.
De meest voorkomende bijwerkingen behoorden tot de systeem/orgaanklassen "Infecties en parasitaire aandoeningen" (14,4% bij patiënten op Cimzia en 8,0% bij patiënten op placebo), "Algemene aandoeningen en toedieningsplaatsstoornissen" (8,8% bij patiënten op Cimzia en 7,4% bij patiënten op placebo) en “Huid- en onderhuidaandoeningen” (7,0% bij patiënten op Cimzia en 2,4% bij patiënten op placebo).
Axiale spondyloartritis
Cimzia werd in eerste instantie gedurende maximaal 4 jaar bij 325 patiënten met actieve axiale spondyloartritis (waaronder spondylitis ankylopoetica en niet-radiografische axiale spondyloartritis) in de klinische studie AS001 onderzocht. Deze periode omvatte een 24 weken durende placebogecontroleerde fase gevolgd door een 24 weken durende dosisblinde periode en een 156 weken durende open-label behandelperiode. Cimzia werd vervolgens bestudeerd bij 317 patiënten met niet-radiografische axiale spondyloartritis gedurende 52 weken in een placebogecontroleerde studie (AS0006). Cimzia werd ook onderzocht bij patiënten met axiale spondyloartritis (waaronder spondylitis ankylopoetica en niet-radiografische axiale spondyloartritis) in een klinische studie gedurende maximaal 96 weken. Deze periode omvatte een 48 weken durende open-label inloopperiode (N=736) gevolgd door een 48 weken durende placebogecontroleerde fase (N=313) voor patiënten met aanhoudende remissie (C-OPTIMISE). Cimzia is ook bestudeerd in een 96 weken durend open-labelonderzoek bij 89 axSpA-patiënten met een voorgeschiedenis van gedocumenteerde opflakkeringen van anterieure uveïtis. In alle vier de studies kwam het veiligheidsprofiel van deze patiënten overeen met het veiligheidsprofiel bij reumatoïde artritis en de eerdere ervaring met Cimzia.
Artritis psoriatica
Cimzia werd gedurende maximaal 4 jaar bij 409 patiënten met artritis psoriatica in de klinische studie PsA001 onderzocht. Deze periode omvatte een 24 weken durende placebogecontroleerde fase gevolgd door een 24 weken durende dosisblinde periode en een 168 weken durende open-label behandelperiode. Het veiligheidsprofiel van Cimzia bij patiënten met artritis psoriatica kwam overeen met het veiligheidsprofiel van Cimzia bij patiënten met reumatoïde artritis en eerdere ervaringen met Cimzia.
Plaque psoriasis
Cimzia werd onderzocht bij 1112 patiënten met psoriasis in gecontroleerde en open-label onderzoeken tot maximaal 3 jaar. In het fase III-programma werden de initiële periode en onderhoudsperiode gevolgd door een 96 weken durende open-label behandelingsperiode (zie rubriek 5.1). Het veiligheidsprofiel op de lange termijn van Cimzia 400 mg om de 2 weken en Cimzia 200 mg om de 2 weken was over het algemeen vergelijkbaar en consistent met eerdere ervaring met Cimzia.
Tijdens gecontroleerde klinische onderzoeken tot en met week 16 was het percentage patiënten met ernstige bijwerkingen 3,5% bij Cimzia en 3,7% bij placebo.
Het percentage patiënten die de behandeling stopzetten vanwege bijwerkingen in de gecontroleerde klinische onderzoeken was 1,5% bij patiënten behandeld met Cimzia en 1,4% bij patiënten behandeld met placebo.
De meest voorkomende bijwerkingen gerapporteerd tot en met week 16 behoorden tot de systeem/orgaanklassen "Infecties en parasitaire aandoeningen" gerapporteerd bij 6,1% bij patiënten op Cimzia en 7% bij patiënten op placebo, "Algemene aandoeningen en toedieningsplaatsstoornissen" gerapporteerd bij 4,1% bij patiënten op Cimzia en 2,3% bij patiënten op placebo en “Huid- en onderhuidaandoeningen” gerapporteerd bij 3,5% bij patiënten op Cimzia en 2,8% bij patiënten op placebo.
Lijst van bijwerkingen in tabelvorm
Bijwerkingen die voornamelijk gebaseerd zijn op ervaring van de placebogecontroleerde klinische onderzoeken en post-marketinggevallen die op zijn minst mogelijk gerelateerd zijn aan Cimzia staan weergegeven in Tabel 1 hieronder, gerangschikt naar frequentie en systeem/orgaanklasse. De frequentiecategorieën zijn als volgt gedefinieerd: zeer vaak (≥1/10), vaak (≥1/100, <1/10), soms (≥1/1.000, <1/100), zelden (≥1/10.000, <1/1.000), zeer zelden (<1/10.000), niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen iedere frequentiegroep worden bijwerkingen weergegeven in volgorde van afnemende ernst.
Tabel 1 Bijwerkingen in klinische onderzoeken en tijdens de post‑marketingperiode
Systeem/orgaanklasse | Frequentie | Bijwerkingen |
Infecties en parasitaire aandoeningen | Vaak | bacteriële infecties (waaronder abces), virale infecties (waaronder herpes zoster, papillomavirus, influenza) |
Soms | sepsis (waaronder multiorgaanfalen, septische shock), tuberculose (waaronder miliaire, gedissemineerde en extrapulmonale tuberculose), schimmelinfecties (waaronder opportunistische) | |
Neoplasmata, benigne, maligne en niet‑gespecificeerd (inclusief cysten en poliepen) | Soms | bloed- en lymfestelselmaligniteiten (waaronder lymfoom en leukemie), solide orgaantumoren, niet‑melanome huidkanker, precancereuze laesies (waaronder orale leukoplakie, melanocytaire naevus), goedaardige tumoren en cysten (waaronder huidpapilloom) |
Zelden | gastro‑intestinale tumoren, melanoom | |
Niet bekend | Merkelcelcarcinoom*, Kaposi-sarcoom | |
Bloed- en lymfestelselaandoeningen | Vaak | eosinofiele afwijkingen, leukopenie (waaronder neutropenie, lymfopenie) |
Soms | anemie, lymfadenopathie, trombocytopenie, trombocytose | |
Zelden | pancytopenie, splenomegalie, erytrocytose, morfologisch abnormale leukocyten | |
Immuunsysteemaandoeningen | Soms | vasculitiden, lupus erythematosus, geneesmiddelovergevoeligheid (waaronder anafylactische shock), allergische aandoeningen, auto‑antilichaampositief |
Zelden | angioneurotisch oedeem, sarcoïdose, serumziekte, panniculitis (waaronder erythema nodosum), verergering van symptomen van dermatomyositis** | |
Endocriene aandoeningen | Zelden | schildklieraandoeningen |
Voedings- en stofwisselingsstoornissen | Soms | elektrolytenonbalans, dislipidemie, eetluststoornissen, verandering in gewicht |
Zelden | hemosiderose | |
Psychische stoornissen | Soms | angst en stemmingsstoornissen (waaronder daarmee verband houdende symptomen) |
Zelden | suïcidepoging, delirium, verminderd geestelijk vermogen | |
Zenuwstelselaandoeningen | Vaak | hoofdpijn (waaronder migraine), sensorische afwijkingen |
Soms | perifere neuropathieën, duizeligheid, tremor | |
Zelden | stuip, ontsteking schedelzenuw, coördinatie- of evenwichtsstoornis | |
Niet bekend | multipele sclerose*, Guillain‑Barrė syndroom* | |
Oogaandoeningen | Soms | visuele stoornis (waaronder verminderde visus), oog- en ooglidontsteking, stoornis in de traansecretie |
Evenwichtsorgaan- en ooraandoeningen | Soms | tinnitus, vertigo |
Hartaandoeningen | Soms | cardiomyopathieën (waaronder hartfalen), ischemische coronaire aandoeningen, aritmieën (waaronder atriumfibrilleren), palpitaties |
Zelden | pericarditis, atrioventriculair blok | |
Bloedvataandoeningen | Vaak | hypertensie |
Soms | hemorragie of bloeding (waar dan ook), verhoogde bloedstolling (waaronder tromboflebitis, longembolie), syncope, oedeem (waaronder perifeer oedeem, gezichtsoedeem), ecchymose (waaronder hematoom, petechiën) | |
Zelden | cerebrovasculair accident, arteriosclerose, Raynaudfenomeen, livedo reticularis, teleangiëctasie | |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Soms | astma en verwante tekenen, pleura‑effusie en symptomen ervan, luchtwegcongestie en -inflammatie, hoesten |
Zelden | interstitiële longziekte, pneumonitis | |
Maagdarmstelselaandoeningen | Vaak | misselijkheid |
Soms | ascites, gastro‑intestinale ulcusvorming en perforatie, ontsteking maag‑darmkanaal (waar dan ook), stomatitis, dyspepsie, abdominale distensie, orofaryngeale droogheid | |
Zelden | odynofagie, hypermotiliteit | |
Lever- en galaandoeningen | Vaak | hepatitis (waaronder verhoogde leverenzymen) |
Soms | hepatopathie (waaronder cirrose), cholestase, hyperbilirubinemie | |
Zelden | cholelithiasis | |
Huid- en onderhuidaandoeningen | Vaak | uitslag |
Soms | alopecia, het nieuw ontstaan of verslechteren van psoriasis (waaronder pustuleuze palmoplantaire psoriasis) en verwante aandoeningen, dermatitis en eczeem, zweetklierstoornis, huidulcus, lichtgevoeligheid, acne, huidverkleuring, droge huid, nagel- en nagelbedaandoeningen | |
Zelden | huidexfoliatie en -desquamatie, bulleuze aandoeningen, haartextuuraandoeningen, Stevens-Johnson-syndroom**, erythema multiforme**, lichenoïde reacties | |
Skeletspierstelsel- en bindweefselaandoeningen | Soms | spieraandoeningen, bloedcreatinefosfokinase verhoogd |
Nier- en urinewegaandoeningen | Soms | nierfunctiestoornis, bloed in de urine, blaas- en urethrasymptomen |
Zelden | nefropathie (waaronder nefritis) | |
Voortplantingsstelsel- en borstaandoeningen | Soms | menstruatiecyclus- en uteriene bloedingsstoornissen (waaronder amenorroe), borstaandoeningen |
Zelden | seksuele dysfunctie | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Vaak | pyrexie, pijn (waar dan ook), asthenie, jeuk (waar dan ook), reacties op de injectieplaats |
Soms | rillingen, influenza‑achtige ziekte, veranderd temperatuurgevoel, nachtzweten, opvliegers | |
Zelden | fistels (waar dan ook) | |
Onderzoeken | Soms | bloed alkaline fosfatase verhoogd, verlengde bloedstollingtijd |
Zelden | verhoogd urinezuur in het bloed | |
Letsels, intoxicaties en verrichtingscomplicaties | Soms | huidletsels, verstoorde genezing |
* Deze bevindingen zijn in verband gebracht met de klasse van de TNF‑antagonisten, maar de incidentie met certolizumab pegol is niet bekend.
** Deze bevindingen zijn in verband gebracht met de klasse van de TNF‑antagonisten.
Daarnaast zijn volgende bijwerkingen soms waargenomen bij gebruik van Cimzia voor andere indicaties: gastro‑intestinale stenose en obstructies, algemene verslechtering van de fysieke gezondheid, spontane abortus en azoöspermie.
Omschrijving van geselecteerde bijwerkingen
Infecties
De incidenties van nieuwe infectiegevallen in placebogecontroleerde klinische onderzoeken bij reumatoïde artritis was 1,03 per patiëntjaar voor alle met Cimzia behandelde patiënten en 0,92 per patiëntjaar voor met placebo behandelde patiënten. De infecties waren voornamelijk infecties van de bovenste luchtwegen, urineweginfecties, infecties van de onderste luchtwegen en virale herpesinfecties (zie rubriek 4.3 en rubriek 4.4).
In de placebogecontroleerde klinische onderzoeken bij reumatoïde artritis waren meer nieuwe gevallen van ernstige infecties bij de met Cimzia behandelde groepen (0,07 per patiëntjaar, alle doses) dan bij placebo (0,02 per patiëntjaar). De meest frequente ernstige infecties waren onder meer pneumonie en tuberculose‑infecties. Ernstige infecties omvatten ook invasieve opportunistische infecties (bijvoorbeeld pneumocystose, schimmeloesofagitis, nocardiose en herpes zoster disseminatus). Er zijn geen aanwijzingen voor een verhoogd infectierisico na verloop van tijd bij voortgezette blootstelling (zie rubriek 4.4).
De incidenties van nieuwe infectiegevallen in placebogecontroleerde klinische onderzoeken bij psoriasis was 1,37 per patiëntjaar voor alle met Cimzia behandelde patiënten en 1,59 per patiëntjaar voor met placebo behandelde patiënten. De infecties waren voornamelijk infecties van de bovenste luchtwegen en virale infecties (waaronder herpesinfecties). De incidentie van ernstige infecties was 0,02 per patiëntjaar voor alle met Cimzia behandelde patiënten. Geen ernstige infecties werden gerapporteerd bij met placebo behandelde patiënten. Er zijn geen aanwijzingen voor een verhoogd infectierisico na verloop van tijd bij voortgezette blootstelling.
Maligniteiten en lymfoproliferatieve aandoeningen
In de klinische Cimzia RA‑onderzoeken, waarbij in totaal 4049 patiënten zijn behandeld (goed voor 9277 patiëntjaren), werden, met uitzondering van niet‑melanome huidkanker, 121 maligniteiten waargenomen, waaronder 5 gevallen van lymfoom. In klinische onderzoeken met Cimzia bij reumatoïde artritis kwam lymfoom voor met een incidentie van 0,05 per 100 patiëntjaren en melanoom met een incidentie van 0,08 per 100 patiëntjaren (zie rubriek 4.4). Eén geval van lymfoom werd eveneens waargenomen in de klinische fase III‑studie rond artritis psoriatica.
In de klinische Cimzia psoriasis-onderzoeken, waarbij in totaal 1112 patiënten werden behandeld (goed voor 2300 patiëntjaren), werden, met uitzondering van niet-melanome huidkanker, 11 maligniteiten waargenomen, waaronder 1 geval van lymfoom.
Auto‑immuniteit
In de belangrijkste studies bij reumatoïde artritis, bij proefpersonen die bij aanvang ANA‑negatief waren, ontstonden positieve ANA‑titers bij 16,7% van de met Cimzia behandelde proefpersonen versus 12,0% van de proefpersonen in de placebogroep. Bij proefpersonen die bij aanvang anti-dsDNA-antilichaamnegatief waren, ontstonden positieve anti-dsDNA-antilichaamtiters bij 2,2% van de met Cimzia behandelde proefpersonen versus 1,0% van de proefpersonen in de placebogroep. In zowel placebogecontroleerde als klinische open‑label vervolgonderzoeken bij reumatoïde artritis werden soms gevallen van een lupusachtig syndroom gerapporteerd. Er zijn zeldzame meldingen gemaakt van andere immuungemedieerde aandoeningen; het causale verband met Cimzia is niet bekend. De invloed van langdurige behandeling met Cimzia op het ontstaan van auto‑immuunziekten is niet bekend.
Reacties op de injectieplaats
In de placebogecontroleerde klinische onderzoeken bij reumatoïde artritis ontstond bij 5,8% van de met Cimzia behandelde patiënten een reactie op de injectieplaats zoals erytheem, jeuk, hematoom, pijn, zwelling of bloeduitstorting versus 4,8% van de patiënten die placebo kregen. Pijn op de injectieplaats werd waargenomen bij 1,5% van de met Cimzia behandelde patiënten. Dit leidde in geen enkel geval tot terugtrekking uit het onderzoek.
Creatinefosfokinase verhogingen
De frequentie van de verhoging van creatinefosfokinase (CPK) was over het algemeen hoger bij patiënten met axSpA ten opzichte van de RA‑populatie. De frequentie was zowel bij patiënten behandeld met placebo (2,8% versus 0,4% in respectievelijk axSpA en RA‑populaties) als bij patiënten behandeld met Cimzia (4,7% versus 0,8% in respectievelijk axSpA en RA‑populaties) verhoogd. De CPK‑verhogingen in de axSpA studie waren meestal mild tot matig, van voorbijgaande aard en van onbekende klinische significantie met geen enkel geval dat tot terugtrekking uit de studie leidde.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
UCB Pharma S.A.
Allée de la Recherche 60
B-1070 Brussel
België
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/09/544/001
EU/1/09/544/002
EU/1/09/544/003
EU/1/09/544/004
10. DATUM VAN HERZIENING VAN DE TEKST
01/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2650406 | CIMZIA 200MG OPL INJ VOORGEV.SPUIT 2 + 2 TAMPONS | L04AB05 | € 717,15 | - | Ja | € 12,5 | € 8,3 |