1. NAAM VAN HET GENEESMIDDEL
Yaz 0,02 mg/3 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
24 lichtroze filmomhulde tabletten:
Elke filmomhulde tablet bevat 0,020 mg ethinylestradiol (als betadexcladraat) en 3 mg drospirenon.
Hulpstof met bekend effect: 46 mg lactose (als lactosemonohydraat 48,18 mg)
4 witte filmomhulde (niet werkzame) placebotabletten:
De tablet bevat geen werkzame bestanddelen.
Hulpstof met bekend effect: 22 mg lactose (als lactosemonohydraat 23,21 mg)
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet
De werkzame tabletten zijn lichtroze en rond met convexe zijden; aan één zijde voorzien van de letters “DS” in een regelmatige zeshoek.
De placebotabletten zijn wit en rond met convexe zijden; aan één zijde voorzien van de letters “DP” in een regelmatige zeshoek.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Orale anticonceptie.
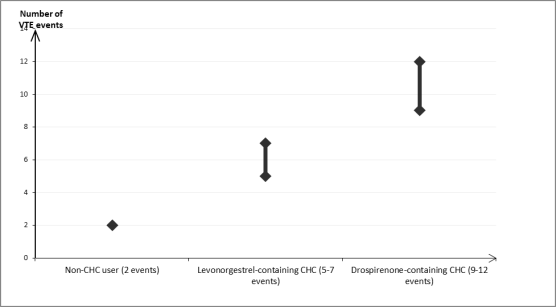
Bij de beslissing om Yaz voor te schrijven moet rekening worden gehouden met de huidige risicofactoren van de individuele vrouw, in het bijzonder met de factoren voor veneuze trombo-embolie (VTE) en hoe het risico op VTE met Yaz zich verhoudt tot het risico met andere gecombineerde hormonale anticonceptiva (zie rubrieken 4.3 en 4.4).
4.2 Dosering en wijze van toediening
Wijze van toediening: oraal gebruik
Dosering
Hoe wordt Yaz ingenomen?
De tabletten moeten elke dag op ongeveer hetzelfde tijdstip worden ingenomen, zonodig met wat vloeistof, in de volgorde die op de blisterverpakking staat aangegeven. De tabletinname is continu. Gedurende 28 opeenvolgende dagen moet dagelijks één tablet worden ingenomen. Elke volgende blisterverpakking wordt gestart de dag na de laatste tablet van de vorige blisterverpakking. Een onttrekkingsbloeding treedt doorgaans de tweede of derde dag na het begin van de inname van de placebotabletten (laatste rij) op; deze bloeding is niet altijd voorbij op de dag waarop met de volgende blisterverpakking wordt begonnen.
Hoe beginnen met Yaz?
- Geen voorafgaand gebruik van een hormonaal anticonceptivum (in de afgelopen maand)
De eerste tablet moet op dag 1 van de natuurlijke cyclus van de vrouw worden ingenomen (d.w.z. op de eerste dag van de menstruatie).
- Overschakelen van een gecombineerd hormonaal anticonceptivum (combinatie oraal anticonceptivum [combinatie OAC], vaginale anticonceptiering of anticonceptiepleister)
De vrouw dient bij voorkeur met Yaz te starten op de dag na de laatste werkzame tablet (de laatste tablet met de werkzame bestanddelen) van haar voorgaande combinatie-OAC, maar niet later dan op de dag na de gebruikelijke tabletvrije of placeboperiode van haar voorgaande combinatie-OAC. Als een vaginale anticonceptiering of een anticonceptiepleister is gebruikt, dient de vrouw bij voorkeur te beginnen met Yaz op de dag van verwijdering, maar niet later dan op de dag waarop de volgende ring of pleister zou moeten worden geplaatst.
- Overschakelen van een progestageenmethode (OAC met alleen een progestageen, injectiepreparaat, implantaat) of van een progestageen-afgevend intra-uterien systeem (IUS)
De vrouw mag overschakelen van een OAC met alleen een progestageen wanneer zij wil (van een implantaat of IUS op de dag van verwijdering en van een injectiepreparaat op de dag waarop de volgende injectie zou moeten worden gegeven), maar moet in al deze gevallen geadviseerd worden om tijdens de eerste 7 dagen van de tabletinname aanvullend een barrièremiddel te gebruiken.
- Na een abortus in het eerste trimester
De vrouw mag direct beginnen. In dit geval hoeft ze geen aanvullende anticonceptieve maatregelen te nemen.
- Na een bevalling of na een abortus in het tweede trimester
Aangeraden moet worden om tussen de 21e en 28e dag na de partus of na een abortus in het tweede trimester te starten. Als een vrouw later begint, dan moet haar worden aangeraden om tijdens de eerste 7 dagen aanvullend een barrièremiddel te gebruiken. Als inmiddels echter geslachtsgemeenschap heeft plaatsgevonden, dan moet een zwangerschap worden uitgesloten of moet de eerste menstruatie worden afgewacht voordat de vrouw met de combinatie-OAC begint.
Voor vrouwen die borstvoeding geven, zie rubriek 4.6.
Wat te doen na het vergeten van tabletten?
Placebotabletten uit de laatste (4e) rij van de blisterverpakking kunnen worden overgeslagen. Ze moeten echter worden weggegooid om te voorkomen dat de placebofase per ongeluk wordt verlengd. Het volgende advies heeft alleen betrekking op vergeten werkzame tabletten:
Als een vrouw minder dan 24 uur te laat is met het innemen van een tablet, is de anticonceptieve werking niet verminderd. De vrouw moet deze tablet alsnog innemen zodra zij eraan denkt en de resterende tabletten op het gebruikelijke tijdstip innemen.
Als de vrouw meer dan 24 uur te laat is met het innemen van een tablet, kan de anticonceptieve werkzaamheid verminderd zijn. Bij het beleid kunnen de volgende twee basisregels als leidraad dienen:
- Het aanbevolen hormoonvrije tablet interval is 4 dagen, het innemen van de tabletten mag nooit langer dan 7 achtereenvolgende dagen onderbroken worden.
- Tabletten moeten 7 dagen zonder onderbreking worden ingenomen om de hypofyse-ovariumas voldoende te onderdrukken.
Dienovereenkomstig kunnen in de praktijk de volgende adviezen worden gegeven:
- Dag 1-7
De vrouw moet de laatste vergeten tablet innemen zodra zij eraan denkt, zelfs als dit betekent dat zij twee tabletten op hetzelfde moment moet innemen. Zij gaat dan op het gebruikelijke tijdstip verder met de resterende tabletten.
Aanvullend dient gedurende de eerstvolgende 7 dagen na het vergeten een barrièremiddel, zoals bijvoorbeeld een condoom, te worden gebruikt. Als er geslachtsgemeenschap heeft plaatsgehad in de 7 dagen vóór het vergeten van de tabletten, dan moet rekening worden gehouden met een mogelijke zwangerschap. De kans op zwangerschap wordt groter naarmate er meer tabletten zijn vergeten en deze tabletten dichter bij de placebofase zijn vergeten.
- Dag 8-14
De vrouw moet de laatste vergeten tablet innemen zodra zij eraan denkt, zelfs als dit betekent dat zij twee tabletten op hetzelfde moment moet innemen. Zij gaat dan op het gebruikelijke tijdstip verder met de resterende tabletten. Als de vrouw de tabletten in de 7 dagen voorafgaande aan de éérste vergeten tablet correct heeft ingenomen, is geen aanvullende anticonceptie nodig. Als de vrouw echter meer dan 1 tablet is vergeten, moet haar aangeraden worden om gedurende de eerstvolgende 7 dagen aanvullend een barrièremiddel te gebruiken.
- Dag 15-24
Vanwege de naderende placebofase dreigt het gevaar van verminderde betrouwbaarheid. Door het aanpassen van het tabletinnameschema kan echter worden voorkomen dat de contraceptieve betrouwbaarheid daadwerkelijk vermindert.
Bij het opvolgen van één van de volgende twee adviezen is dan ook geen aanvullende anticonceptie nodig, mits de vrouw alle tabletten in de 7 dagen voorafgaande aan de eerste vergeten tablet correct heeft ingenomen. Als dit niet het geval is, moet zij het eerste van de hierna gegeven adviezen volgen en bovendien gedurende de eerstvolgende 7 dagen aanvullend een barrièremiddel gebruiken.
- De vrouw moet de laatste vergeten tablet innemen zodra zij eraan denkt, zelfs als dit betekent dat zij twee tabletten op hetzelfde moment moet innemen. Zij gaat dan op het gebruikelijke tijdstip verder met de resterende werkzame tabletten tot deze op zijn. De 4 placebotabletten uit de laatste rij moeten worden weggegooid. Na de laatste werkzame tablet van de blisterverpakking moet de vrouw direct met een nieuwe blisterverpakking beginnen. De vrouw heeft waarschijnlijk geen onttrekkingsbloeding tot na de laatste werkzame tabletten van de tweede blisterverpakking maar er kan wel enig bloedverlies (‘doorbraakbloeding’ of ‘spotting’) optreden tijdens het gebruik van deze blisterverpakking.
- De vrouw mag ook worden aangeraden om te stoppen met het innemen van de werkzame tabletten uit de huidige blisterverpakking. Ze moet dan de placebotabletten van de laatste rij innemen gedurende 4 dagen, inclusief de dagen waarop zij tabletten was vergeten, en na die periode doorgaan met de volgende blisterverpakking.
Als een vrouw na het vergeten van tabletten geen onttrekkingsbloeding heeft in de placebofase dan moet rekening worden gehouden met een eventuele zwangerschap.
Advies in het geval van gastro-intestinale stoornissen
In het geval van ernstige gastro-intestinale stoornissen (bijv. overgeven of diarree), kan de absorptie verstoord zijn en dienen aanvullende anticonceptiemaatregelen te worden gebruikt. Als braken optreedt binnen 3-4 uur na de inname van een werkzame tablet, moet de vrouw zo snel mogelijk een nieuwe (vervangende) tablet innemen. De nieuwe tablet moet zo mogelijk binnen 24 uur na het normale innametijdstip worden ingenomen. Als er echter méér dan 24 uur zijn verstreken, geldt het advies voor het vergeten van tabletten dat in rubriek 4.2 “Wat te doen na het vergeten van tabletten?” is gegeven. Als de vrouw haar normale schema van tabletinname niet wil veranderen, moet ze de extra tablet(ten) uit een andere blisterverpakking nemen.
Hoe kan een onttrekkingsbloeding worden uitgesteld?
Om een maandelijkse bloeding uit te stellen dient de vrouw de placebotabletten uit haar huidige blisterverpakking over te slaan en door te gaan met de volgende blisterverpakking Yaz. De maandelijkse bloeding kan worden uitgesteld naar gelang de wensen van de vrouw, maar niet langer dan totdat de werkzame tabletten in de tweede blisterverpakking zijn opgebruikt. Tijdens de verlenging kan doorbraakbloeding of spotting optreden. Na de gebruikelijke placebofase wordt de reguliere inname van Yaz hervat.
Als een vrouw de huidige begindag van haar bloeding wenst te verschuiven naar een andere dag, kan haar worden aangeraden haar eerstvolgende placebotabletfase te verkorten met zoveel dagen als zij wenst. Hoe korter de placebofase wordt, hoe groter de kans wordt dat ze geen onttrekkingsbloeding krijgt en doorbraakbloeding of spotting zal krijgen tijdens het gebruik van de volgende blisterverpakking (vergelijkbaar met het uitstellen van de menstruatie).
Bijkomende informatie over speciale patiëntengroepen
Pediatrische patiënten
Yaz is enkel geïndiceerd na de menarche.
Ouderen
Yaz is niet geïndiceerd voor gebruik na de menopauze.
Patiënten met leverfunctiestoornis
Yaz is gecontra-indiceerd bij vrouwen met ernstige leverziektes. Zie ook rubrieken 4.3 en 5.2.
Patiënten met nierfunctiestoornis
Yaz is gecontra-indiceerd bij vrouwen met een ernstige nierfunctiestoornis of acuut nierfalen. Zie ook rubrieken 4.3 en 5.2.
4.3 Contra-indicaties
Gecombineerde hormonale anticonceptiva (CHC’s) mogen in de volgende situatie niet worden gebruikt. Als één van deze aandoeningen voor het eerst optreedt tijdens het gebruik van een CHC, dan moet het gebruik hiervan onmiddellijk worden gestaakt.
- Aanwezigheid van of risico op veneuze trombo-embolie (VTE)
- Veneuze trombo-embolie – bestaande VTE (bij antistollingsmiddelen) of eerder doorgemaakte VTE (bijv. diepe veneuze trombose [DVT] of longembolie [PE])
- Bekende erfelijke of verworven predispositie voor veneuze trombo-embolie, bijvoorbeeld APC-resistentie, (waaronder factor V-Leiden), antitrombine‑III-deficiëntie, proteïne C-deficiëntie, proteïne S-deficiëntie
- Zware operatie met langdurige immobilisatie (zie rubriek 4.4)
- Een hoog risico op veneuze trombo-embolie door de aanwezigheid van meerdere risicofactoren (zie rubriek 4.4)
- Aanwezigheid van of risico op arteriële trombo-embolie (ATE)
- Arteriële trombo-embolie – bestaande arteriële trombo-embolie, eerder doorgemaakte arteriële trombo-embolie (bijv. myocardinfarct) of prodromale aandoening (bijv. angina pectoris)
- Cerebrovasculaire ziekte – bestaande beroerte, eerder doorgemaakte beroerte of prodromale aandoening (bijv. transient ischaemic attack (TIA))
- Bekende erfelijke of verworven predispositie voor arteriële trombo-embolie, bijvoorbeeld hyperhomocysteïnemie en antifosfolipiden-antistoffen (anticardiolipine-antistoffen, lupusanticoagulans)
- Voorgeschiedenis van migraine met focale neurologische symptomen
- Een hoog risico op arteriële trombo-embolie als gevolg van meerdere risicofactoren (zie rubriek 4.4) of door de aanwezigheid van een ernstige risicofactor, zoals:
- diabetes mellitus met vasculaire symptomen
- ernstige hypertensie
- ernstige dislipoproteïnemie
- Manifeste of eerder doorgemaakte ernstige leveraandoening zolang de leverfunctiewaarden niet genormaliseerd zijn
- Ernstige nierinsufficiëntie of acuut nierfalen
- Manifeste of eerder doorgemaakte levertumoren (benigne of maligne)
- Aanwezigheid van geslachtshormoonafhankelijke maligne aandoeningen (bijvoorbeeld van de geslachtsorganen of de mammae), of het vermoeden daarvan
- Vaginale bloedingen waarvan de diagnose niet is gesteld
- Overgevoeligheid voor de werkzame stoffen of voor een van de in rubriek 6.1 vermelde hulpstoffen
Yaz is gecontra-indiceerd voor concomitant gebruik met geneesmiddelen die ombitasvir/
paritaprevir/ritonavir en dasabuvir bevatten, geneesmiddelen die glecaprevir/pibrentasvir of sofosbuvir/velpatasvir/voxilaprevir bevatten (zie rubriek 4.5).
4.8 Bijwerkingen
Voor ernstige ongewenste effecten bij gebruiksters van een combinatie-OAC zie ook rubriek 4.4.
De volgende ongewenste geneesmiddelenreacties werden tijdens het gebruik van Yaz gerapporteerd:
Onderstaande tabel vermeldt bijwerkingen volgens de MedDRA systeem-/orgaanklassen (MedDRA SOCs). De frequenties zijn gebaseerd op gegevens uit klinisch onderzoek. De meest geschikte MedDRA-term is gebruikt voor het beschrijven van een bepaalde bijwerking, samen met synoniemen en verwante aandoeningen.
Bijwerkingen die in verband zijn gebracht met het gebruik van Yaz als oraal anticonceptivum of in de behandeling van matige acne vulgaris volgens de MedDRA systeem/orgaanklassen en MedDRA-termen.
Systeem-/orgaanklassen (MedDRA versie 9.1) | Vaak | Soms | Zelden | Niet bekend |
Infecties en parasitaire aandoeningen |
|
| candidiasis |
|
Bloed- en lymfestelselaandoeningen |
|
| anemie |
|
Immuunsysteem-aandoeningen |
|
| allergische reactie | Overgevoeligheid |
Endocriene aandoeningen |
|
| endocriene aandoening |
|
Voedings- en stofwisselingsstoornissen |
|
| toegenomen eetlust |
|
Psychische stoornissen | emotionele labiliteit | depressie | anorgasmie |
|
Zenuwstelsel-aandoeningen | hoofdpijn | duizeligheid | draaiduizeligheid |
|
Oogaandoeningen |
|
| conjunctivitis |
|
Hartaandoeningen |
|
| tachycardie |
|
Bloedvataandoeningen |
| migraine | phlebitis |
|
Maagdarmstelsel-aandoeningen | misselijkheid | buikpijn | vergrote (onder)buik |
|
Lever- en galaandoeningen |
|
| pijn aan de galwegen of galblaas |
|
Huid- en onderhuid-aandoeningen |
| acne | chloasma | erythema |
Skeletspierstelsel- en bindweefselaandoeningen |
| rugpijn |
|
|
Voortplantingsstelsel- en borstaandoeningen | pijn in de borst | vaginale candidiasis | dyspareunie |
|
Algemene aandoeningen en toedieningsplaatsstoornissen |
| asthenie | malaise |
|
Onderzoeken |
| toename lichaamsgewicht | afname lichaamsgewicht |
|
*onregelmatig bloedverlies neemt gewoonlijk af met het voortzetten van de behandeling
Beschrijving van geselecteerde bijwerkingen
Er is een verhoogd risico waargenomen op arteriële en veneuze trombotische en trombo-embolische voorvallen, waaronder myocardinfarct, beroerte, transiënte ischemische aanvallen, veneuze trombose en longembolie bij vrouwen die gecombineerde hormonale anticonceptiva gebruikten. Hier wordt in rubriek 4.4 dieper op ingegaan.
De volgende ernstige bijwerkingen, welke besproken zijn in rubriek 4.4 “Bijzondere waarschuwingen en voorzorgen bij gebruik”, zijn gerapporteerd bij gebruiksters van combinatie-OAC’s:
- veneuze trombo-embolieën
- arteriële trombo-embolieën
- hypertensie
- levertumoren
- aandoeningen die kunnen optreden of verslechteren, waarvan geen eenduidig verband is aangetoond met het gebruik van combinatie-OAC's: ziekte van Crohn, colitis ulcerosa, epilepsie, uterusmyomen, porfyrie, systemische lupus erythematodes, herpes gestationis, chorea van Sydenham, hemolytisch-uremisch syndroom, cholestatische geelzucht.
- chloasma
- acute of chronische leverfunctiestoornissen kunnen het noodzakelijk maken het gebruik van combinatie-OAC's te staken totdat de leverfunctieparameters weer zijn genormaliseerd.
De frequentie van de diagnose borstkanker is heel licht toegenomen bij gebruiksters van combinatie-OAC’s. Omdat borstkanker zelden voorkomt bij vrouwen onder de 40, is het aantal extra gevallen klein vergeleken met het levenslange risico van borstkanker. Een oorzakelijk verband met combinatie-OAC’s is onbekend. Voor meer informatie, zie de rubrieken 4.3 en 4.4.
Interacties
Doorbraakbloeding en/of mislukken van de anticonceptie kunnen te wijten zijn aan interacties tussen andere geneesmiddelen (enzyminductoren) en orale anticonceptiva (zie rubriek 4.5).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Bayer SA-NV
Kouterveldstraat 7A 301
B-1831 Diegem (Machelen)
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
België: BE321386
Luxemburg: 2008090015
1x 28 tabletten 0491184
3x 28 tabletten 0492536
6x 28 tabletten 0492553
13x 28 tabletten 0572221
10. DATUM VAN HERZIENING VAN DE TEKST
Goedkeuringsdatum: 02/2025
[1] Deze incidenties werden geschat op basis van alle epidemiologische onderzoeksgegevens samen, met gebruik van relatieve risico's voor de verschillende producten, vergeleken met levonorgestrelbevattende gecombineerde hormonale anticonceptiva.
[2] Middelste punt van het bereik ('mid-point of range') van 5‑7 per 10.000 vrouwjaren, op basis van een relatief risico voor levonorgestrelbevattende gecombineerde hormonale anticonceptiva versus niet-gebruik van ongeveer 2,3 tot 3,6
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2551877 | YAZ 0,02 MG/3 MG FILMOMH TABL 3 X 28 | G03AA12 | € 34,81 | - | Ja | € 25,81 | € 25,81 |
| 2677417 | YAZ 0,02 MG/3 MG FILMOMH TABL 13 X 28 | G03AA12 | € 116,85 | - | Ja | € 77,85 | € 77,85 |
| 2677425 | YAZ 0,02 MG/3 MG FILMOMH TABL 6 X 28 | G03AA12 | € 59,42 | - | Ja | € 41,42 | € 41,42 |