SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
DEPO-ELIGARD 45 mg, poeder en oplosmiddel voor oplossing voor injectie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Een voorgevulde spuit met poeder voor oplossing voor injectie bevat 45 mg leuprorelineacetaat, equivalent aan 41,7 mg leuproreline.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder en oplosmiddel voor oplossing voor injectie.
Poeder (spuit B):
Voorgevulde spuit met wit tot gebroken wit poeder.
Oplosmiddel (spuit A):
Voorgevulde spuit met een klare, kleurloze tot lichtgele oplossing
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
DEPO-ELIGARD 45 mg is geïndiceerd voor de behandeling van hormoonafhankelijke gevorderde prostaatkanker en voor de behandeling van lokale hormoonafhankelijke prostaatkanker met een hoog risico en lokaal gevorderde hormoonafhankelijke prostaatkanker in combinatie met radiotherapie.
4.2 Dosering en wijze van toediening
Dosering
Volwassen mannen
DEPO-ELIGARD 45 mg dient toegediend te worden onder toezicht van een professionele gezondheidszorgverstrekker die over de gepaste ervaring beschikt om de respons op de behandeling te kunnen volgen.
DEPO-ELIGARD 45 mg wordt toegediend als een enkele subcutane injectie elke zes maanden. De geïnjecteerde oplossing vormt een vast geneesmiddelendepot en geeft gedurende een periode van zes maanden continu leuprorelineacetaat af.
Als algemene regel houdt een therapie voor gevorderde prostaatkanker met DEPO-ELIGARD 45 mg een langetermijnbehandeling in en deze therapie mag niet gestopt worden bij remissie of verbetering.
DEPO-ELIGARD 45 mg kan worden gebruikt als neoadjuvante of adjuvante behandeling in combinatie met radiotherapie bij lokale prostaatkanker met een hoog risico en lokaal gevorderde prostaatkanker.
Het antwoord op DEPO-ELIGARD 45 mg moet gevolgd worden aan de hand van klinische parameters en door de hoeveelheden van het prostaatspecifieke antigeen (PSA) in het serum te meten. Klinische studies hebben aangetoond dat de testosteronwaarden stegen gedurende de eerste 3 dagen van de behandeling bij de meerderheid van niet-gecastreerde patiënten en dat ze daarna in 3 tot 4 weken daalden tot onder de medische castratiespiegels. Eens bereikt, werden de castratiespiegels behouden zolang de behandeling werd voortgezet (<1 % doorbraak van testosteron). Wanneer het antwoord van een patiënt suboptimaal lijkt, zou moeten bevestigd worden dat de serumtestosteronwaarden het castratieniveau bereikt hebben of op dat niveau behouden blijven.
Aangezien een gebrek aan effectiviteit het gevolg kan zijn van onjuiste bereiding, reconstitutie of toediening, moeten in gevallen van vermoede of bekende onjuiste handelingen de testosteronwaarden worden geëvalueerd (zie rubriek 4.4).
Bij patiënten met uitgezaaide castratieresistente prostaatkanker, die niet operatief zijn gecastreerd, en die een GnRH-agonist, zoals leuproreline krijgen, en die in aanmerking komen voor behandeling met androgene biosyntheseremmers of androgene receptorremmers, kan de behandeling met een GnRH- agonist worden voortgezet.
Pediatrische patiënten
De veiligheid en werkzaamheid van DEPO-ELIGARD 45 mg bij kinderen van 0 tot 18 jaar zijn niet vastgesteld (zie ook rubriek 4.3)
Specifieke patiëntengroepen
Er werden geen klinische studies uitgevoerd bij patiënten met een gestoorde lever- of nierfunctie.
Wijze van toediening
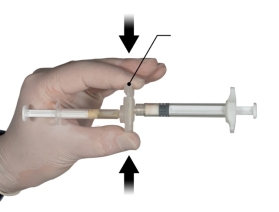
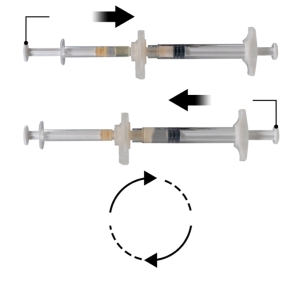
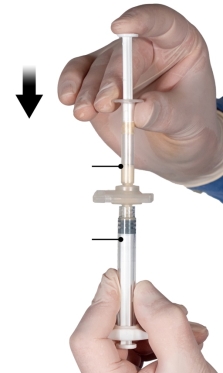
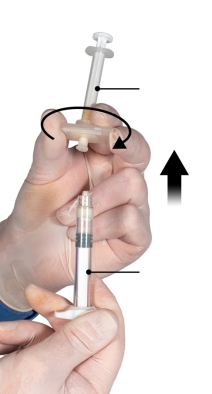
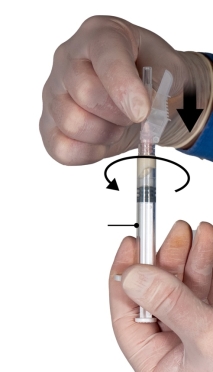
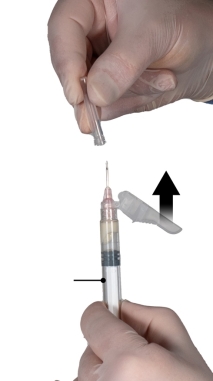
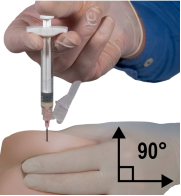
Depo-Eligard 45 mg mag uitsluitend worden bereid, gereconstitueerd en toegediend door zorgverleners die bekend zijn met deze procedures. De instructies voor reconstitutie en toediening dienen nauwgezet te worden opgevolgd (zie rubriek 4.4 en 6.6). Als het product niet op de juiste wijze wordt bereid, mag het niet worden toegediend.
De inhoud van de twee voorgevulde steriele spuiten moet gemengd worden onmiddellijk voor de toediening van DEPO-ELIGARD 45 mg door subcutane injectie.
Intra-arteriële of intraveneuze injecties moeten strikt vermeden worden. Dit is gebleken uit de ervaring met dieren.
Zoals met andere geneesmiddelen die door een subcutane injectie worden toegediend, moet de injectieplaats regelmatig afgewisseld worden.
4.3 Contra-indicaties
DEPO-ELIGARD 45 mg is gecontra-indiceerd bij vrouwen en kinderen.
Overgevoeligheid voor leuprorelineacetaat, voor andere GnRH-agonisten of voor (één van) de in rubriek 6.1 vermelde hulpstof(fen).
Bij patiënten die voorafgaand gecastreerd werden (net als andere GnRH-agonisten geeft DEPO-ELIGARD 45 mg geen verdere daling van het testosterongehalte in het geval van chirurgische castratie).
Als enige behandeling van prostaatkanker bij patiënten met samendrukking van het ruggenmerg of aangetoonde metastasen in het ruggenmerg (zie ook rubriek 4.4)
4.8 Bijwerkingen
Bijwerkingen die werden gezien met DEPO-ELIGARD zijn voornamelijk toe te schrijven aan de specifieke farmacologische werking van leuproreline, met name stijging en daling van bepaalde hormoonconcentraties. De meest beschreven bijwerkingen zijn warmteopwellingen, misselijkheid, een gevoel van onbehagen en vermoeidheid en voorbijgaande lokale irritatie op de injectieplaats. Milde of gematigde warmteopwellingen komen voor bij ongeveer 58% van de patiënten.
Overzicht van bijwerkingen in tabelvorm
De volgende bijwerkingen werden gerapporteerd tijdens klinische studies met DEPO-ELIGARD bij patiënten met gevorderde prostaatkanker. Bijwerkingen worden geklasseerd volgens frequentie als volgt: zeer vaak (≥1/10), vaak (≥1/100, <1/10), soms (≥1/1000, <1/100), zelden (≥1/10.000, <1/1000) en zeer zelden (<1/10.000) of niet gekend (kan niet geschat worden op basis van beschikbare gegevens).
Tabel 1: Bijwerkingen in klinische studies met Depo-Eligard | |
Infecties en parasitaire aandoeningen |
|
vaak | nasofaryngitis |
soms | urineweginfectie, lokale huidinfectie |
Voedings- en stofwisselingsstoornissen |
|
soms | verergering van diabetes mellitus |
Psychische stoornissen |
|
soms | abnormale dromen, depressie, verminderd libido |
Zenuwstelselaandoeningen |
|
| |
soms | duizeligheid, hoofdpijn, slapeloosheid, verstoring van smaak- en reukzin, hypoaesthesie, vertigo |
zelden | abnormale onwillekeurige bewegingen |
Hartaandoeningen | |
Bloedvataandoeningen |
|
zeer vaak | warmteopwellingen |
soms | hypertensie, hypotensie |
zelden | syncope, collaps |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen |
|
soms | rinorroe, dyspneu |
Maagdarmstelselaandoeningen |
|
vaak | misselijkheid, diarree, gastro-enteritis/colitis |
soms | constipatie, droge mond, dyspepsie, braken |
zelden | flatulentie, oprispingen |
Huid- en onderhuidaandoeningen |
|
zeer vaak | ecchymoses, erytheem |
vaak | pruritus, nachtelijk zweten |
soms | klamheid, verhoogd zweten |
zelden | alopecie, huideruptie |
Skeletspierstelsel- en bindweefselaandoeningen |
|
vaak | arthralgie, pijn in de ledematen, myalgie, stijfheid, slapheid |
soms | rugpijn, spierkrampen |
Nier- en urinewegaandoeningen |
|
vaak | weinig plassen, moeilijke urinelozing, dysurie, nocturie, verminderde urineproductie |
soms | blaaskrampen, bloedplassen, verhoogde plasfrequentie, urineretentie |
Voortplantingsstelsel- en borstaandoeningen |
|
vaak | gevoelige borsten, testiculaire atrofie, pijn in de teelballen, onvruchtbaarheid, hypertrofie van de borsten, erectiele dysfunctie, verminderde penisgrootte |
soms | gynaecomastie, impotentie, testiculaire aandoeningen |
zelden | pijnlijke borsten |
Algemene aandoeningen en toedieningsplaatsstoornissen |
|
zeer vaak | vermoeidheid, branderig gevoel op de plaats van de injectie, paresthesie op de plaats van de injectie |
vaak | malaise, pijn op de plaats van injectie, blauwe plekken op de plaats van injectie, een stekend gevoel op de plaats van injectie |
soms | jeuk op de plaats van de injectie, injectieplaatsverharding, lethargie, pijn, koorts |
zelden | zweren op de plaats van de injectie |
zeer zelden | necrose op de plaats van de injectie |
Bloed- en lymfestelselaandoeningen |
|
vaak | veranderingen in het bloedbeeld, anemie |
Onderzoeken |
|
vaak | verhoogde creatinine fosfokinase bloedspiegels, verlengde bloedstollingstijd |
soms | verhoogd alanine aminotransferase, verhoogd bloedtriglyceridengehalte, verlengde prothrombinetijd, gewichtstoename |
Andere bijwerkingen die algemeen vastgesteld werden tijdens een behandeling met leuprorelineacetaat omvatten perifeer oedeem, pulmonaire embolie, palpitaties, myalgie, spierzwakte, wijziging in de huidsensatie, rillingen, uitslag, amnesie en gezichtsstoornissen. Spieratrofie werd waargenomen bij langdurig gebruik van de producten van deze klasse. Een infarct van reeds voorafbestaande hypofysaire adenomen werd zelden gerapporteerd na toediening van zowel lang- als kortwerkende GnRH-agonisten. Er zijn zeldzame rapporten van trombocytopenie en leukopenie. Veranderingen in glucosetolerantie werden gerapporteerd.
Convulsies werden gemeld na toediening van GnRH-agonistanalogen (zie rubriek 4.4).
Lokale bijwerkingen die werden beschreven na de injectie van DEPO-ELIGARD 45 mg zijn vergelijkbaar met deze die frequent geassocieerd worden met gelijkaardige subcutaan te injecteren preparaten.
Algemeen zijn deze lokale bijwerkingen na subcutane injectie mild en beschreven als zijnde van korte duur.
Anafylactische/anafylactoïde reacties werden zelden gemeld na toediening van GnRH-agonistanalogen.
Veranderingen in botdensiteit
Verminderde botdensiteit bij mannen wordt gerapporteerd in de medische literatuur na castratie of na behandeling met een GnRH-analoog. Het kan verwacht worden dat een langetermijnbehandeling met leuproreline een stijging van de tekens van osteoporose kan veroorzaken. Wat het verhoogde risico op breuken door osteoporose betreft, zie rubriek 4.4.
Opflakkering van de tekenen en symptomen van de ziekte
Een behandeling met leuproreline kan opflakkeringen van de tekenen en symptomen van de ziekte veroorzaken gedurende de eerste behandelingsweken. Wanneer vertebrale metastasen en/of urinewegobstructie of hematurie verergeren, kunnen neurologische problemen optreden zoals zwakte en/of paresthesie van de onderste ledematen of verslechtering van de urinaire symptomen.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem.
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Matteo Civitali, 1
I-20148 Milano
Italië
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE 314973
10. DATUM VAN HERZIENING VAN DE TEKST:
Datum van goedkeuring: 10/2024.
| Pagina 1 van 17 |
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 2544880 | DEPO ELIGARD 45,0 MG PULV SOL INJ 1 | L02AE02 | € 455,47 | - | Ja | - | - |