SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
BOTOX
100 Allerganeenheden
poeder voor oplossing voor injectie
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
botulinumtoxine* type A, 100 Allerganeenheden/injectieflacon.
* van Clostridium botulinum
Botulinumtoxine-eenheden van verschillende producten zijn niet onderling uitwisselbaar.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder voor oplossing voor injectie.
Wit poeder.
BOTOX verschijnt als een dunne witte afzetting die op de bodem van de injectieflacon moeilijk zichtbaar kan zijn.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Neurologische aandoeningen:
BOTOX is geïndiceerd voor de symptomatische behandeling van:
- Focale spasticiteit van de enkel en voet bij ambulante kinderen van twee jaar of ouder met hersenverlamming als aanvulling op revalidatietherapie.
- Focale spasticiteit van de pols en de hand bij volwassen patiënten die een CVA hebben doorgemaakt.
- Focale spasticiteit van de enkel en de voet bij volwassen patiënten die een CVA hebben doorgemaakt (zie rubriek 4.4).
- Blefarospasmen, hemifacialisspasmen en geassocieerde focale dystonieën.
- Cervicale dystonie (spasmodische torticollis).
- Symptoomverlichting bij volwassenen die voldoen aan de criteria voor chronische migraine (hoofdpijn op ≥15 dagen per maand, waarbij deze op minstens 8 dagen gepaard gaat met migraine) bij patiënten die onvoldoende hebben gereageerd op of intolerant zijn voor profylactische geneesmiddelen tegen migraine (zie rubriek 4.4).
BOTOX is geïndiceerd voor de behandeling van:
Blaasaandoeningen:
- Idiopathische overactieve blaas met symptomen van urine-incontinentie, urgency en pollakisurie bij volwassen patiënten die onvoldoende reageren op anticholinergica of die deze geneesmiddelen niet verdragen.
- Urine-incontinentie bij volwassenen met neurogene detrusoroveractiviteit bij een neurogene blaas door stabiel subcervicaal ruggenmergletsel of multipele sclerose.
Huid en huidgerelateerde aandoeningen:
- Persistente ernstige primaire hyperhidrose van de oksels die het dagelijks leven verstoort en niet reageert op topische behandeling.
4.2 Dosering en wijze van toediening
Dosering
Botulinumtoxine-eenheden van verschillende producten zijn niet onderling uitwisselbaar. De doses die worden aanbevolen in Allerganeenheden zijn niet dezelfde als die van andere preparaten van botulinumtoxine.
Een neuroloog die expert is in de behandeling van chronische migraine dient de diagnose van chronische migraine te stellen en BOTOX mag uitsluitend worden toegediend onder toezicht van een dergelijke neuroloog.
Oudere patiënten
Er is geen specifieke dosisaanpassing vereist voor het gebruik bij ouderen. De initiële dosering dient de laagste effectieve dosis voor de specifieke indicatie te zijn. Bij herhaal-injecties wordt de laagste doeltreffende dosis met het langste, klinisch aangewezen interval tussen injecties aanbevolen. Oudere patiënten met een significante medische voorgeschiedenis en die tegelijkertijd andere geneesmiddelen gebruiken, moeten met voorzichtigheid worden behandeld. Er zijn beperkte klinische gegevens bij patiënten ouder dan 65 jaar die met BOTOX worden behandeld voor spasticiteit van de bovenste en onderste ledematen na een CVA. Zie rubriek 4.4, 4.8 en 5.1 voor meer informatie.
Pediatrische patiënten
De veiligheid en werkzaamheid van BOTOX bij de indicaties, andere dan degene beschreven voor de pediatrische patiënten in rubriek 4.1 zijn niet vastgesteld. Er kan geen doseringsadvies worden gegeven voor andere indicaties dan pediatrische focale spasticiteit geassocieerd met hersenverlamming. Voor deze indicatie mag BOTOX alleen worden toegediend door artsen die ervaring hebben met de beoordeling en behandeling van pediatrische focale spasticiteit en als onderdeel van een gestructureerd revalidatieprogramma.
De momenteel beschikbare gegevens bij pediatrische patiënten worden beschreven in rubriek 4.2, 4.4, 4.8 en 5.1, zoals beschreven in onderstaande tabel.
| 12 jaar (zie rubriek 4.4 en 4.8) | |
| 12 jaar (zie rubriek 4.4 en 4.8) | |
| 2 jaar (zie rubriek 4.2, 4.4 en 4.8) | |
| 12 jaar | |
| 5 – 17 jaar (zie rubriek 4.8 en 5.1) | |
| 12 – 17 jaar (zie rubriek 4.8 en 5.1) | |
De volgende informatie is belangrijk:
Als verschillende injectieflacongrootten van BOTOX worden gebruikt bij dezelfde injectieprocedure, moet er op gelet worden dat de juiste hoeveelheid verdunningsmiddel wordt gebruikt om een bepaald aantal eenheden per 0,1 ml te reconstitueren. De hoeveelheid verdunningsmiddel verschilt voor BOTOX 50 Allerganeenheden, BOTOX 100 Allerganeenheden en BOTOX 200 Allerganeenheden. Elke spuit moet dienovereenkomstig worden voorzien van een etiket.
BOTOX mag alleen gereconstitueerd worden met een steriele niet-geconserveerde 0,9% natriumchloride oplossing voor injectie. De juiste hoeveelheid verdunningsmiddel moet in een spuit worden opgetrokken. Zie de verdunningstabellen in rubriek 6.6.
Dit product is bestemd voor eenmalig gebruik en eventuele ongebruikte oplossing moet worden weggegooid.
Voor instructies over het gebruik, de hantering en de verwijdering van injectieflacons, zie rubriek 6.6.
Wijze van toediening
Zie voor elke indicatie de specifieke richtlijnen die hieronder worden beschreven.
BOTOX dient enkel te worden toegediend door artsen met de juiste kwalificaties en ervaring met de behandeling, en het gebruik van de benodigde apparatuur.
De algemeen geldende optimale dosisniveaus en het aantal injectieplaatsen per spier werden niet voor alle indicaties bepaald. In deze gevallen moeten daarom individuele behandelingsschema's door de arts worden opgesteld. Het optimale dosisniveau dient met behulp van titratie vastgesteld te worden, maar de aanbevolen maximale dosis mag niet overschreden worden.
NEUROLOGISCHE AANDOENINGEN:
Focale spasticiteit van het onderste ledemaat bij pediatrische patiënten
Aanbevolen naald: | Steriele naald met juiste maatvoering. De lengte van de naald moet worden bepaald op basis van de plaats en de diepte van de spier. | |||
|
| |||
Toedieningsrichtlijn: | Lokalisatie van de betrokken spieren met technieken zoals elektromyografische (EMG) begeleiding van de naald, zenuwstimulatie of echografie wordt aanbevolen. Voorafgaand aan de injectie kan lokale anesthesie of lokale anesthesie in combinatie met minimale of matige sedatie worden toegepast, afhankelijk van de lokale praktijk. De veiligheid en werkzaamheid van BOTOX bij de behandeling van pediatrische spasticiteit is niet geëvalueerd onder algemene verdoving of diepe sedatie/analgesie. | |||
|
| |||
Aanbevolen dosis: | De aanbevolen dosis voor de behandeling van pediatrische spasticiteit van de onderste ledematen is 4 eenheden/kg tot 8 eenheden/kg lichaamsgewicht verdeeld over de aangetaste spieren. | |||
Geïnjecteerde spieren | BOTOX 4 eenheden/kg* | BOTOX 8 eenheden/kg** | Aantal Injectieplaatsen | |
Verplichte enkelspieren | 1 eenheid/kg (37,5 eenheden) | 2 eenheden/kg (75 eenheden) | 2 | |
Gastrocnemius laterale kop | 1 eenheid/kg (37,5 eenheden) | 2 eenheden/kg (75 eenheden) | 2 | |
Soleus | 1 eenheid/kg (37,5 eenheden) | 2 eenheden/kg (75 eenheden) | 2 | |
Tibialis posterior | 1 eenheid/kg (37,5 eenheden) | 2 eenheden/kg (75 eenheden) | 2 | |
| * niet hoger dan een totale dosis van 150 eenheden | |||
Maximale totale dosis: | De totale dosis BOTOX die per behandelingssessie in het onderste ledemaat wordt toegediend, mag niet hoger zijn dan 8 eenheden/kg lichaamsgewicht of 300 eenheden, afhankelijk van welke van de twee het laagst is. Indien de behandelende arts dit nodig acht, dient de patiënt in aanmerking te komen voor herinjectie wanneer het klinische effect van de vorige injectie is afgenomen, niet eerder dan 12 weken na de vorige injectie. Bij de behandeling van beide onderste ledematen mag de totale dosis niet hoger zijn dan de laagste van 10 eenheden/kg lichaamsgewicht of 340 eenheden, met een interval van 12 weken. | |||
|
| |||
Bijkomende informatie: | De behandeling met BOTOX is niet bedoeld ter vervanging van de gebruikelijke standaard van zorgrevalidatieschema’s. Gewoonlijk wordt een klinische verbetering gezien binnen de eerste twee weken na injectie. Herhaalbehandelingen kunnen toegediend worden wanneer het klinische effect van een vorige injectie vermindert, maar niet frequenter dan iedere drie maanden. | |||
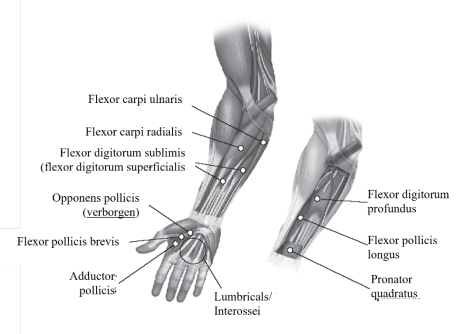
Focale spasticiteit van de bovenste ledematen geassocieerd met CVA bij volwassenen
Aanbevolen naald: | Steriele naald van 25, 27 of 30 gauge. De lengte van de naald dient bepaald te worden op basis van de plaats en de diepte van de spier. |
|
|
Toedieningsrichtlijn: | Het kan nuttig zijn de betrokken spieren te lokaliseren met elektromyografie of zenuwstimulatie- of ultrasone technieken. Injectie van BOTOX op meerdere plaatsen resulteert in een gelijkmatiger contact met de bezenuwingszones van de spier, wat vooral nuttig is in grotere spieren. |
|
|
Aanbevolen dosis: | De aanbevolen dosis voor de behandeling van spasticiteit van de bovenste ledematen bij volwassenen is maximaal 240 eenheden, verdeeld over de aangetaste spieren, zoals vermeld in de volgende tabel. De maximale dosis bij één behandeling is 240 eenheden. |
|
Spier | Aanbevolen dosis; Aantal injectieplaatsen |
Onderarm
Pronator quadratus
10 - 50 eenheden; 1 plaats
Pols | |
Vingers/Hand | |
Duim | |
*Wanneer zowel in lumbricalen en/of interossei wordt geïnjecteerd, is de aanbevolen maximale dosis 50 eenheden per hand.
Bijkomende informatie:
In gecontroleerde klinische studies werden de patiënten 12 weken gevolgd na een eenmalige behandeling. Verbetering in spiertonus trad op binnen twee weken, waarbij het maximale effect meestal binnen vier tot zes weken werd gezien. In een open-label vervolgonderzoek werden de meeste patiënten opnieuw geïnjecteerd na een interval van 12 tot 16 weken, wanneer het effect op de spiertonus was afgenomen. Deze patiënten kregen tot vier injecties met een maximale cumulatieve dosis van 960 eenheden verspreid over 54 weken. Als de behandelende arts dat wenselijk acht, kunnen herhalingsdoses worden toegediend wanneer het effect van een vorige injectie minder is geworden, niet eerder dan 12 weken na de vorige injectie. Afhankelijk van de mate en de aard van de spierspasticiteit op het ogenblik van herhalingsinjectie kan het noodzakelijk zijn de dosis van BOTOX aan te passen en andere spieren te injecteren. De laagste werkzame dosis dient te worden gebruikt.
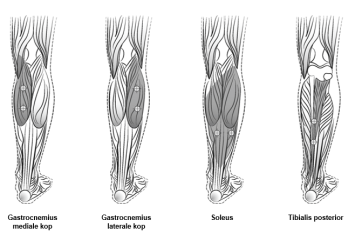
Focale spasticiteit van de onderste ledematen geassocieerd met CVA bij volwassenen
Aanbevolen naald: | Steriele naald van 25, 27 of 30 gauge. Lengte van de naald dient bepaald te worden volgens plaats en diepte van de spier. |
Toedieningsrichtlijn: | Het kan nuttig zijn de betrokken spieren te lokaliseren met elektromyografie of zenuwstimulatietechnieken. Meerdere injectieplaatsen kunnen ervoor zorgen dat Botox een gelijkmatiger contact heeft met de bezenuwingszones van de spier, en zijn vooral nuttig voor grotere spieren. |
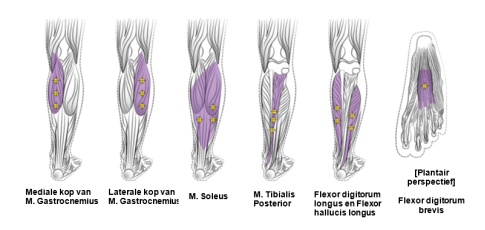
Aanbevolen dosis: | De aanbevolen dosis voor de behandeling van spasticiteit van de onderste ledematen bij volwassenen waarbij de enkel en de voet betrokken zijn, bedraagt 300 eenheden tot 400 eenheden, verdeeld over hoogstens 6 spieren, zoals beschreven in onderstaande tabel. De maximale aanbevolen dosis in één behandeling is 400 eenheden. |
Spier | Aanbevolen dosis |
Gastrocnemius | |
Soleus | 75 eenheden; 3 plaatsen |
Tibialis posterior | 75 eenheden; 3 plaatsen |
Flexor hallucis longus | 50 eenheden; 2 plaatsen |
Flexor digitorum longus | 50 eenheden; 2 plaatsen |
Flexor digitorum brevis | 25 eenheden; 1 plaats |
Bijkomende informatie: | Indien de behandelende arts dit gepast acht, moet de patiënt in beschouwing genomen worden voor herhaalde injectie wanneer het klinische effect van de voorgaande injectie verminderd is, maar niet eerder dan 12 weken na de vorige injectie. |
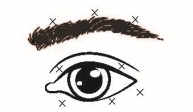
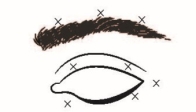
Blefarospasme/ hemifacialisspasme
Aanbevolen naald: | Steriele naald van 27-30 gauge/0,40-0,30 mm. | |||||
|
| |||||
Toedieningsrichtlijn: | Elektromyografische begeleiding is niet vereist. | |||||
|
| |||||
Aanbevolen dosis: | De aanbevolen startdosis is 1,25-2,5 eenheden in de mediale en laterale m. orbicularis oculi van het bovenste ooglid en de laterale m. orbicularis oculi van het onderste ooglid. Men kan ook injecties geven op andere plaatsen in de zone van de wenkbrauwen, de laterale orbicularis en het bovenste gedeelte van het gelaat als spasmen daar het gezichtsvermogen verstoren. | |||||
|
| |||||
Maximale totale dosis: | De startdosis mag niet hoger zijn dan 25 eenheden per oog. | |||||
|
| |||||
Bijkomende informatie: | Om het risico op ptose als complicatie te beperken, moeten injecties in de buurt van de m. levator palpebrae superioris worden vermeden. Om het risico op diplopie als complicatie te beperken, moeten injecties in het mediale gedeelte van het onderste ooglid worden vermeden, zodat diffusie naar de m. obliquus inferior wordt beperkt. De volgende tekeningen tonen de mogelijke injectieplaatsen:
| |||||
|
|
| ||
Mediaal
Lateraal
Mediaal
Lateraal
Over het algemeen wordt het eerste effect van de injecties gezien binnen drie dagen en is het effect maximaal één tot twee weken na de behandeling. Het effect van elke behandeling houdt ongeveer drie maanden aan, waarna de procedure zo nodig kan worden herhaald. Bij herbehandelingssessies kan de dosis tot het dubbele worden verhoogd als de respons op de initiële behandeling onvoldoende wordt geacht. Injectie van meer dan 5 eenheden per plaats blijkt echter weinig extra voordeel op te leveren. Normaal wordt geen bijkomend voordeel behaald door vaker te behandelen dan eens in de drie maanden.
Patiënten met een hemifacialisspasme of stoornissen van zenuw VII moeten worden behandeld zoals voor een unilateraal blefarospasme, met zo nodig injectie van andere aangetaste gelaatsspieren (bijv. de m. zygomaticus major, de m. orbicularis oris).
Cervicale dystonie
Aanbevolen naald: | Een naald met juiste maatvoering (gewoonlijk 25-30 gauge/0,50-0,30 mm). |
|
|
Toedieningsrichtlijn: | In klinische studies werd bij de behandeling van cervicale dystonie BOTOX gewoonlijk geïnjecteerd in de m. sternocleidomastoideus, de m. levator scapulae, de m. scalenus, de m. splenius capitis, de m. semispinalis, de m. longissimus en/of de m. trapezius. Deze lijst is niet exhaustief, aangezien elke spier die de positie van het hoofd controleert, aangetast kan zijn en dus behandeling nodig kan hebben. |
|
|
Aanbevolen dosis: | Bij de eerste behandelingssessie mag in totaal niet meer dan 200 eenheden worden geïnjecteerd. Bij de volgende sessies wordt de dosering aangepast volgens de initiële respons. |
|
|
Maximale totale dosis: | Per sessie mogen in totaal niet meer dan 300 eenheden per dosis worden gegeven. Het optimale aantal injectieplaatsen hangt af van de grootte van de spier. Een behandelingsinterval van minder dan 10 weken wordt niet aanbevolen. |
|
|
Bijkomende informatie: | Doorgaans wordt een klinische verbetering gezien binnen de eerste twee weken na injectie. De effecten zijn doorgaans maximaal ongeveer zes weken na de injectie. De duur van de gunstige effecten die in klinische studies werd gerapporteerd, schommelde sterk (van 2 tot 33 weken), met doorgaans een duur van ongeveer 12 weken. |
Chronische migraine
Aanbevolen naald: | Steriele naald van 30-gauge, 1,27 cm. |
|
|
Toedieningsricht- lijn: | De injecties moeten worden verdeeld over 7 specifieke spiergroepen van hoofd en nek, zoals aangegeven in de onderstaande tabel. Bij patiënten met bijzonder dikke nekspieren kan in de nek een naald van 2,54 cm nodig zijn. Met uitzondering van de musculus procerus die op 1 plaats moet worden geïnjecteerd (middenlijn), moeten alle spieren tweezijdig worden geïnjecteerd, waarbij de helft van de injecties aan de linkerkant en de andere helft aan de rechterkant van hoofd en nek worden toegediend. Als een bepaalde pijnlocatie overheerst, kunnen aan één of aan beide kanten extra injecties worden toegediend aan tot 3 specifieke spiergroepen (occipitalis, temporalis en trapezius), tot de maximale dosis per spier zoals aangegeven in de tabel hieronder. |

![]()
![]()
![]()
![]()
![]()
![]()
![]()
De volgende afbeeldingen geven de aanbevolen spiergroepen aan voor eventuele bijkomende injecties:

![]()
![]()
![]()
|
| ||
Hoofd/Nek | Totale dosering (aantal plaatsen*) |
Corrugator**
10 eenheden (2 plaatsen)
Procerus
5 eenheden (1 plaats)
Frontalis**
20 eenheden (4 plaatsen)
Temporalis**
40 eenheden (8 plaatsen) tot 50 eenheden (tot 10 plaatsen)
Occipitalis**
30 eenheden (6 plaatsen) tot 40 eenheden (tot 8 plaatsen)
Cervicale Paraspinale Spier Groep**
20 eenheden (4 plaatsen)
Trapezius**
30 eenheden (6 plaatsen) tot 50 eenheden (tot 10 plaatsen)
Totaal doseringsbereik:
155 eenheden tot 195 eenheden
31 tot 39 plaatsen
* 1 IM injectieplaats = 0,1 ml = 5 eenheden BOTOX
** Dosis verdeeld over twee zijden
Bijkomende informatie:
Het aanbevolen schema voor herhaling van de behandeling is om de 12 weken.
BLAASAANDOENINGEN:
Patiënten mogen geen urineweginfectie hebben wanneer de behandeling zal plaatsvinden.
Patiënten dienen profylactisch behandeld te worden met antibiotica gedurende 1-3 dagen vóór de behandeling, op de dag van behandeling en 1-3 dagen na de behandeling.
Het verdient aanbeveling om ten minste 3 dagen voorafgaand aan de injectieprocedure geen anticoagulantia meer te gebruiken. Patiënten onder antistollingsbehandeling moeten aandachtig gevolgd worden om het risico op bloedingen te verminderen.
Bij de behandeling van urine-incontinentie moet BOTOX worden toegediend door artsen die ervaring hebben met de evaluatie en de behandeling van blaasdisfunctie (bijv. urologen en urogynaecologen).
Overactieve blaas:
Aanbevolen naald: | Flexibele of rigide cystoscoop kan worden gebruikt. De injectienaald moet worden gevuld (geprimed) met ongeveer 1 ml gereconstitueerde BOTOX vóór de start van de injecties (afhankelijk van de lengte van de naald) om eventuele lucht te verwijderen. |
|
|
| Vóór injectie kan een verdund topisch anestheticum met of zonder sedatie in de blaas worden geïnstilleerd conform de lokale praktijkvoering. In geval van instillatie van een lokaal anestheticum moet de blaas vóór de volgende stappen van de procedure worden gedraineerd en gespoeld met steriele natriumchloride oplossing. |
| |
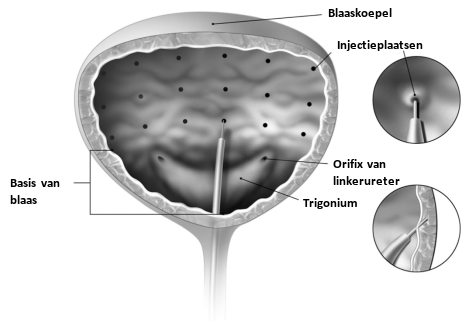
Aanbevolen dosis: | De aanbevolen dosis is 100 eenheden BOTOX als injecties van 0,5 ml (5 eenheden) op 20 plaatsen in de detrusor. |
|
|
Bijkomende informatie: | De klinische verbetering kan binnen 2 weken optreden. Patiënten komen in aanmerking voor een herinjectie wanneer het klinische effect van de vorige injectie afgenomen is (de mediane duur in de klinische fase 3-studies was 166 dagen (~24 weken), gebaseerd op de vraag van de patiënt voor een herbehandeling), maar niet vroeger dan 3 maanden na de vorige injectie in de blaas. |
Urine-incontinentie door neurogene detrusoroveractiviteit
Aanbevolen naald: | Flexibele of rigide cystoscoop kan worden gebruikt. De injectienaald moet voorafgaand aan de injecties met ongeveer 1 ml worden gevuld (afhankelijk van de naaldlengte) om aanwezige lucht te verwijderen. |
|
|
Toedieningsrichtlijn: | Voorafgaand aan de injectieprocedure kan een intravesicale instillatie van verdund anestheticum in de blaas worden geïnstilleerd (met of zonder sedatie), of algemene anesthesie worden toegepast, afhankelijk van de lokale praktijk. Als een lokaal anestheticum in de blaas wordt geïnstilleerd, dient de blaas te worden gedraineerd en gespoeld met een steriele natriumchloride oplossing vóór de volgende stappen van de injectieprocedure. |
|
|
Aanbevolen dosis: | De aanbevolen dosis is 200 eenheden BOTOX, als injecties van 1 ml (~6,7 eenheden) op 30 plaatsen, verspreid over de detrusor. |
|
|
Bijkomende informatie: | Klinische verbetering treedt in het algemeen op binnen 2 weken. Herhalingsinjectie dient te worden overwogen wanneer het klinische effect van de voorafgaande injectie is afgenomen (mediane duur in klinische fase 3-studies was 256-295 dagen (~36-42 weken) voor BOTOX 200 eenheden) gebaseerd op de vraag van de patiënt voor een herbehandeling, maar mag niet eerder plaatsvinden dan 3 maanden na de voorafgaande injectie in de blaas. |
HUID- EN HUIDGERELATEERDE AANDOENING:
Primaire hyperhidrose van de oksels
Aanbevolen naald: | Steriele naald van 30-gauge. |
|
|
Toedieningsrichtlijn: | De hyperhidrotische zone kan worden gedefinieerd met standaardkleurtechnieken, bv. de jodiumzetmeeltest van Minor. |
|
|
Aanbevolen dosis: | 50 eenheden BOTOX worden intradermaal geïnjecteerd, gelijkmatig verdeeld over meerdere plaatsen op ongeveer 1-2 cm van elkaar binnen de hyperhidrotische zone in elke oksel. |
|
|
Maximale totale dosis: | Andere doses dan 50 eenheden per oksel kunnen niet worden aanbevolen. De injecties mogen niet vaker dan om de 16 weken worden herhaald (zie rubriek 5.1). |
|
|
Bijkomende informatie: | Doorgaans treedt klinische verbetering op binnen de eerste week na injectie. Wanneer het klinische effect van een vorige injectie vermindert en als de behandelende arts dat nodig acht, kan een herhalingsinjectie van BOTOX worden toegediend. |
ALLE INDICATIES:
Als een eerste behandelingssessie geen resultaat oplevert, d.w.z. geen significante klinische verbetering één maand na injectie ten opzichte van de aanvang, moeten de volgende maatregelen worden genomen:
- Klinische controle met eventueel elektromyografisch onderzoek door een specialist van de werking van het toxine op de geïnjecteerde spier(en);
- Analyse van de oorzaken van mislukken van de behandeling, bv. slechte keuze van de te injecteren spieren, te lage dosis, slechte injectietechniek, een gefixeerde contractuur, te zwakke antagonistische spieren, vorming van toxineneutraliserende antistoffen;
- Herevaluatie van de geschiktheid van de behandeling met botulinumtoxine type A;
- Als er geen bijwerkingen zijn opgetreden als gevolg van de eerste behandelingssessie, kan een tweede behandelingssessie als volgt worden uitgewerkt: i) de dosis aanpassen, rekening houdend met de analyse van het mislukken van de eerdere behandeling; ii) gebruikmaken van een EMG; en iii) een interval handhaven van drie maanden tussen twee behandelingssessies.
Als de behandeling geen resultaat oplevert of als het effect bij herhaalinjecties vermindert, moet een alternatieve behandelingsmethode worden toegepast.
Bij de behandeling van volwassen patiënten, waaronder de behandeling voor meerdere indicaties, mag de maximale cumulatieve dosis niet hoger zijn dan 400 eenheden, met een interval van 12 weken.
4.3 Contra-indicaties
BOTOX is gecontra-indiceerd:
- bij personen met een bekende overgevoeligheid voor botulinumtoxine type A of voor een van de in rubriek 6.1 vermelde hulpstoffen;
- bij aanwezigheid van een infectie op de beoogde injectieplaats(en).
BOTOX ter behandeling van blaasaandoeningen is ook gecontra-indiceerd:
- bij patiënten met een urineweginfectie op het moment van behandeling;
- bij patiënten met acute urineretentie op het moment van behandeling, die niet routinematig worden gekatheteriseerd;
- bij patiënten die geen katheterisatie willen en/of kunnen ondergaan na de behandeling, mocht dat nodig zijn.
4.8 Bijwerkingen
Algemeen
In gecontroleerde klinische studies werden bijwerkingen gemeld die volgens de onderzoekers samenhingen met BOTOX bij 35% patiënten met blefarospasme, bij 28% met cervicale dystonie, bij 8% met pediatrische spasticiteit, bij 11% met primaire hyperhidrose van de oksels en bij 16% met focale spasticiteit van de bovenste ledematen door CVA en 15% met focale spasticiteit van de onderste ledematen door CVA. In klinische studies bij overactieve blaas was de incidentie 26% met de eerste behandeling en 22% met een tweede behandeling. Klinische studies voor neurogene detrusoroveractiviteit bij volwassenen vermeldden een incidentie van 32% bij de eerste behandeling en een lagere incidentie van 18% bij de tweede behandeling. Voor neurogene detrusoroveractiviteit bij kinderen was de incidentie 6,2% met de eerste behandeling. In klinische studies voor chronische migraine bedroeg de incidentie 26% bij de eerste behandeling en een lagere incidentie van 11% bij een tweede behandeling.
Bijwerkingen treden doorgaans op in de eerste dagen na injectie en hoewel ze gewoonlijk van voorbijgaande aard zijn, kunnen ze meerdere maanden of, in zeldzame gevallen, langer aanhouden.
Lokale spierzwakte vertegenwoordigt de verwachte farmacologische werking van botulinumtoxine in spierweefsel. Zwakte van aangrenzende spieren en/of spieren weg van de injectieplaats werden echter gemeld.
Zoals bij elke injectie kan worden verwacht, zijn gelokaliseerde pijn, ontsteking, paresthesie, hypo-esthesie, gevoeligheid, zwelling/oedeem, erytheem, gelokaliseerde infectie, bloeding en/of blauwe plekken in verband gebracht met de injectie. Pijn door en/of angst voor de naald hebben geresulteerd in vasovagale reactie, waaronder voorbijgaande symptomatische hypotensie en syncope. Koorts en een griepsyndroom werden eveneens gerapporteerd na injecties van botulinumtoxine.
De bijwerkingen zijn ingedeeld in de volgende categorieën, afhankelijk van hoe vaak ze voorkomen: zeer vaak (≥ 1/10), vaak (≥ 1/100 tot < 1/10), soms (≥ 1/1.000 tot < 1/100), zelden (≥ 1/10.000 tot < 1/1.000), zeer zelden (< 1/10.000), of niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Hieronder vindt u de lijsten met bijwerkingen, die variëren afhankelijk van het deel van het lichaam waar BOTOX werd geïnjecteerd.
NEUROLOGISCHE AANDOENINGEN:
Focale spasticiteit van het onderste ledemaat bij pediatrische patiënten
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Huid- en onderhuidaandoeningen | Huiduitslag | Vaak |
Skeletspierstelsel- en bindweefselaandoeningen | Spierzwakte | Soms |
Letsels, intoxicaties en verrichtingscomplicaties | Ligamentverstuiking, huidschaafwond | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Loopstoornis, pijn op de plaats van injectie | Vaak |
Focale spasticiteit van de bovenste ledematen geassocieerd met CVA bij volwassenen
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Maagdarmstelselaandoeningen | Nausea | Vaak |
Skeletspierstelsel- en bindweefselaandoeningen | Pijn in extremiteit, spierzwakte | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Vermoeidheid, perifeer oedeem | Vaak |
Bij herhaalde dosering werd geen verandering waargenomen in het algemene veiligheidsprofiel.
Focale spasticiteit van de onderste ledematen geassocieerd met CVA bij volwassenen
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Huid- en onderhuidaandoeningen | Huiduitslag | Vaak |
Skeletspierstelsel- en bindweefselaandoeningen | Artralgie, skeletspierstijfheid, spierzwakte | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | Perifeer oedeem | Vaak |
Letsels, intoxicaties en verrichtingscomplicaties | Vallen | Vaak |
Er werd geen verandering waargenomen in het algemeen veiligheidsprofiel bij herhaalde dosering.
Blefarospasme, hemifacialisspasmen en geassocieerde dystonie
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Zenuwstelselaandoeningen | Duizeligheid, facialisparese, facialisverlamming | Soms |
Oogaandoeningen | Ptose van het ooglid | Zeer vaak |
Keratitis punctata, lagophthalmos, droog oog, fotofobie, oogirritatie, traanproductie verhoogd | Vaak | |
Keratitis, ectropion, diplopie, entropion, visuele stoornis, wazig zicht | Soms | |
Oedeem van het ooglid | Zelden | |
Ulceratieve keratitis, cornea-epitheel defect, corneaperforatie | Zeer zelden | |
Huid- en onderhuidaandoeningen | Ecchymose | Vaak |
Huiduitslag/dermatitis | Soms | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Irritatie, gezichtsoedeem | Vaak |
Vermoeidheid | Soms |
Cervicale dystonie
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Infecties en parasitaire aandoeningen | Rhinitis, infectie van de bovenste luchtwegen | Vaak |
Zenuwstelselaandoeningen | Duizeligheid, hypertonie, hypo-esthesie, somnolentie, hoofdpijn | Vaak |
Oogaandoeningen | Diplopie, ptose van het ooglid | Soms |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Dyspneu, dysfonie | Soms |
Maagdarmstelselaandoeningen | Dysfagie | Zeer vaak |
Droge mond, nausea | Vaak | |
Skeletspierstelsel- en bindweefselaandoeningen | Spierzwakte | Zeer vaak |
Stijfheid en pijn van skeletspieren | Vaak | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Pijn | Zeer vaak |
Asthenie, griepachtige ziekte, malaise | Vaak | |
Pyrexie | Soms |
Chronische migraine
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Zenuwstelselaandoeningen | Hoofdpijn, migraine inclusief verergering van migraine, facialisparese | Vaak |
Oogaandoeningen | Ptose van het ooglid | Vaak |
Huid- en onderhuidaandoeningen | Pruritus, uitslag | Vaak |
Pijn t.h.v. de huid | Soms | |
Skeletspierstelsel- en bindweefselaandoeningen | Nekpijn, myalgie, stijfheid en pijn van skeletspieren, spierspasmen, strak aanvoelende spieren, spierzwakte | Vaak |
Pijn t.h.v. de kaak | Soms | |
Mephisto-effect (lateraal optrekken van de wenkbrauwen) | Niet bekend | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Pijn op de injectieplaats | Vaak |
Maagdarmstelselaandoeningen | Dysfagie | Soms |
Het uitvalpercentage vanwege bijwerkingen in deze fase-3-onderzoeken was 3,8% voor BOTOX ten opzichte van 1,2% voor placebo.
BLAASSTOORNISSEN:
Overactieve blaas bij volwassenen
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Infecties en parasitaire aandoeningen | Urineweginfectie | Zeer vaak |
Bacteriurie | Vaak | |
Nier- en urinewegaandoeningen | Dysurie | Zeer vaak |
Urineretentie, pollakisurie, leukocyturie | Vaak | |
Onderzoeken | Residuaal urinevolume* | Vaak |
*verhoogd residuaal urinevolume na urinelozing (post-void residual urine volume, PVR) waarvoor geen katheterisatie vereist is
Proceduregerelateerde bijwerkingen die vaak zijn opgetreden, waren dysurie en hematurie.
Een propere, intermitterende katheterisatie werd gestart bij 6,5% van de patiënten na behandeling met BOTOX 100 eenheden versus 0,4% in de placebogroep.
Van de 1.242 patiënten in de placebogecontroleerde klinische studies was 41,4% van de patiënten (n = 514) ≥ 65 jaar oud en 14,7% (n = 182) was ≥ 75 jaar oud. In die studies werd geen algeheel verschil in veiligheidsprofiel na behandeling met BOTOX waargenomen tussen patiënten ≥ 65 jaar vergeleken met patiënten < 65 jaar, met uitzondering van urineweginfectie, waarbij de incidentie zowel in de placebogroep als in de BOTOX-groep hoger lag bij oudere patiënten dan bij de jongere patiënten.
Bij herhaalde dosering werd geen verandering van het algehele veiligheidsprofiel waargenomen.
Overactieve blaas bij pediatrische patiënten
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Infecties en parasitaire aandoeningen | Urineweginfectie | Vaak |
Nier- en urinewegaandoeningen | Dysurie*, urethraalpijn* | Vaak |
Maagdarmstelselaandoeningen | Buikpijn, pijn laag in de onderbuik | Vaak |
*procedure-gerelateerde bijwerkingen
In één dubbelblinde, gerandomiseerde, multicentrische klinische studie met parallelle groepen uitgevoerd bij 55 patiënten tussen 12 en 17 jaar oud, waren de bijwerkingen over het alemeen vergelijkbaar met het bekende veiligheidsprofiel bij volwassen patiënten met een overactieve blaas. Echter, bijwerkingen van urethraalpijn en buikpijn werden ook waargenomen in dit kleinschalig OAB-onderzoek naar een overactieve blaas bij kinderen.
Zie rubriek 4.2 en 5.1.
Urine-incontinentie door neurogene detrusoroveractiviteit bij volwassenen
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Infecties en parasitaire aandoeningen | Urineweginfectiea,b, bacteriurieb | Zeer vaak |
Onderzoeken | Residuaal urinevolume**b | Zeer vaak |
Psychische stoornissen | Insomniaa | Vaak |
Maagdarmstelselaandoeningen | Constipatiea | Vaak |
Skeletspierstelsel- en bindweefselaandoeningen | Spierzwaktea, spierspasmea | Vaak |
Nier- en urinewegaandoeningen | Urineretentie a,b | Zeer vaak |
Hematurie*a,b, dysurie*a,b, blaasdivertikela | Vaak | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Vermoeidheida, loopstoornisa | Vaak |
Letsels, intoxicaties en verrichtingscomplicaties | Autonome dysreflexie*a, vallena | Vaak |
* procedure-gerelateerde bijwerkingen
**verhoogde PVR waarvoor geen katheterisatie vereist is
a Bijwerkingen uit fase 2 en pivotale fase 3 klinische studies
b Bijwerkingen uit de postmarketingstudie met BOTOX 100 eenheden bij MS-patiënten zonder blaaskatheter bij aanvang
Klinische studies maakten melding van urineweginfecties bij 49,2% van de patiënten behandeld met 200 eenheden BOTOX, en bij 35,7% van de patiënten behandeld met placebo (53,0% van multiple sclerose-patiënten behandeld met 200 eenheden versus 29,3% met placebo; 45,4% van ruggenmergletselpatiënten behandeld met 200 eenheden versus 41,7% met placebo). Van urineretentie werd melding gemaakt bij 17,2% van de patiënten behandeld met 200 eenheden BOTOX en bij 2,9% van de patiënten behandeld met placebo (28,8% van multipele sclerose-patiënten behandeld met 200 eenheden versus 4,5% met placebo; 5,4% van ruggenmergletselpatiënten behandeld met 200 eenheden versus 1,4% met placebo).
Er werd geen verandering in het type bijwerkingen waargenomen bij herhaalde dosering.
Bij multipele sclerose (MS)-patiënten die deelnamen aan de hoofdstudies werd tussen BOTOX-groepen en placebogroepen geen verschil waargenomen in het aantal MS-exacerbaties per patiëntjaar (BOTOX = 0,23, placebo = 0,20), noch in de postmarketingstudie met BOTOX 100 eenheden bij MS-patiënten zonder katheterisatie bij aanvang (BOTOX=0, placebo=0,07).
Van de patiënten die bij aanvang niet werden gekatheteriseerd vóór de behandeling werd in de pivotale studies na de behandeling met BOTOX 200 eenheden of placebo begonnen met katheterisatie bij respectievelijk 38,9% en 17,3%.
In een postmarketingstudie met BOTOX 100 eenheden bij MS-patiënten zonder katheterisatie bij aanvang, werd gestart met katheterisatie bij 15,2% van de patiënten die een behandeling met BOTOX 100 eenheden hadden gekregen, versus 2,6% met de placebo (zie rubriek 5.1).
Neurogene detrusoroveractiviteit bij kinderen
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Infecties en parasitaire aandoeningen | Bacteriurie | Zeer vaak |
Urineweginfectie, leukocyturie | Vaak | |
Nier- en urinewegaandoeningen | Hematurie, blaaspijn* | Vaak |
* procedure-gerelateerde bijwerkingen
Er werd geen verandering in het type bijwerkingen waargenomen bij herhaalde dosering.
Zie rubriek 4.2 en 5.1.
HUID- EN ONDERHUIDAANDOENING:
Primaire hyperhidrose van de oksels
Systeem/orgaanklasse | Voorkeursterm | Frequentie |
Zenuwstelselaandoeningen | Hoofdpijn, paresthesie | Vaak |
Bloedvataandoeningen | Opvliegers | Vaak |
Maagdarmstelselaandoeningen | Nausea | Soms |
Huid- en onderhuidaandoeningen | Hyperhidrose (niet onder de oksels), abnormale geur van de huid, pruritus, subcutane knobbels, alopecia | Vaak |
Skeletspierstelsel- en bindweefselaandoeningen | Pijn in extremiteit | Vaak |
Spierzwakte, myalgie, artropathie | Soms | |
Algemene aandoeningen en toedieningsplaatsstoornissen | Pijn op de plaats van injectie | Zeer vaak |
Pijn, oedeem op de plaats van injectie, hemorragie op de plaats van injectie, overgevoeligheid op de plaats van injectie, irritatie op de plaats van injectie, asthenie, reacties op de plaats van injectie | Vaak |
Bij de behandeling van primaire hyperhidrose van de oksels werd een toename van zweten buiten de oksels binnen 1 maand na injectie gemeld bij 4,5% van de patiënten. Er was geen bepaald patroon te zien wat de aangedane anatomische plaatsen betreft. Bij ongeveer 30% van de patiënten verdween dat probleem binnen vier maanden.
Soms (0,7%) werd ook zwakte van de arm gerapporteerd; die zwakte was mild, kortstondig, hoefde niet te worden behandeld en herstelde zonder gevolgen. Deze bijwerking houdt mogelijk verband met de behandeling, de injectietechniek of beide. Soms werd spierzwakte gemeld; in dat geval kan een neurologisch onderzoek worden overwogen. Bovendien is het raadzaam de injectietechniek te herevalueren voorafgaand aan de volgende injectie om er zeker van te zijn dat de injecties intradermaal worden toegediend.
In een niet-gecontroleerd onderzoek naar de veiligheid van BOTOX (50 eenheden per oksel) bij pediatrische patiënten van 12 tot 17 jaar (n=144) waren pijn op de plaats van injectie en hyperhidrose (niet onder de oksels) de bijwerkingen die bij meer dan één patiënt (telkens 2 patiënten) optraden.
Aanvullende informatie
De volgende lijst bevat bijwerkingen of andere medisch relevante bijwerkingen die zijn gemeld sinds het geneesmiddel op de markt werd gebracht, ongeacht de indicatie, en kan een aanvulling zijn op rubriek 4.4 (Bijzondere waarschuwingen en voorzorgen bij gebruik) en rubriek 4.8 (Bijwerkingen).
Systeem/orgaanklasse | Voorkeursterm |
Immuunsysteemaandoeningen | Anafylaxie, angio-oedeem, serumziekte, urticaria |
Voedings- en stofwisselingsstoornissen | Anorexie |
Zenuwstelselaandoeningen | Brachiale plexopathie, dysfonie, dysartrie, facialisparese, hypo-esthesie, spierzwakte, myasthenia gravis, perifere neuropathie, paresthesie, radiculopathie, convulsies, syncope, facialisverlamming |
Oogaandoeningen | Geslotenhoekglaucoom (bij behandeling van blefarospasmen), strabisme, wazig zicht, visuele stoornis, droog oog (geassocieerd met peri-oculaire injecties), ooglidoedeem |
Evenwichtsorgaan- en ooraandoeningen | Hypoacusie, tinnitus, vertigo |
Hartaandoeningen | Aritmie, myocardinfarct |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Aspiratie pneumonie (sommige met fatale afloop), dyspneu, ademhalingsdepressie, respiratoir falen |
Maagdarmstelselaandoeningen | Buikpijn, diarree, constipatie, droge mond, dysfagie, nausea, braken |
Huid- en onderhuidaandoeningen | Alopecia, dermatitis psoriasiformis, erythema multiforme, hyperhidrose, madarose, pruritus, huiduitslag |
Skeletspierstelsel- en bindweefselaandoeningen | Spieratrofie, myalgie, gelokaliseerde spiertrekkingen/onwillekeurige spiercontracties |
Algemene aandoeningen en toedieningsplaatsstoornissen | Denervatie-atrofie, malaise, pyrexie |
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
AbbVie S.A.
Av. Einstein 14
1300 Wavre
België
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE: BE215126
10. DATUM VAN HERZIENING VAN DE TEKST
12/2024
Goedkeuringsdatum: 09/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1186022 | BOTOX VIAL IM/SC 100 U PR/U | M03AX01 | - | - | Ja | - | - |