1. NAAM VAN HET GENEESMIDDEL
CABOMETYX 20 mg filmomhulde tabletten
CABOMETYX 40 mg filmomhulde tabletten
CABOMETYX 60 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
CABOMETYX 20 mg filmomhulde tabletten
Elke filmomhulde tablet bevat cabozantinib (S)-malaat, equivalent aan 20 mg cabozantinib.
Hulpstoffen met bekend effect
Elke filmomhulde tablet bevat 15,54 mg lactose.
CABOMETYX 40 mg filmomhulde tabletten
Elke filmomhulde tablet bevat cabozantinib (S)-malaat, equivalent aan 40 mg cabozantinib.
Hulpstoffen met bekend effect
Elke filmomhulde tablet bevat 31,07 mg lactose.
CABOMETYX 60 mg filmomhulde tabletten
Elke filmomhulde tablet bevat cabozantinib (S)-malaat, equivalent aan 60 mg cabozantinib.
Hulpstoffen met bekend effect
Elke filmomhulde tablet bevat 46,61 mg lactose.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet.
CABOMETYX 20 mg filmomhulde tabletten
De tabletten zijn geel en rond zonder breukstreep en hebben aan de ene zijde “XL” gegraveerd en aan de andere zijde van de tablet “20”.
CABOMETYX 40 mg filmomhulde tabletten
De tabletten zijn geel en driehoekig van vorm zonder breukstreep en hebben aan de ene zijde “XL” gegraveerd en aan de andere zijde van de tablet “40”.
CABOMETYX 60 mg filmomhulde tabletten
De tabletten zijn geel en ovaal van vorm zonder breukstreep en hebben aan de ene zijde “XL” gegraveerd en aan de andere zijde van de tablet “60”.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Niercelcarcinoom (RCC, renal cell carcinoma)
CABOMETYX is geïndiceerd als monotherapie voor gevorderd niercelcarcinoom
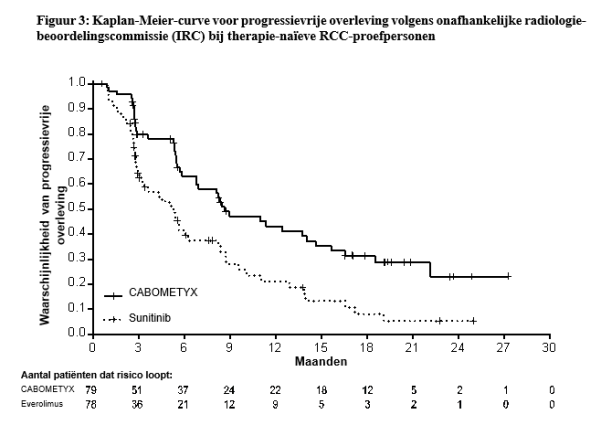
- als eerstelijnsbehandeling van volwassen patiënten met intermediate of poor risk (zie rubriek 5.1),
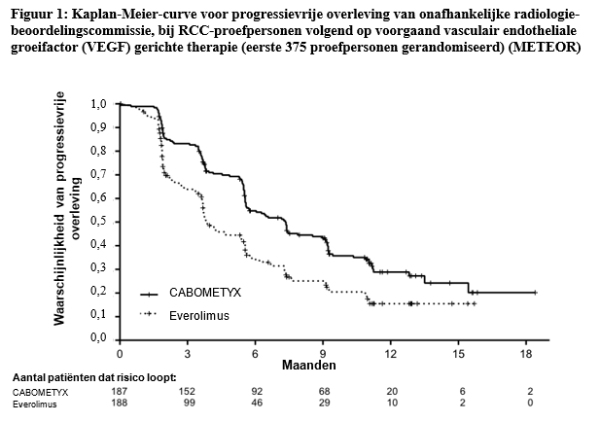
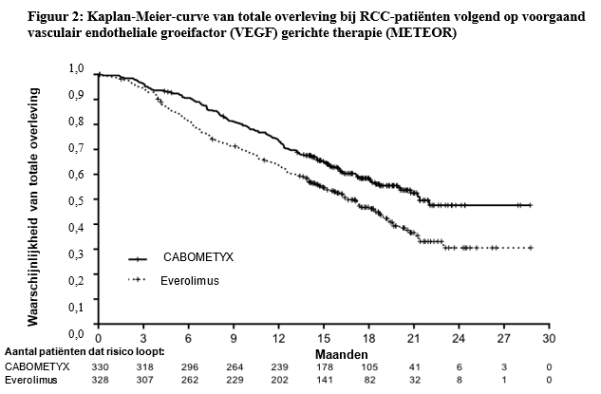
- bij volwassenen volgend op voorgaand vasculair endotheliale groeifactor (VEGF, vascular endothelial growth factor) gerichte therapie (zie rubriek 5.1).
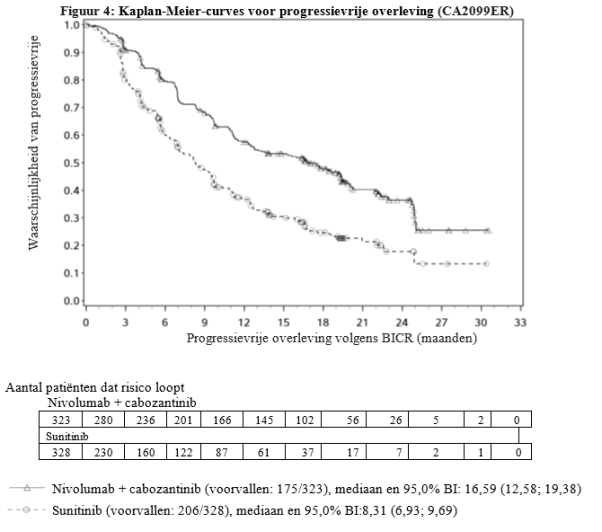
CABOMETYX in combinatie met nivolumab is geïndiceerd voor de eerstelijnsbehandeling van gevorderd niercelcarcinoom bij volwassenen (zie rubriek 5.1).
Hepatocellulair carcinoom (HCC)
CABOMETYX is geïndiceerd als monotherapie voor de behandeling van hepatocellulair carcinoom (HCC) bij volwassenen die voordien behandeld werden met sorafenib.
Gedifferentieerd schildkliercarcinoom (DTC)
CABOMETYX is geïndiceerd als monotherapie voor de behandeling van volwassen patiënten met lokaal gevorderd of gemetastaseerd gedifferentieerd schildkliercarcinoom (DTC), refractair of niet in aanmerking komend voor radioactief jodium (RAI) die progressie hebben vertoond tijdens of na eerdere systemische behandeling.
Neuro-endocriene tumoren (NET)
CABOMETYX is geïndiceerd voor de behandeling van volwassen patiënten met niet-reseceerbare of gemetastaseerde, goed gedifferentieerde extra-pancreatische (epNET) en pancreatische (pNET) neuro-endocriene tumoren die progressie hebben vertoond na ten minste één eerdere systemische therapie anders dan met somatostatine-analogen
4.2 Dosering en wijze van toediening
Behandeling met CABOMETYX dient te worden gestart door een arts die ervaren is in de toediening van antikankergeneesmiddelen.
Dosering
CABOMETYX tabletten en cabozantinib capsules zijn niet bio-equivalent en mogen niet onderling worden verwisseld (zie rubriek 5.2).
CABOMETYX als monotherapie
De aanbevolen dosis voor RCC, HCC, DTC en NET van CABOMETYX is 60 mg eenmaal daags. De behandeling dient voortgezet te worden tot de patiënt geen klinisch voordeel meer heeft van de behandeling of tot onacceptabele toxiciteit optreedt.
CABOMETYX in combinatie met nivolumab in eerstelijns gevorderd RCC
De aanbevolen dosis CABOMETYX is 40 mg eenmaal daags in combinatie met nivolumab oplossing voor infusie, intraveneus toegediend in ofwel 240 mg elke 2 weken of 480 mg elke 4 weken, of met nivolumab oplossing voor injectie, subcutaan toegediend in ofwel 600 mg elke 2 weken of 1200 mg elke 4 weken. De behandeling moet worden voortgezet tot ziekteprogressie of onaanvaardbare toxiciteit. Nivolumab dient te worden voortgezet tot ziekteprogressie, onaanvaardbare toxiciteit, of tot 24 maanden bij patiënten zonder ziekteprogressie (zie de Samenvatting van de Productkenmerken (SmPC) voor de dosering van nivolumab).
Aanpassing van de behandeling
Voor behandeling van vermoedelijke bijwerkingen van het geneesmiddel kan mogelijk tijdelijke behandeling onderbreking en/of dosisverlaging nodig zijn (zie Tabel 1). Wanneer dosisverlaging nodig is in monotherapie, is het raadzaam te verlagen tot dagelijks 40 mg en daarna tot dagelijks 20 mg.
Als CABOMETYX wordt toegediend in combinatie met nivolumab, wordt aanbevolen om de dosis te verlagen naar 20 mg CABOMETYX eenmaal daags en vervolgens tot 20 mg om de dag (raadpleeg de SmPC van nivolumab voor aanbevolen aanpassing van de behandeling voor nivolumab).
Dosisonderbrekingen worden aanbevolen in geval van CTCAE graad 3 of hogere toxiciteit of ondraaglijke graad 2 toxiciteit. Dosisverlagingen worden aanbevolen voor gevallen die, indien persistent, ernstig of ondraaglijk zouden kunnen worden.
Wanneer een patiënt een dosis mist, dient de gemiste dosis niet te worden ingenomen wanneer het minder dan 12 uur vóór de volgende dosis is.
Tabel 1: Aanbevolen aanpassingen van CABOMETYX dosis in geval van bijwerkingen
Bijwerking en ernst | Aanpassing van behandeling |
Graad 1 en graad 2 bijwerkingen die draaglijk en gemakkelijk te behandelen zijn | Gewoonlijk is een dosisaanpassing niet nodig. |
Graad 2 bijwerkingen die ondraaglijk zijn en niet kunnen worden behandeld met een dosisverlaging of ondersteunende zorg | Onderbreek de behandeling tot de bijwerking is verminderd tot ≤ graad 1. |
Graad 3 bijwerkingen (met uitzondering van klinisch niet-relevante afwijkingen in laboratoriumwaarden) | Onderbreek de behandeling tot de bijwerking is verminderd tot ≤ graad 1. |
Graad 4 bijwerkingen (met uitzondering van klinisch niet-relevante afwijkingen in laboratoriumwaarden) | Onderbreek de behandeling. |
Verhogingen van leverenzymen voor RCC-patiënten die worden behandeld met CABOMETYX in combinatie met nivolumab |
|
ALAT of ASAT > 3 keer ULN maar ≤ 10 keer ULN zonder gelijktijdige totale bilirubine ≥ 2 keer ULN | Onderbreek CABOMETYX en nivolumab totdat deze bijwerkingen zijn verminderd tot graad ≤ 1 |
ALAT of ASAT > 10 keer ULN of > 3 keer ULN met gelijktijdige totale bilirubine ≥ 2 keer ULN | Zet de behandeling met CABOMETYX en nivolumab definitief stop. |
Opmerking: Graad van toxiciteit in overeenstemming met National Cancer Institute Common Terminology Criteria for Adverse Events versie 4.0 (NCI-CTCAE v4).
Gelijktijdige geneesmiddelen
Men dient voorzichtig te zijn met het gelijktijdig gebruik van geneesmiddelen die sterke remmers van CYP3A4 zijn en gelijktijdig chronisch gebruik van geneesmiddelen die sterke inductoren van CYP3A4 zijn, dient te worden vermeden (zie rubrieken 4.4 en 4.5).
Gelijktijdig gebruik van een alternatief geneesmiddel zonder of met minimaal potentieel voor het induceren of remmen van CYP3A4 dient te worden overwogen.
Speciale populaties
Ouderen
Er wordt geen specifieke dosisaanpassing voor het gebruik van cabozantinib bij oudere patiënten (≥ 65 jaar) aanbevolen.
Ras
Er is geen dosisaanpassing vereist op basis van etniciteit (zie rubriek 5.2).
Nierfunctiestoornis
Bij patiënten met een lichte of matig ernstige nierfunctiestoornis dient men voorzichtig te zijn met het gebruik van cabozantinib.
Cabozantinib wordt niet aanbevolen voor gebruik bij patiënten met een ernstige nierfunctiestoornis aangezien de veiligheid en werkzaamheid niet zijn vastgesteld bij deze populatie.
Leverfunctiestoornis
Bij patiënten met een lichte leverfunctiestoornis is er geen dosisaanpassing vereist. Aangezien er slechts beperkte gegevens beschikbaar zijn voor patiënten met een matig ernstige leverfunctiestoornis (Child-Pugh B), kan er geen doseringsadvies worden gegeven. Strikte monitoring van de algehele veiligheid wordt aanbevolen bij deze patiënten (zie rubriek 4.4 en 5.2). Er is geen klinische ervaring bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh C), zodat cabozantinib niet aanbevolen wordt voor gebruik bij deze patiënten (zie rubriek 5.2).
Hartaandoening
Er zijn beperkte gegevens over patiënten met een hartaandoening. Er kunnen geen specifieke dosisaanbevelingen worden gedaan.
Pediatrische patiënten
De veiligheid en werkzaamheid van cabozantinib bij kinderen en adolescenten jonger dan 18 jaar zijn nog niet vastgesteld. De momenteel beschikbare gegevens worden beschreven in rubriek 4.8, 5.1 en 5.2, maar er kunnen geen dosisaanbevelingen worden gedaan.
Wijze van toediening
CABOMETYX is voor oraal gebruik. De tabletten dienen in hun geheel te worden doorgeslikt en mogen niet worden geplet. Patiënten dienen te worden geïnstrueerd gedurende ten minste 2 uur vóór, tot 1 uur na, het innemen van CABOMETYX niets te eten.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Cabozantinib als monotherapie
Samenvatting van het veiligheidsprofiel
De vaakst voorkomende ernstige bijwerkingen in de RCC-populatie (incidentie ≥ 1%) zijn pneumonie, abdominale pijn, diarree, misselijkheid, hypertensie, embolie, hyponatriëmie, longembolie, braken, dehydratie, vermoeidheid, asthenie, verminderde eetlust, diepe veneuze trombose, duizeligheid, hypomagnesiëmie en palmoplantair erytrodysesthesiesyndroom (PPES).
De vaakst voorkomende ernstige bijwerkingen in de HCC-populatie (incidentie ≥ 1%) zijn hepatische encefalopathie, asthenie, vermoeidheid, PPES, diarree, hyponatriëmie, braken, abdominale pijn en trombocytopenie.
De meest voorkomende ernstige bijwerkingen bij de DTC-populatie (incidentie ≥1%) zijn diarree, pleurale effusie, pneumonie, longembolie, hypertensie, anemie, diep-veneuze trombose, hypocalciëmie, osteonecrose van de kaak, pijn, PPES, braken en nierinsufficiëntie.
De meest voorkomende ernstige bijwerkingen in de NET-populatie (incidentie ≥1%) zijn hypertensie, vermoeidheid, longembolie, braken, diarree, misselijkheid en embolie.
De meest voorkomende bijwerkingen van ongeacht welke graad (ervaren door ten minste 25% van de patiënten) in de RCC-, HCC-, DTC- en NET-populaties waren diarree, vermoeidheid, misselijkheid, verminderde eetlust, PPES en hypertensie.
Lijst van bijwerkingen in tabelvorm
Bijwerkingen, waargenomen in de gepoolde database van patiënten behandeld met cabozantinib monotherapie bij RCC, HCC, DTC en NET (n=1355) of gerapporteerd na postmarketinggebruik van cabozantinib, worden in Tabel 2 vermeld. De bijwerkingen zijn opgesomd volgens MedDRA systeem/orgaanklasse en frequentiecategorieën. Frequenties zijn gebaseerd op alle graden en gedefinieerd als: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen elke frequentiegroep worden de bijwerkingen gepresenteerd in volgorde van afnemende ernst.
Tabel 2: Bijwerkingen gemeld in klinische studies of na postmarketinggebruik bij patiënten behandeld met cabozantinib in monotherapie
Infecties en parasitaire aandoeningen | |
Vaak | abces, pneumonie |
Bloed- en lymfestelselaandoeningen | |
Zeer vaak | anemie, trombocytopenie |
Vaak | neutropenie, lymfopenie |
Endocriene aandoeningen | |
Zeer vaak | hypothyreoïdie* |
Voedings- en stofwisselingsstoornissen | |
Zeer vaak | verminderde eetlust, hypomagnesiëmie, hypokaliëmie, hypoalbuminemie, hypocalciëmie, |
Vaak | dehydratie, hypofosfatemie, hyponatriëmie, hyperkaliëmie, hyperbilirubinemie, hyperglykemie, hypoglykemie |
Zenuwstelselaandoeningen | |
Zeer vaak | dysgeusie, hoofdpijn, duizeligheid |
Vaak | perifere neuropathiea |
Soms | convulsie, cerebrovasculair accident, posterieur reversibel encefalopathiesyndroom |
Evenwichtsorgaan- en ooraandoeningen | |
Vaak | tinnitus |
Hartaandoeningen | |
Soms | acuut myocardinfarct |
Bloedvataandoeningen | |
Zeer vaak | hypertensie, bloedingb* |
Vaak | veneuze trombosec, hypotensie, embolie |
Soms | hypertensieve crisis, arteriële trombose, arteriële embolie |
Niet bekend | aneurysma's en arteriële dissecties |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | |
Zeer vaak | dysfonie, dyspneu, hoesten |
Vaak | longembolie, allergische rhinitis |
Soms | pneumothorax |
Maagdarmstelselaandoeningen | |
Zeer vaak | diarree*, misselijkheid, braken, stomatitis, constipatie, abdominale pijn, dyspepsie |
Vaak | gastro-intestinale perforatie*g, pancreatitis, fistel*, gastro-oesofageale refluxziekte, hemorroïden, mondpijn, droge mond, dysfagie, flatulentie |
Soms | glossodynie |
Lever- en galaandoeningen | |
Vaak | hepatische encefalopathie* |
Soms | hepatitis cholestatisch |
Huid- en onderhuidaandoeningen | |
Zeer vaak | palmoplantair erytrodysesthesiesyndroom, huiduitslagf |
Vaak | pruritus, alopecia, droge huid, verandering van haarkleur, hyperkeratose, erytheem |
Niet bekend | cutane vasculitis |
Skeletspierstelsel- en bindweefselaandoeningen | |
Zeer vaak | pijn in extremiteit, artralgie |
Vaak | spierspasmen |
Soms | osteonecrose van kaak |
Nier- en urinewegaandoeningen | |
Vaak | proteïnurie |
Algemene aandoeningen en toedieningsplaatsstoornissen | |
Zeer vaak | vermoeidheid, slijmvliesontsteking, asthenie, perifeer oedeem |
Onderzoekend | |
Zeer vaak | gewichtsverlies, serum ALAT verhoogd, ASAT verhoogd, alkalische fosfatase in bloed verhoogd |
Vaak | GGT verhoogd, creatinine in bloed verhoogd, amylase verhoogd, lipase verhoogd, bloedcholesterol verhoogd, bloed triglyceriden verhoogd, daling van het aantal witte bloedcellen |
Letsels, intoxicaties en verrichtingscomplicaties | |
Soms | Wondcomplicatiese |
* Zie rubriek 4.8 Beschrijving van geselecteerde bijwerkingen voor verdere karakterisering.
a Met inbegrip van polyneuropathie; perifere neuropathie is hoofdzakelijk sensorieel
b Inclusief epistaxis als de meest gemelde bijwerking
c Alle gevallen van veneuze trombose inclusief diep veneuze trombose
d Gebaseerd op gerapporteerde bijwerkingen
e Verstoorde heling, complicaties op de incisieplaats en wonddehiscentie
f Huiduitslag is een samengestelde term die dermatitis, acneïforme dermatitis, bulleuze dermatose, exfoliatieve uitslag, erythemateuze uitslag, folliculaire uitslag, maculaire uitslag, maculopapulaire uitslag, papulaire uitslag, pruritische uitslag en geneesmiddeleneruptie omvat.
g Er zijn fatale gevallen gemeld
Cabozantinib in combinatie met nivolumab in eerstelijns gevorderd RCC
Samenvatting van het veiligheidsprofiel
Als cabozantinib wordt toegediend in combinatie met nivolumab, raadpleeg dan de SmPC van nivolumab voordat de behandeling wordt gestart. Raadpleeg de SmPC van nivolumab voor aanvullende informatie over het veiligheidsprofiel van nivolumab als monotherapie.
In de dataset van cabozantinib 40 mg eenmaal daags in combinatie met nivolumab 240 mg elke twee weken in RCC (n = 320), met een minimale follow-up van 16 maanden, waren de meest voorkomende ernstige bijwerkingen (≥ 1% incidentie) diarree, pneumonitis, longembolie, hyponatriëmie, pneumonie, pyrexie, bijnierinsufficiëntie, braken en uitdroging.
De meest voorkomende bijwerkingen (≥ 25%) waren diarree, vermoeidheid, palmoplantair erytrodysesthesiesyndroom, stomatitis, musculoskeletale pijn, hypertensie, huiduitslag, hypothyreoïdie, verminderde eetlust, misselijkheid en buikpijn. De meeste bijwerkingen waren mild tot matig (graad 1 of 2).
Lijst van bijwerkingen in tabelvorm
Bijwerkingen die in de klinische studie van cabozantinib in combinatie met nivolumab zijn vastgesteld, worden in Tabel 3 vermeld volgens MedDRA systeem/orgaanklassen en frequentiecategorieën. Frequenties zijn gebaseerd op alle graden en gedefinieerd als: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); niet bekend (kan met de beschikbare gegevens niet worden bepaald). Binnen elke frequentiegroep worden bijwerkingen gerangschikt naar afnemende ernst.
Tabel 3: Bijwerkingen met cabozantinib in combinatie met nivolumab | |
Infecties en parasitaire aandoeningen | |
Zeer vaak | Infectie van de bovenste luchtwegen |
Vaak | pneumonie |
Bloed- en lymfestelselaandoeningen | |
Vaak | eosinofilie |
Immuunsysteemaandoeningen | |
Vaak | overgevoeligheid (inclusief anafylactische reactie) |
Soms | infusiegerelateerde overgevoeligheidsreactie |
Endocriene aandoeningen | |
Zeer vaak | hypothyreoïdie, hyperthyreoïdie |
Vaak | bijnierinsufficiëntie |
Soms | hypofysitis, thyreoïditis |
Voedings- en stofwisselingsstoornissen | |
Zeer vaak | verminderde eetlust |
Vaak | uitdroging |
Zenuwstelselaandoeningen | |
Zeer vaak | dysgeusie, duizeligheid, hoofdpijn |
Vaak | perifere neuropathie |
Soms | auto-immune encefalitis, syndroom van Guillain-Barré, myasthenisch syndroom |
Evenwichtsorgaan- en ooraandoeningen | |
Vaak | tinnitus |
Oogaandoeningen | |
Vaak | droge ogen, wazig zien |
Soms | uveïtis |
Hartaandoeningen | |
Vaak | boezemfibrilleren, tachycardie |
Soms | myocarditis |
Bloedvataandoeningen | |
Zeer vaak | hypertensie |
Vaak | trombosea |
Soms | arteriële embolie |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | |
Zeer vaak | dysfonie, dyspneu, hoesten |
Vaak | pneumonitis, longembolie, epistaxis, pleurale effusie |
Soms | pneumothorax |
Maagdarmstelselaandoeningen | |
Zeer vaak | diarree, braken, misselijkheid, constipatie, stomatitis, buikpijn, dyspepsie |
Vaak | colitis, gastritis, orale pijn, droge mond, aambeien |
Soms | pancreatitis, perforatie van de dunne darmb, glossodynie |
Lever- en galaandoeningen | |
Vaak | hepatitis |
Niet bekend | ‘vanishing bile duct’-syndroomc |
Huid- en onderhuidaandoeningen | |
Zeer vaak | palmoplantair erytrodysesthesiesyndroom, huiduitslagd, pruritus |
Vaak | alopecia, droge huid, erytheem, haarkleurverandering |
Soms | psoriasis, urticaria |
Niet bekend | cutane vasculitis |
Skeletspierstelsel- en bindweefselaandoeningen | |
Zeer vaak | musculoskeletale pijne, artralgie, spierspasmen |
Vaak | artritis |
Soms | myopathie, osteonecrose van de kaak, fistel |
Nier- en urinewegaandoeningen | |
Zeer vaak | proteïnurie |
Vaak | nierfalen, acuut nierletsel |
Soms | nefritis |
Algemene aandoeningen en toedieningsplaatsstoornissen | |
Zeer vaak | vermoeidheid, pyrexie, oedeem |
Vaak | pijn, pijn op de borst |
Onderzoekenf | |
Zeer vaak | verhoogde ALAT, verhoogde ASAT, hypofosfatemie, hypocalciëmie, hypomagnesiëmie, hyponatriëmie, hyperglykemie, lymfopenie, verhoogde alkalische fosfatase, verhoogde lipase, verhoogde amylase, trombocytopenie, |
Vaak | bloedcholesterol verhoogd, hypertriglyceridemie |
De in Tabel 3 weergegeven frequenties van bijwerkingen zijn mogelijk niet volledig toe te schrijven aan cabozantinib alleen, de onderliggende ziekte of nivolumab dat in combinatie wordt gebruikt kunnen hebben bijgedragen.
a Trombose is een samengestelde term die portale veneuze trombose, pulmonale veneuze trombose, pulmonale trombose, aortatrombose, arteriële trombose, diepe veneuze trombose, bekkenvenetrombose, vena cava trombose, veneuze trombose en veneuze trombose in de ledematen omvat.
b Er zijn fatale gevallen gemeld.
c Met eerdere of gelijktijdige blootstelling aan een immuun-‘checkpoint’-remmer
d Uitslag is een samengestelde term die dermatitis, acneïforme dermatitis, bulleuze dermatitis, exfoliatieve uitslag, erythemateuze uitslag, folliculaire uitslag, maculaire uitslag, maculo-papulaire uitslag, papulaire uitslag, pruritische uitslag en geneesmiddeleneruptie omvat.
e Musculoskeletale pijn is een samengestelde term die rugpijn, botpijn, musculoskeletale pijn op de borst, musculoskeletaal ongemak, myalgie, nekpijn, pijn in extremiteiten en spinale pijn omvat.
f Frequenties van laboratoriumtermen weerspiegelen het percentage patiënten dat een verslechtering ervoer ten opzichte van de uitgangswaarde bij laboratoriummetingen met uitzondering van gewichtsverlies, bloedcholesterol verhoogd en hypertriglyceridemie.
Beschrijving van geselecteerde bijwerkingen
Gegevens voor de volgende bijwerkingen zijn gebaseerd op patiënten die CABOMETYX 60 mg eenmaal daags oraal kregen als monotherapie in de pivotale studies bij RCC volgend op voorgaande VEGF-gerichte therapie en bij therapie-naïef RCC, bij HCC volgend op voorafgaande systemische therapie, bij DTC bij patiënten die refractair zijn of niet in aanmerking komen voor radioactief jodium (RAI) en die ziekteprogressie hebben vertoond tijdens of na voorgaande systemische behandeling, bij progressieve NET na eerdere systemische behandeling of bij patiënten die CABOMETYX 40 mg eenmaal daags oraal kregen in combinatie met nivolumab in eerstelijns gevorderd RCC (rubriek 5.1).
Gastro-intestinale (GI) perforatie (zie rubriek 4.4)
In de RCC-studie (METEOR) zijn GI-perforaties gemeld bij 0,9% (3/331) van de met cabozantinib behandelde RCC-patiënten. De voorvallen waren graad 2 of 3. De mediane tijd tot optreden bedroeg 10,0 weken.
In de studie bij therapie-naïef RCC (CABOSUN) zijn GI-perforaties gemeld bij 2,6% (2/78) van de met cabozantinib behandelde patiënten. De voorvallen waren graad 4 en 5.
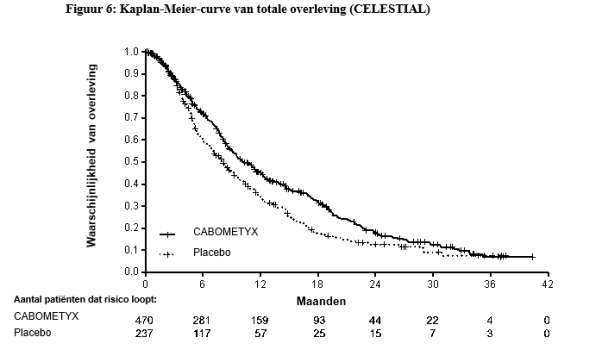
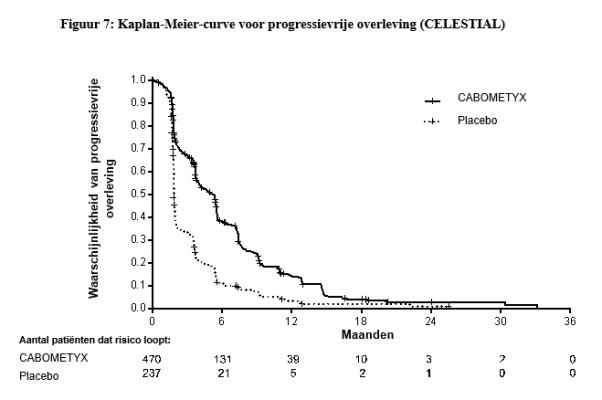
In de HCC-studie (CELESTIAL) zijn GI-perforaties gemeld bij 0,9% (4/467) van de met cabozantinib behandelde patiënten. Alle voorvallen waren graad 3 of 4. De mediane tijd tot optreden bedroeg 5,9 weken.
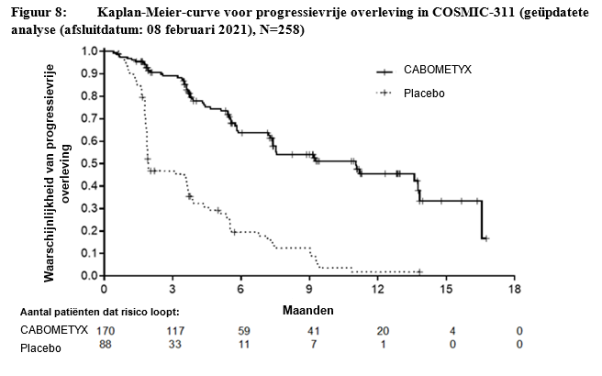
In de DTC-studie (COSMIC-311) werd GI-perforatie graad 4 gemeld bij één patiënt (0,6%) van de met cabozantinib behandelde patiënten en deze trad op na 14 weken behandeling.
In de NET-studie (CABINET) zijn GI-perforaties gemeld bij 1,3% (3/227) van de met cabozantinib behandelde patiënten. De voorvallen waren graad 3, 4 en 5. De mediane tijd tot optreden bedroeg 21,6 weken.
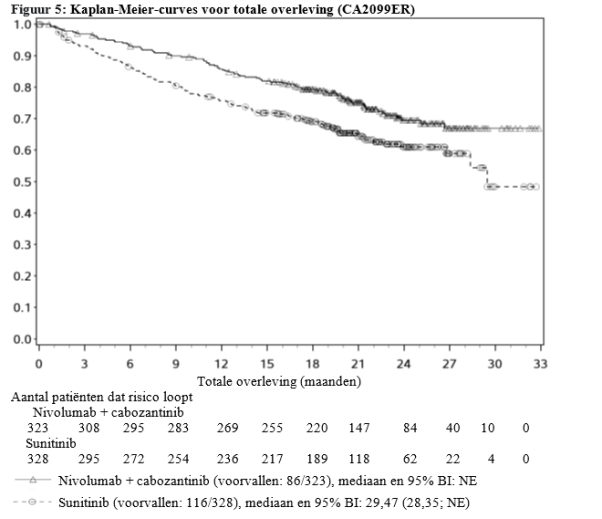
In combinatie met nivolumab bij gevorderd RCC als eerstelijnsbehandeling (CA2099ER) was de incidentie van GI-perforaties 1,3% (4/320) van de behandelde patiënten. Eén voorval was graad 3, twee voorvallen waren graad 4 en één voorval was graad 5 (fataal).
Fatale perforaties zijn voorgekomen in het klinische programma met cabozantinib.
Hepatische encefalopathie (zie rubriek 4.4)
In de HCC-studie (CELESTIAL) is hepatische encefalopathie (hepatische encefalopathie, encefalopathie, hyperammoniëmische encefalopathie) gemeld bij 5,6% (26/467) van de met cabozantinib behandelde patiënten; graad 3-4 voorvallen bij 2,8%, en één (0,2%) graad 5 voorval. De mediane tijd tot optreden bedroeg 5,9 weken.
In de NET-studie (CABINET) is hepatische encefalopathie gemeld bij 0,9% (2/227) van de met cabozantinib behandelde patiënten; er was één graad 3 voorval (0,4%) waarvoor de mediane tijd tot optreden 14,3 weken bedroeg.
Er zijn geen gevallen van hepatische encefalopathie gemeld in de RCC-studies (METEOR, CABOSUN en CA2099ER) en in de DTC-studie (COSMIC-311).
Diarree (zie rubriek 4.4)
In de RCC-studie (METEOR) is diarree gemeld bij 74% (245/331) van de met cabozantinib behandelde RCC-patiënten; graad 3-4 voorvallen bij 11%. De mediane tijd tot optreden bedroeg 4,9 weken.
In de studie bij therapie-naïef RCC (CABOSUN) is diarree gemeld bij 73% (57/78) van de met cabozantinib behandelde patiënten (57/78); graad 3-4 voorvallen bij 10%.
In de HCC-studie (CELESTIAL) is diarree gemeld bij 54% (251/467) van de met cabozantinib behandelde patiënten; graad 3-4 voorvallen bij 9,9%. De mediane tijd tot optreden van alle voorvallen bedroeg 4,1 weken. Diarree leidde tot dosisaanpassingen, onderbrekingen en stopzettingen bij respectievelijk 84/467 (18%), 69/467 (15%) en 5/467 (1%) van de proefpersonen.
In de DTC-studie (COSMIC-311) werd diarree gemeld bij 62% van de met cabozantinib behandelde patiënten (105/170); graad 3-4 voorvallen bij 7,6%. Diarree leidde tot dosisreductie en -onderbreking bij respectievelijk 24/170 (14%) en 36/170 (21%) van de proefpersonen.
In de NET-studie (CABINET) werd diarree gemeld bij 63% van de met cabozantinib behandelde patiënten (144/227); graad 3 voorvallen bij 8,4%, geen graad 4 voorvallen. De mediane tijd tot optreden voor graad 3 voorvallen bedroeg 5,1 weken.
In combinatie met nivolumab bij gevorderd RCC als eerstelijnsbehandeling (CA2099ER) werd diarree gemeld bij 64,7% (207/320) van de behandelde patiënten; graad 3-4 voorvallen bij 8,4% (27/320). De mediane tijd tot aanvang van alle voorvallen was 12,9 weken. De dosis werd vertraagd of verlaagd bij 26,3% (84/320) en stopgezet bij 2,2% (7/320) van de patiënten met diarree.
Fistels (zie rubriek 4.4)
In de RCC-studie (METEOR) zijn fistels gemeld bij 1,2% (4/331) van de met cabozantinib behandelde patiënten en deze omvatten anale fistels bij 0,6% (2/331) van de met cabozantinib behandelde patiënten. Eén voorval was graad 3; de overige waren graad 2. De mediane tijd tot optreden bedroeg 30,3 weken.
In de studie bij therapie-naïef RCC (CABOSUN) zijn geen gevallen van fistels gemeld.
In de HCC-studie (CELESTIAL) zijn fistels gemeld bij 1,5% (7/467) van de HCC-patiënten. De mediane tijd tot optreden bedroeg 14 weken.
In de DTC-studie (COSMIC-311) werden fistels (twee anale fistels en één farynxfistel) gemeld bij 1,8% (3/170) van de met cabozantinib behandelde patiënten.
In de NET-studie (CABINET) werden fistels (twee anale fistels en één biliaire fistel) gemeld bij 1,3% (3/227) van de met cabozantinib behandelde patiënten. De voorvallen van anale fistels waren graad 1 en 3, de biliaire fistel graad 2. De mediane tijd tot optreden bedroeg 19,3 weken.
In combinatie met nivolumab bij gevorderd RCC als eerstelijnsbehandeling (CA2099ER) werden bij 0,9% (3/320) van de behandelde patiënten fistels gemeld en was de ernst graad 1. Fatale gevallen van fistels zijn voorgekomen in het klinische programma met cabozantinib.
Hemorragie (zie rubriek 4.4)
In de RCC-studie (METEOR) was de incidentie van ernstige hemorragische voorvallen (graad ≥ 3) 2,1% (7/331) bij de met cabozantinib behandelde RCC-patiënten. De mediane tijd tot optreden bedroeg 20,9 weken.In de studie bij therapie-naïef RCC (CABOSUN) was de incidentie van ernstige hemorragische -voorvallen (graad ≥ 3) 5,1% (4/78) bij de met cabozantinib behandelde RCC-patiënten.
In de HCC-studie (CELESTIAL) was de incidentie van ernstige hemorragische voorvallen (graad ≥ 3) 7,3% (34/467) bij de met cabozantinib behandelde patiënten. De mediane tijd tot optreden bedroeg 9,1 weken.
In de DTC-studie (COMIC-311) was de incidentie van ernstige hemorragische voorvallen (graad ≥ 3) 2,4% bij met cabozantinib behandelde patiënten (4/170). De mediane tijd tot optreden bedroeg 11,5 weken..
In de NET-studie (CABINET) was de incidentie van ernstige hemorragische voorvallen (graad ≥ 3) 1,8% (4/227) bij de met cabozantinib behandelde patiënten. De mediane tijd tot optreden bedroeg 14,1 weken.
In combinatie met nivolumab bij gevorderd RCC als eerstelijnsbehandeling (CA2099ER) was de incidentie van ≥ graad 3 bloeding 1,9% (6/320) van de behandelde patiënten.
Fatale gevallen van hemorragie zijn voorgekomen in het klinische programma met cabozantinib.
Posterieur reversibel encefalopathiesyndroom (PRES) (zie rubriek 4.4)
Er zijn geen gevallen van PRES gemeld in de METEOR-, CABOSUN-, CA2099ER- of CELESTIAL-studies, maar PRES is bij één patiënt in de DTC-studie (COSMIC-311) en bij één patiënt in de NET-studie (CABINET) gemeld. PRES is wel zelden gemeld in andere klinische proeven (bij 2/4872 proefpersonen; 0,04%).
Verhoogde leverenzymen wanneer cabozantinib wordt gecombineerd met nivolumab in RCC
In een klinische studie met niet eerder behandelde patiënten met RCC die cabozantinib in combinatie met nivolumab kregen, werd een hogere incidentie van graad 3 en 4 verhoogde ALAT (10,1%) en verhoogde ASAT (8,2%) waargenomen ten opzichte van monotherapie met cabozantinib bij patiënten met gevorderd RCC (verhoogde ALAT van 3,6% en verhoogde ASAT van 3,3% in METEOR-studie). De mediane tijd tot aanvang van een graad > 2 verhoogde ALAT of ASAT was 10,1 weken (bereik: 2 tot 106,6 weken; n = 85). Bij patiënten met graad ≥ 2 verhoogde ALAT of ASAT verdwenen de verhogingen tot graad 0-1 in 91% van de gevallen met een mediane tijd tot herstel van 2,3 weken (bereik: 0,4 tot 108,1 weken).
Van de 45 patiënten met graad ≥ 2 verhoogde ALAT of ASAT die opnieuw werden blootgesteld aan ofwel cabozantinib (n = 10) ofwel nivolumab (n = 10) als monotherapie of met beide (n = 25), werd een recidief van graad ≥ 2 geobserveerd bij 4 patiënten die cabozantinib kregen, bij 3 patiënten die nivolumab kregen en bij 8 patiënten die zowel cabozantinib als nivolumab kregen.
Hypothyreoïdie
In de RCC-studie (METEOR) was de incidentie van hypothyreoïdie 21% (68/331).
In de studie bij therapie-naïef RCC (CABOSUN) was de incidentie van hypothyreoïdie 23% (18/78) bij de met cabozantinib behandelde patiënten.
In de HCC-studie (CELESTIAL) was de incidentie van hypothyreoïdie 8,1% (36/467) bij de met cabozantinib behandelde patiënten en graad 3 voorvallen in 0,4% (2/467).
In de DTC-studie (COSMIC-311) was de incidentie van hypothyreoïdie 2,4% (4/170), alle graad 1-2; geen van de gevallen vereiste wijziging van de behandeling.
In de NET-studie (CABINET) was de incidentie van hypothyreoïdie 26% (59/227) bij de met cabozantinib behandelde patiënten, alle graad 1-2.
In combinatie met nivolumab in gevorderd RCC als eerstelijnsbehandeling (CA2099ER) was de incidentie van hypothyreoïdie 35,6% (114/320) van de behandelde patiënten.
Pediatrische patiënten (zie rubriek 5.1)
In studie ADVL1211, een beperkte dosisescalatiestudie van cabozantinib bij pediatrische en adolescente patiënten met recidiverende of refractaire solide tumoren inclusief tumoren in het centraal zenuwstelsel (CZS), werden de volgende events met een hogere frequentie waargenomen bij alle proefpersonen in alle doseringsgroepen van de veiligheidspopulatie (N=39), in vergelijking met volwassenen: verhoogde aspartaataminotransferase (ASAT) (zeer vaak; 76,9%), verhoogde alanineaminotransferase (ALAT) (zeer vaak; 71,8%), verlaagde lymfocytenaantallen (zeer vaak; 48,7%), verlaagde neutrofielenaantallen (zeer vaak; 35,9%) en verhoogde lipase (zeer vaak; 33,3%). De verhoogde percentages voor deze Preferred Terms (PT’s) hebben betrekking op elke graad alsook graad 3/4 van deze bijwerkingen. De gerapporteerde bijwerkingen liggen kwalitatief in lijn met het erkende veiligheidsprofiel van cabozantinib onder volwassen populaties. De kleine aantallen proefpersonen sluiten echter een sluitende beoordeling van trends en frequenties en een verdere vergelijking met het erkende veiligheidsprofiel van cabozantinib uit.
In studie ADVL1622 werd cabozantinib onderzocht bij kinderen en jongvolwassenen met de volgende solide-tumorstrata: Ewing-sarcoom, rabdomyosarcoom, non-rhabdomyosarcoom soft tissue sarcoma (NRSTS), osteosarcoom, Wilms-tumor en andere zeldzame solide tumoren (niet-statistisch cohort). Het veiligheidsprofiel van met cabozantinib behandelde kinderen en jongvolwassenen in alle strata was vergelijkbaar met dat waargenomen bij volwassenen die met cabozantinib werden behandeld.
Bij behandeling met cabozantinib werd epifysaire verbreding waargenomen bij kinderen met open groeischijven.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem zoals vermeld in aanhangsel V.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Ipsen Pharma
70 rue Balard
75015 Paris
Frankrijk
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
CABOMETYX 20 mg filmomhulde tabletten
EU/1/16/1136/002
CABOMETYX 40 mg filmomhulde tabletten
EU/1/16/1136/004
CABOMETYX 60 mg filmomhulde tabletten
EU/1/16/1136/006
10. DATUM VAN HERZIENING VAN DE TEKST
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 3567534 | CABOMETYX 20MG COMP PELL 30 | L01EX07 | - | € 5918,97 | Ja | - | - |
| 3567542 | CABOMETYX 40MG COMP PELL 30 | L01EX07 | - | € 5918,97 | Ja | - | - |
| 3567559 | CABOMETYX 60MG COMP PELL 30 | L01EX07 | - | € 5918,97 | Ja | - | - |