1. NAAM VAN HET GENEESMIDDEL
Decapeptyl Sustained Release 3,75 mg poeder en oplosmiddel voor suspensie voor injectie.
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Injectieflacon met poeder: triptoreline acetaat overeenkomend met triptoreline 4,2 mg (4,2 mg actief bestanddeel per injectieflacon maakt een toediening mogelijk van een effectieve dosis van 3,75 mg).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder en oplosmiddel voor suspensie voor injectie.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Prostaatkanker
- Behandeling van plaatselijk gevorderde of gemetastaseerde hormoongevoelige prostaatkanker.
- Als neo-adjuvante, gelijktijdige of adjuvante behandeling bij radiotherapie bij hoog-risico gelokaliseerde of lokaal gevorderde prostaatkanker (zie ook rubriek 5.1).
Endometriose
Behandeling van endometriose met genitale en extragenitale lokalisatie.
Fibromen
Behandeling van fibromen van de uterus voorafgaand aan chirurgie:
- indien geassocieerd met anemie (hemoglobine ≤ 8 g/dl)
- indien de grootte van het fibroom gereduceerd moet worden om endoscopische of transvaginale chirurgie te vergemakkelijken of mogelijk te maken.
Vrouwelijke onvruchtbaarheid
Optimalisatie van de ovariële stimulatie door combinatie van Decapeptyl Sustained Release en exogene gonadotrofinen (HMG, FSH, HCG) in het kader van een in vitro fertilisatie gevolgd door een embryotransfer (IVF-ET), een intra-fallopische transfert van gameten (GIFT) of een intra-fallopische transfert van zygoten (ZIFT).
Borstkanker
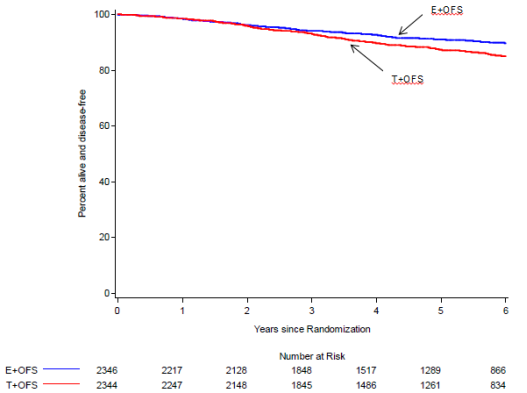
Als adjuvante behandeling, in combinatie met tamoxifen of een aromataseremmer, van hormoongevoelige borstkanker in een vroegtijdig stadium bij vrouwen met een hoog risico op recidief en een bevestigde premenopauzale status na beëindiging van de chemotherapie (zie rubrieken 4.3, 4.4, 4.8 en 5.1).
Vroegtijdige puberteit van centrale oorsprong
Vóór de leeftijd van 8 jaar bij meisjes en vóór de leeftijd van 10 jaar bij jongens.
4.2 Dosering en wijze van toediening
Dosering
Omdat Decapeptyl Sustained Release 3,75 mg een suspensie van microsferen is, moet een onbedoelde intravasculaire injectie strikt vermeden worden.
Decapeptyl Sustained Release 3,75 mg moet toegediend worden onder toezicht van een arts.
Er is geen dosisaanpassing vereist voor patiënten met een verminderde nier- of leverfunctie.
Het is belangrijk de injecties nauwkeurig volgens de instructies in de bijsluiter uit te voeren.
Elke verkeerde handeling waarbij het verlies van suspensie groter is dan de hoeveelheid die normaal in het voor de injectie gebruikte materiaal achterblijft, moet worden gemeld.
Na het bereiden van de suspensie dient de injectie onmiddellijk diep intramusculair te worden toegediend.
Prostaatkanker
1 intramusculaire injectie met Decapeptyl Sustained Release om de 4 weken.
Behandelingsduur: zie rubriek 5.1.
Endometriose
1 intramusculaire injectie met Decapeptyl Sustained Release om de 4 weken. De behandeling moet binnen de 5 eerste dagen van de cyclus worden begonnen.
De behandelingsduur is afhankelijk van de initiële ernst van de endometriose en van de evolutie van de klinische (functionele en anatomische) verschijnselen bij de behandeling. In principe bedraagt de duur 4 tot 6 maanden. De behandeling mag niet langer dan 6 maanden worden toegediend (zie rubriek 4.8). Een tweede behandeling met triptoreline of een ander GnRH-analoog wordt niet aanbevolen. Er werd aangetoond bij patiënten die met GnRH-analogen worden behandeld voor endometriose, de toevoeging van een add-back-therapy (ABT – een oestrogeen en een progestageen) het verlies van minerale botdensiteit en de vasomotorische symptomen vermindert. Indien gepast, dient ABT daarom gelijktijdig met de GnRH-analoog worden toegediend, rekening houdend met de risico's en de baten van elke behandeling.
Fibroom
1 intramusculaire injectie met Decapeptyl Sustained Release om de 4 weken. De behandeling moet binnen de eerste 5 dagen van de menstruatiecyclus worden begonnen. De duur van de behandeling mag niet meer dan 3 maanden bedragen.
Vrouwelijke onvruchtbaarheid
1 intramusculaire injectie van Decapeptyl Sustained Release vanaf de tweede dag van de cyclus.
Doorgaans wordt stimulatie met gonadotrofinen uitgevoerd als de concentratie van de oestrogenen lager is dan 50 pg/ml (meestal rond de 15e dag).
Borstkanker
1 intramusculaire injectie om de 4 weken in combinatie met tamoxifen of een aromataseremmer.
De behandeling met triptoreline moet gestart worden na voltooiing van de chemotherapie, zodra de premenopauzale status werd bevestigd (zie rubriek 4.4).
De behandeling met triptoreline moet ingesteld worden minstens 6-8 weken voordat de behandeling met de aromataseremmer wordt gestart. Minimum 2 injecties van triptoreline (met een interval van 4 weken tussen de injecties) moeten toegediend worden voordat de behandeling met de aromataseremmer wordt gestart.
Tijdens de behandeling met een aromataseremmer mag de toediening van triptoreline niet onderbroken worden om een rebound stijging van de circulerende oestrogeenspiegels bij premenopauzale vrouwen te voorkomen.
In het kader van een adjuvante behandeling in combinatie met een andere hormoontherapie is de aanbevolen behandelingsduur maximum 5 jaar.
Pediatrische patiënten
Vroegtijdige puberteit van centrale oorsprong
De behandeling van kinderen met triptoreline moet gebeuren onder toezicht van een endocrinoloog-pediater of een pediater of een endocrinoloog met ervaring in de behandeling van vroegtijdige puberteit van centrale oorsprong.
Kinderen met een lichaamsgewicht van meer dan 30 kg: 1 intramusculaire injectie om de 4 weken (28 dagen).
Kinderen met een lichaamsgewicht tussen 20 en 30 kg: twee derden van de dosis langs intramusculaire weg, om de 4 weken (28 dagen); d.w.z. dien twee derden van het volume van de gereconstitueerde suspensie toe.
Kinderen met een lichaamsgewicht lager dan 20 kg: de helft van de dosis langs intramusculaire weg, om de 4 weken (28 dagen); d.w.z. dien de helft van het volume van de gereconstitueerde suspensie toe.
De behandeling moet worden gestopt rond de fysiologische leeftijd van de puberteit bij jongens en meisjes, en het wordt aanbevolen dat de behandeling niet wordt voortgezet bij meisjes met een botrijping van meer dan 12-13 jaar. Er zijn beperkte gegevens beschikbaar bij jongens in verband met het optimale tijdstip om de behandeling te stoppen op basis van de botleeftijd; er wordt echter aanbevolen om de behandeling te stoppen bij jongens met een botrijpingsleeftijd van 13-14 jaar.
4.3 Contra-indicaties
Overgevoeligheid voor GnRH, GnRH-analogen of voor één van de in rubriek 6.1 vermelde hulpstoffen.
Zwangerschap en borstvoedingsperiode.
In het kader van borstkanker bij premenopauzale vrouwen: Een behandeling met een aromataseremmer instellen voordat adequate ovariële suppressie met triptoreline werd bereikt (zie rubrieken 4.2 en 4.4).
4.8 Bijwerkingen
Ervaring tijdens klinische studies
Algemene tolerantie bij mannen (zie rubriek 4.4)
Aangezien patiënten met lokaal gevorderde of gemetastaseerde, hormoonafhankelijke prostaat-kanker over het algemeen oud zijn en andere ziekten hebben die vaak voorkomen in deze oudere populatie, rapporteerde meer dan 90% van de patiënten die ingesloten werden in klinische studies, bijwerkingen, en vaak is het causaal verband moeilijk te evalueren. Zoals werd vastgesteld met andere GnRH-agonistische behandelingen of na heelkundige castratie waren de vaakst waargenomen bijwerkingen in verband met triptoreline te wijten aan zijn verwachte farmacologische effecten. Deze effecten omvatten opvliegers en verminderde libido.
Met uitzondering van immuno-allergische reacties (zelden) en reacties op de injectieplaats (< 5%), is van alle bijwerkingen bekend dat ze gerelateerd zijn aan veranderingen in de testosteronspiegel.
De volgende bijwerkingen die beschouwd werden als op zijn minst mogelijk gerelateerd aan de behandeling met triptoreline, werden gemeld. Van de meeste van deze bijwerkingen is bekend dat ze verband houden met biochemische of heelkundige castratie.
De frequentie van de bijwerkingen werd als volgt ingedeeld: zeer vaak (≥1/10); vaak (≥1/100 tot <1/10); soms (≥1/1.000 tot <1/100); zelden (≥1/10.000 tot <1/1.000); frequentie niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Systeem/ orgaanklassen | Zeer vaak | Vaak | Soms | Zelden | Aanvullende postmarketing-gegevens |
Infecties en parasitaire aandoeningen |
|
|
| Nasofaryngitis |
|
Bloed- en lymfestelsel-aandoeningen |
|
| Trombocytose |
| Anemie |
Immuun-systeem-aandoeningen |
| Overgevoelig-heid |
| Anafylactische reactie | Anafylactische shock |
Voedings- en stofwisselings-stoornissen |
|
| Anorexia |
|
|
Psychische stoornissen | Verminderde libido | Depressie* | Slapeloosheid | Verwardheid | Angst |
Zenuwstelsel-aandoeningen | Paresthesie onderste ledematen | Duizeligheid | Paresthesie | Verminderd geheugen |
|
Oog-aandoeningen |
|
| Gezichts-beperking | Abnormaal gevoel in het oog |
|
Evenwichts-orgaan- en oor-aandoeningen |
|
| Tinnitus |
|
|
Endocriene aandoeningen |
|
|
|
| Hypofysaire apoplexie** |
Hart-aandoeningen |
|
| Palpitaties |
| QT verlenging* (zie rubrieken 4.4 en 4.5) |
Bloedvat-aandoeningen | Warmte-opwelling | Hypertensie |
| Hypotensie |
|
Ademhalings-stelsel-, borstkas- en mediastinum-aandoeningen |
|
| Dyspnoe | Orthopnoe |
|
Maag-darmstelsel-aandoeningen |
| Droge mond | Buikpijn | Abdominale distensie |
|
Huid- en onderhuid-aandoeningen | Hyperhidrose |
| Acne | Blaarvorming | Angio-neurotisch oedeem |
Skeletspier-stelsel- en bindweefsel-aandoeningen | Rugpijn | Musculoskele-tale pijn | Artralgie | Gewrichts-stijfheid |
|
Nier- en urineweg-aandoeningen |
|
| Nycturie |
| Urine-incontinentie |
Voortplantings-stelsel- en borst-aandoeningen | Erectiele dysfunctie (waaronder ejaculatiefalen, ejaculatie-stoornis) | Bekkenpijn | Gynaecomastie |
|
|
Algemene aandoeningen en toedienings-plaats-stoornissen | Asthenie | Reactie op de injectieplaats (waaronder erytheem, inflammatie en pijn) | Lethargie | Pijn in de borstkas | Malaise |
Onderzoeken |
| Gewichtstoe-name | Verhoogde alanine-amino-transferase | Verhoogde alkalische fosfatasen in bloed |
|
*Deze frequentie is gebaseerd op klasse-effect frequenties die gemeenschappelijk zijn voor alle GnRH-agonisten. | |||||
Triptoreline veroorzaakt een tijdelijke stijging van de serumtestosteronspiegels binnen de eerste week na de eerste injectie van de vorm met verlengde vrijstelling. Door deze initiële stijging van de serumtestosteronspiegels kan een klein percentage patiënten (≤ 5%) een tijdelijke verergering van de tekens en symptomen van hun prostaatkanker (tumor flare) ervaren, wat zich doorgaans uit in toegenomen urinaire symptomen (< 2%) en metastatische pijn (5%), die symptomatisch kunnen behandeld worden. Deze symptomen zijn van voorbijgaande aard en verdwijnen meestal binnen één tot twee weken.
Er waren geïsoleerde gevallen van verergering van ziektesymptomen, urethraobstructie of ruggenmergcompressie door metastase. Daarom moeten patiënten met metastatische wervelletsels en/of obstructie van de bovenste of onderste urinewegen van nabij opgevolgd worden tijdens de eerste weken van de behandeling (zie rubriek 4.4).
Het gebruik van GnRH-agonisten als behandeling van prostaatkanker kan gepaard gaan met toegenomen botverlies en kan osteoporose en een verhoogd fractuurrisico veroorzaken.
Patiënten die een langdurige behandeling met GnRH-analogen in combinatie met radiotherapie krijgen, kunnen meer bijwerkingen hebben, voornamelijk gastro-intestinaal en in verband met de radiotherapie.
Er werd een verhoging van het aantal lymfocyten gemeld bij patiënten onder behandeling met een GnRH-analoog. Deze secundaire lymfocytose houdt blijkbaar verband met de door GnRH veroorzaakte castratie en lijkt er op te wijzen dat geslachtshormonen betrokken zijn bij thymusinvolutie.
Algemene tolerantie bij vrouwen (zie rubriek 4.4)
Ingevolge de lagere oestrogeenspiegels waren de vaakst gemelde bijwerkingen (verwacht bij 10% of meer van de vrouwen) hoofdpijn, verminderde libido, slaapstoornissen, stemmingswisselingen, dyspareunie, dysmenorree, genitale bloeding, ovarieel hyperstimulatiesyndroom, ovarium-hypertrofie pelvische pijn, seborroe, vulvovaginale droogte, hyperhidrose, opvliegers en asthenie.
De volgende bijwerkingen, die beschouwd werden als minstens mogelijks gerelateerd aan de behandeling met triptoreline, werden gemeld.
De frequentie van de bijwerkingen werd als volgt ingedeeld: zeer vaak (≥1/10); vaak (≥1/100 tot <1/10); soms (≥1/1.000 tot <1/100); frequentie niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Systeem/orgaan-klassen | Zeer vaak | Vaak | Soms | Aanvullende postmarketing-gegevens |
Immuunsysteem-aandoeningen |
| Overgevoeligheid |
| Anafylactische shock |
Voedings- en stofwisselings-stoornissen |
|
| Verminderde eetlust Vochtretentie |
|
Psychische stoornissen | Slaapstoornis | Depressie* | Emotionele labiliteit | Verwardheid |
Zenuwstelsel-aandoeningen | Hoofdpijn | Duizeligheid | Dysgeusie | Convulsies**** |
Oogaandoeningen |
|
| Droge ogen Gezichtsbeperking | Visusstoornis |
Evenwichtsorgaan- en ooraandoeningen |
|
| Vertigo |
|
Endocriene aandoeningen |
|
|
| Hypofysaire apoplexie*** |
Hartaandoeningen |
|
| Palpitaties |
|
Bloedvat-aandoeningen | Opvliegers |
|
| Hypertensie |
Ademhalings-stelsel-, borstkas- en mediastinum-aandoeningen |
|
| Dyspnoe |
|
Maagdarmstelsel-aandoeningen |
| Nausea | Opgezette buik | Diarree |
Huid- en onderhuid-aandoeningen | Acne |
| Alopecia | Angioneurotisch oedeem |
Skeletspierstelsel- en bindweefsel-aandoeningen |
| Artralgie | Rugpijn | Spierzwakte |
Voortplantings-stelsel- en borstaandoeningen | Borststoornis | Borstpijn | Coïtale bloeding | Amenorree |
Algemene aandoeningen en toedieningsplaats-stoornissen | Asthenie | Reactie op de injectieplaats (waaronder pijn, zwelling, erytheem en inflammatie) |
| Pyrexie |
Onderzoeken |
| Gewichtstoename | Gewichtsafname | Verhoogde alkalische fosfatase in bloed |
*Langetermijngebruik: deze frequentie is gebaseerd op klasse-effect frequenties die gemeenschappelijk zijn voor alle GnRH agonisten.
**Kortetermijngebruik: deze frequentie is gebaseerd op klasse-effect frequenties die gemeenschappelijk zijn voor alle GnRH agonisten
***Gerapporteerd na initiële toediening bij patiënten met een hypofysair adenoom
****Tijdens postmarketing ervaring werden convulsies gemeld bij patiënten behandeld met GnRH-analogen, waaronder triptoreline.
Bij het begin van de behandeling kunnen de symptomen van endometriose, waaronder pelvische pijn en dysmenorree, zeer vaak (≥ 10%) verergeren tijdens de initiële tijdelijke stijging van de oestradiol plasmaspiegels. Deze symptomen zijn van voorbijgaande aard en verdwijnen meestal binnen één tot twee weken.
Genitale bloeding, waaronder menorragie en metrorragie, kunnen voorkomen in de maand na de eerste injectie.
Bij gebruik als behandeling van infertiliteit kan de combinatie met gonadotrofines aanleiding geven tot ovarieel hyperstimulatiesyndroom. Ovariële hypertrofie, pelvische en/of buikpijn kunnen waargenomen worden.
Borstkanker
In de TEXT en SOFT studies waren de vaakst waargenomen bijwerkingen bij gebruik van triptoreline in combinatie met tamoxifen of een aromataseremmer gedurende een periode van maximum 5 jaar: warmteopwellingen, musculoskeletale stoornissen, vermoeidheid, insomnia, hyperhidrosis, vulvovaginale droogte en depressie.
De frequenties van de bijwerkingen die gemeld werden met triptoreline in combinatie met tamoxifen (N = 2325) of exemestaan (N = 2318), worden vermeld in de onderstaande tabel. De frequentie van de bijwerkingen wordt als volgt ingedeeld: zeer vaak (≥1/10); vaak (≥1/100 tot <1/10); soms (≥1/1.000 tot <1/100), zelden (≥1/10.000 tot <1/1.000); frequentie niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Systeem/orgaan-klassen | Zeer vaak | Vaak | Soms | Aanvullende postmarketing-gegevens |
Hartaandoeningen |
|
| Myocardischemie | QT-verlenging |
Voedings- en stofwisselingsstoornissen |
| Diabetes mellitus |
|
|
Maagdarmstelsel-aandoeningen | Misselijkheid |
|
|
|
Algemene aandoeningen en toedieningsplaats-stoornissen | Vermoeidheid | Reactie op de injectieplaats |
|
|
Immuunsysteem-aandoeningen |
| Overgevoeligheid |
|
|
Skeletspierstelsel- en bindweefsel- | Musculoskeletale stoornis | Fractuur |
|
|
Zenuwstelsel- |
|
| Cerebrale ischemie |
|
Psychische stoornissen | Insomnia |
|
|
|
Nier- en urineweg- | Urine-incontinentie |
|
|
|
Voortplantingsstelsel- en borstaandoeningen | Dyspareunie |
|
|
|
Huid- en onderhuid-aandoeningen | Hyperhidrosis |
|
|
|
Bloedvat-aandoeningen | Warmteopwellingen | Embolie |
|
|
De hierboven geïdentificeerde bijwerkingen moeten vermeld worden naast de bijwerkingen van triptoreline die geïdentificeerd werden bij mannen en vrouwen, beschreven in de tabellen hierboven, om het bijwerkingenprofiel van het gebruik van OFS in combinatie met exemestaan of tamoxifen volledig te beschrijven.
Bij gebruik van triptoreline in combinatie met exemestaan werd een hogere frequentie van osteoporose gemeld dan in combinatie met tamoxifen (39% versus 25%) (zie rubriek 4.4).
Musculoskeletale stoornissen en fracturen werden ook vaker gemeld in combinatie met exemestaan dan in combinatie met tamoxifen (89% versus 76% en 6.8% versus 5.2%, respectievelijk)
Bij gebruik van triptoreline in combinatie met exemestaan of tamoxifen werd hypertensie gemeld als gerichte bijwerking in een frequentie ‘zeer vaak’ (23% en 22% respectievelijk).
Bij gebruik van triptoreline in combinatie met exemestaan of tamoxifen werden hyperglykemie en diabetes gemeld als gerichte bijwerkingen in een frequentie ‘vaak’ (hyperglykemie: 2,6% en 3,4% respectievelijk; diabetes: 2,3% en 2,3% respectievelijk).
Algemene tolerantie bij pediatrische patiënten (zie rubriek 4.4.)
De frequentie van de bijwerkingen werd als volgt ingedeeld: zeer vaak (≥1/10); vaak (≥1/100 tot <1/10); soms (≥1/1.000 tot <1/100); frequentie niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Systeem/orgaan-klassen | Zeer vaak | Vaak | Soms | Aanvullende postmarketing-gegevens |
Immuunsysteem-aandoeningen |
| Overgevoeligheid |
| Anafylactische shock |
Voedings- en stofwisselings-stoornissen |
|
| Obesitas |
|
Psychische stoornissen |
|
| Stemmings-wisselingen | Emotioneel labiel |
Zenuwstelsel-aandoeningen |
| Hoofdpijn |
| Idiopathische intracraniële hypertensie (pseudotumor cerebri) (zie rubriek 4.4) |
Oogaandoeningen |
|
| Gezichtsbeperking | Visusstoornis |
Bloedvat-aandoeningen |
| Opvliegers |
| Hypertensie |
Ademhalings-stelsel-, borstkas- en mediastinum-aandoeningen |
|
| Epistaxis |
|
Maagdarmstelsel-aandoeningen |
| Buikpijn | Braken |
|
Huid- en onderhuid-aandoeningen |
| Acne | Pruritus | Angioneurotisch oedeem |
Skeletspierstelsel- en bindweefsel-aandoeningen |
|
| Nekpijn | Myalgie |
Voortplantings-stelsel- en borstaandoeningen | Vaginale bloeding (waaronder vaginale hemorragie, onttrekkingsbloeding uteriene bloeding), vaginale afscheiding, vaginale bloeding (waaronder spotting) |
| Borstpijn |
|
Algemene aandoeningen en toedieningsplaats-stoornissen |
| Reactie op de injectieplaats (waaronder pijn, erytheem en inflammatie) | Malaise |
|
Onderzoeken |
| Gewichtstoename |
| Verhoogde prolactine in bloed |
* Tijdens postmarketing ervaring werden convulsies gemeld bij patiënten behandeld met GnRH-analogen, waaronder triptoreline.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten. www.fagg.be. Afdeling Vigilantie: Website: www.eenbijwerkingmelden.be, e-mail: adr@fagg-afmps.be.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
IPSEN nv
Treurenberg 2 - 4, bus 4
1000 Brussel
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE145826
10. DATUM VAN HERZIENING VAN DE TEKST
Datum van goedkeuring: 10/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 0676882 | DECAPEPTYL SR 3,75MG FL LYO IM SOL | L02AE04 | € 93,82 | - | Ja | € 2 | € 1 |