1. NAAM VAN HET GENEESMIDDEL
Somatuline Autogel Injectable 60 mg / 90 mg / 120 mg
oplossing voor injectie in een voorgevulde spuit
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Lanreotide 60 mg, 90 mg, 120 mg, voorkomend als lanreotide acetaat.
Elke voorgevulde spuit bevat een oververzadigde oplossing van lanreotide acetaat, overeenkomend met 0,246 mg lanreotide base/mg oplossing, hetgeen een effectief geïnjecteerde dosis van respectievelijk 60 mg, 90 mg en 120 mg lanreotide garandeert.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Oplossing voor injectie in een voorgevulde spuit.
Witte tot bleekgele, viskeuze en oververzadigde oplossing.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Somatuline Autogel Injectable is aangewezen voor:
- de langetermijnbehandeling van personen met acromegalie wanneer de GroeiHormoonenspiegels (GH) en/of de Insulineachtige GroeiFactor-1 (IGF-1) abnormaal blijven na chirurgie en/of radiotherapie, of bij patiënten voor wie chirurgie en/of radiotherapie geen optie is. Het doel van de behandeling bij acromegalie is de GH- en IGF-1-spiegels te reduceren en waar mogelijk terug te brengen tot normale waarden.
- het verlichten van de symptomen geassocieerd aan acromegalie.
- de behandeling van de klinische symptomen, namelijk flush en diarree, geassocieerd aan carcinoïdtumoren die niet door heelkunde behandeld kunnen worden.
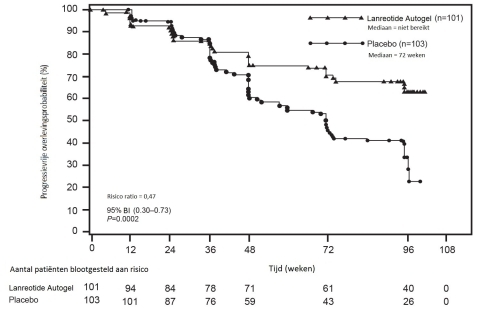
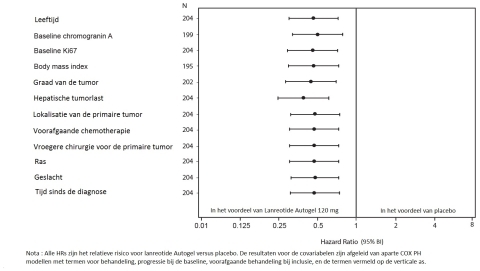
- de behandeling van graad 1 en een subgroep van graad 2 (Ki67 index tot 10%) gastro-enteropancreatische neuro-endocriene tumoren (GEP-NETs) met oorsprong in de middendarm, de pancreas of ongekend, waarbij oorsprong in de einddarm werd uitgesloten, bij volwassen patiënten met niet-reseceerbare lokaal gevorderde of gemetastaseerde ziekte (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
Dosering
Somatuline Autogel Injectable is beschikbaar in drie sterktes met 60 mg, 90 mg en 120 mg lanreotide.
Acromegalie
De aanbevolen startdosis bedraagt 60 tot 120 mg, toe te dienen om de 28 dagen.
Daarna zou de dosis geïndividualiseerd moeten worden, afhankelijk van de respons van de patiënt (zoals beoordeeld wordt door een reductie van de symptomen en/of een reductie in de GH- en/of IGF-1-spiegels).
Indien de gewenste respons niet wordt bereikt, mag de dosis verhoogd worden.
De dosis mag verhoogd worden als GH-niveaus meer dan 2,5 ng/ml bedragen.
Voor GH-niveaus tussen 2,5 ng/ml en 1 ng/ml kan de dosis aangehouden worden indien het leeftijds-aangepaste IGF-1-niveau normaal is.
Als volledige controle word verkregen (gebaseerd op GH-spiegels onder de 1 ng/ml, genormaliseerde IGF-1-spiegels en/of verdwijning van de symptomen), mag de dosis verlaagd worden.
Patiënten, die goed onder controle zijn met een somatostatine-analoog, kunnen om de 42 of 56 dagen met Somatuline Autogel Injectable 120 mg behandeld worden. Bijvoorbeeld, patiënten die goed onder controle zijn met Somatuline Autogel Injectable 60 mg die om de 28 dagen wordt geïnjecteerd, kunnen om de 56 dagen worden behandeld met Somatuline Autogel Injectable 120 mg en patiënten die goed onder controle zijn met Somatuline Autogel Injectable 90 mg die om de 28 dagen wordt geïnjecteerd, kunnen om de 42 dagen worden behandeld met Somatuline Autogel Injectable 120 mg.
Langetermijnmonitoring van de symptomen, GH- en IGF-1-spiegels moet worden uitgevoerd zoals klinisch aangewezen.
Symptomen geassocieerd met carcinoïdtumoren
De aanbevolen startdosis bedraagt 60 tot 120 mg, toe te dienen om de 28 dagen.
De dosis moet aangepast worden in functie van de graad van verlichting van de symptomen die wordt bekomen. De maximale aanbevolen dosis is 120 mg Somatuline Autogel Injectable om de 28 dagen.
Patiënten, die goed onder controle zijn met een somatostatine-analoog, kunnen om de 42 of 56 dagen worden behandeld met Somatuline Autogel Injectable 120 mg. Bijvoorbeeld, patiënten die goed onder controle zijn met Somatuline Autogel Injectable 60 mg die om de 28 dagen wordt geïnjecteerd, kunnen om de 56 dagen worden behandeld met Somatuline Autogel Injectable 120 mg en patiënten die goed onder controle zijn met Somatuline Autogel Injectable 90 mg die om de 28 dagen wordt geïnjecteerd, kunnen om de 42 dagen worden behandeld met Somatuline Autogel Injectable 120 mg. De symptomen moeten nauwlettend worden opgevolgd wanneer wordt overgeschakeld op het verlengde doseringsinterval.
Graad 1 en een subgroep van graad 2 (Ki67 index tot 10%) gastro-enteropancreatische neuro-endocriene tumoren (GEP-NETs) met oorsprong in de middendarm, de pancreas of met onbekende oorsprong waarbij oorsprong in de einddarm werd uitgesloten, bij volwassen patiënten met niet-resecteerbare lokaal gevorderde of gemetastaseerde ziekte
De aanbevolen dosis is één injectie van Somatuline Autogel Injectable 120 mg toegediend om de 28 dagen. De behandeling met Somatuline Autogel Injectable moet voortgezet worden zolang als nodig voor controle van de tumor.
Nier- en/of leverinsufficiëntie
Bij patiënten met gestoorde nier- of leverfunctie is geen dosisaanpassing vereist omwille van het breed therapeutisch venster van lanreotide (zie rubriek 5.2 Farmacokinetische eigenschappen).
Bejaarde patiënten
Bij bejaarde patiënten is geen dosisaanpassing vereist omwille van het breed therapeutisch venster van lanreotide (zie rubriek 5.2 Farmacokinetische eigenschappen).
Pediatrische patiënten
De veiligheid en werkzaamheid van Somatuline Autogel Injectable bij kinderen en adolescenten zijn niet vastgesteld.
Wijze van toediening
Somatuline Autogel Injectable moet diepsubcutaan in het buitenste bovenkwadrant van de bilspier of in de buitenkant van de bovendij worden toegediend.
Patiënten die een vaste dosis Somatuline Autogel Injectable krijgen toegediend, kunnen na een passende opleiding door een gezondheidszorgbeoefenaar, het product ofwel zelf injecteren ofwel laten toedienen door een andere opgeleide persoon. Ingeval van zelfinjectie moet de injectie in het buitenste bovengedeelte van de dij worden toegediend.
Het is de gezondheidszorgbeoefenaar die de beslissing neemt of de injectie door de patiënt of door een andere opgeleide persoon mag worden toegediend.
Ongeacht de toedieningsplaats, mag de huid niet geplooid worden en dient de naald snel en in zijn volledige lengte, perpendiculair t.o.v. de huid te worden ingebracht.
De injectieplaats dient te worden afwisselend tussen de linker- of rechterzijde.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof, somatostatine of verwante peptiden of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Bijwerkingen die in klinische studies gemeld werden door patiënten met acromegalie of GEP-NETs, behandeld met lanreotide, staan vermeld onder de betreffende systeem/orgaanklasse volgens de volgende frequentiegroepen: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1000, < 1/100); niet bekend (kan met de beschikbare gegevens niet worden bepaald).
De meest verwachte bijwerkingen na behandeling met lanreotide zijn gastro-intestinale stoornissen (vaakst gemeld zijn diarree en buikpijn, meestal licht of matig en tijdelijk), cholelithiase (vaak asymptomatisch) en injectieplaatsreacties (pijn, knobbelvorming en induratie).
Het bijwerkingenprofiel is vergelijkbaar voor alle indicaties.
Systeem/orgaanklasse | Zeer vaak (≥1/10) | Vaak | Soms (≥1/1000, <1/100) | Post-marketing veiligheids-ervaring |
Immuunsysteemaandoeningen |
|
|
| Allergische reacties (inclusief angio-oedeem, anafylaxie, overgevoeligheid) |
Voedings- en stofwisselingsstoornissen |
| Hypoglycemie, verminderde |
|
|
Psychische stoornissen |
|
| Slapeloosheid* |
|
Zenuwstelselaandoeningen |
| Duizeligheid, hoofdpijn, lethargie** |
|
|
Hartaandoeningen |
| Sinusbradycardie* |
|
|
Bloedvataandoeningen |
|
| Opvliegers* |
|
Maagdarmstelselaandoeningen | Diarree, slappe stoelgang*, buikpijn | Nausea, | Bleke stoelgang* | Pancreas-exocriene insufficiëntie, pancreatitis |
Lever- en galaandoeningen | Cholelithiase | Galdilatatie* |
| Cholecystitis, |
Huid- en onderhuidaandoeningen |
| Alopecia, hypotrichose* |
|
|
Skeletspierstelsel- en bindweefselaandoeningen |
| Musculoskeletale pijn**, |
|
|
Algemene aandoeningen en toedieningsplaatsstoornissen |
| Asthenie, |
| Abces op injectieplaats |
Onderzoeken |
| Verhoogde ALAT*, abnormale ASAT*, abnormale ALAT*, verhoogde bilirubinemie*, verhoogde glycemie*, verhoogde geglycosyleerde hemoglobine*, gewichtsverlies, verlaagde pancreasenzymen** | Verhoogde ASAT*, verhoogde alkalische fosfatasen in het bloed*, abnormale bilirubinemie*, verlaagde natriëmie* |
|
* gebaseerd op een pool van studies uitgevoerd bij patiënten met acromegalie
** gebaseerd op een pool van studies uitgevoerd bij patiënten met GEP-NETs
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten, Afdeling Vigilantie. Galileelaan 5/03, 1210 BRUSSEL. Website: www.eenbijwerkingmelden.be. e-mail: adr@fagg.be.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
IPSEN nv
Treurenberg 2 - 4 bus 4
1000 Brussel
België
8. NUMMERS VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Somatuline Autogel Injectable 60 mg oplossing voor injectie in een voorgevulde spuit: BE234062
Somatuline Autogel Injectable 90 mg oplossing voor injectie in een voorgevulde spuit: BE234071
Somatuline Autogel Injectable 120 mg oplossing voor injectie in een voorgevulde spuit: BE234087
10. DATUM VAN HERZIENING VAN DE TEKST
Goedkeuringsdatum: 10/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 1720424 | SOMATULINE AUTOGEL INJECT 60 MG SER 1X0,5ML | H01CB03 | € 673,24 | - | Ja | € 12,5 | € 8,3 |
| 1720432 | SOMATULINE AUTOGEL INJECT 120 MG SER 1X0,5ML | H01CB03 | € 1023,88 | - | Ja | € 12,5 | € 8,3 |
| 1720440 | SOMATULINE AUTOGEL INJECT 90 MG SER 1X0,5ML | H01CB03 | € 804,64 | - | Ja | € 12,5 | € 8,3 |