BIJLAGE I
SAMENVATTING VAN DE PRODUCTKENMERKEN
![]() Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
1. NAAM VAN HET GENEESMIDDEL
Tibsovo 250 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke filmomhulde tablet bevat 250 mg ivosidenib.
Hulpstof met bekend effect
Elke filmomhulde tablet bevat lactosemonohydraat overeenkomend met 9,5 mg lactose (zie rubriek 4.4).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tablet (tablet)
Blauwe, ovale filmomhulde tabletten van ongeveer 18 mm lang met ‘IVO’ aan de ene zijde en ‘250’ aan de andere zijde gedrukt.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
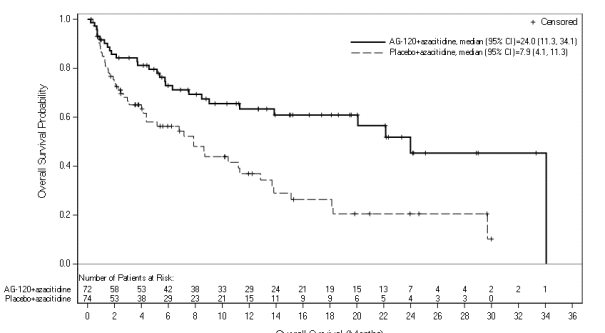
Tibsovo in combinatie met azacitidine is geïndiceerd voor de behandeling van volwassen patiënten met nieuw gediagnosticeerde acute myeloïde leukemie (AML) met een R132-mutatie in isocitraatdehydrogenase-1 (IDH1), die niet in aanmerking komen voor standaard inductiechemotherapie (zie rubriek 5.1).
Monotherapie met Tibsovo is geïndiceerd voor de behandeling van volwassen patiënten met lokaal gevorderd of gemetastaseerd cholangiocarcinoom met een R132-mutatie in IDH1 die eerder zijn behandeld met minstens één eerdere lijn van systemische therapie (zie rubriek 5.1).
4.2 Dosering en wijze van toediening
De behandeling moet worden ingesteld onder toezicht van een arts die ervaring heeft met het gebruik van geneesmiddelen tegen kanker.
Alvorens Tibsovo te gebruiken, moeten patiënten een R132-mutatie in IDH1 hebben die bevestigd is met een passende diagnostische test.
Dosering
Acute myeloïde leukemie
De aanbevolen dosering is 500 mg ivosidenib (2 x 250 mg tabletten) oraal eenmaal daags.
Ivosidenib dient te worden gestart op dag 1 van cyclus 1 in combinatie met azacitidine 75 mg/m2 lichaamsoppervlak, intraveneus of subcutaan, eenmaal daags op dag 1-7 van elke cyclus van 28 dagen. De eerste behandelingscyclus van azacitidine dient in 100% van de dosis te worden gegeven. Het wordt aanbevolen om patiënten gedurende minimaal 6 cycli te behandelen.
Raadpleeg voor de dosering en wijze van toediening van azacitidine de volledige productinformatie voor azacitidine.
De behandeling dient te worden voortgezet tot ziekteprogressie of tot de patiënt de behandeling niet meer verdraagt.
Cholangiocarcinoom
De aanbevolen dosis is 500 mg ivosidenib (2 x 250 mg tabletten) eenmaal daags oraal ingenomen.
De behandeling dient te worden voortgezet tot ziekteprogressie of tot de patiënt de behandeling niet meer verdraagt.
Gemiste of uitgestelde dosis
Als een dosis wordt gemist of niet op het gebruikelijke tijdstip wordt ingenomen, dienen de tabletten zo snel mogelijk binnen 12 uur na de gemiste dosis te worden ingenomen. Twee doses mogen niet binnen 12 uur worden ingenomen. De tabletten moeten op het gebruikelijke tijdstip op de volgende dag worden ingenomen.
Als er een dosis wordt uitgebraakt, mogen er geen vervangende tabletten worden ingenomen. De tabletten moeten op het gebruikelijke tijdstip op de volgende dag worden ingenomen.
Te nemen voorzorgsmaatregelen voorafgaand aan toediening en controle
Voorafgaand aan het instellen van de behandeling moet er een elektrocardiogram (ECG) worden gemaakt. Voorafgaand aan het instellen van de behandeling dient het voor hartslag gecorrigeerde QT-interval (QTc) korter te zijn dan 450 ms en indien er sprake is van een abnormaal QT-interval dienen zorgverleners de baten/risicoverhouding van het instellen van ivosidenib grondig opnieuw te beoordelen. Indien de verlenging van het QTc-interval tussen 480 ms en 500 ms is, dient de behandeling met ivosidenib tot uitzonderlijke gevallen beperkt te blijven en gepaard te gaan met nauwlettende controle.
Er dient een ECG te worden gemaakt vóór het instellen van de behandeling, minstens wekelijks in de eerste 3 weken van behandeling en daarna maandelijks indien het QTc-interval ≤ 480 ms blijft. Afwijkingen in het QTc-interval dienen direct te worden behandeld (zie tabel 1 en rubriek 4.4). Bij symptomen die daarop wijzen, dient een ECG te worden gemaakt indien klinisch noodzakelijk.
Gelijktijdige toediening van geneesmiddelen waarvan bekend is dat ze het QTc-interval verlengen of van matige of krachtige CYP3A4-remmers kan het risico van verlenging van het QTc-interval verhogen en dienen waar mogelijk te worden vermeden tijdens behandeling met Tibsovo. Indien het gebruik van een geschikt alternatief niet mogelijk is, dienen patiënten met voorzichtigheid te worden behandeld en nauwlettend te worden gecontroleerd op verlenging van het QTc-interval. Voorafgaand aan gelijktijdige toediening dient er een ECG te worden gemaakt en dient de patiënt gedurende minstens 3 weken wekelijks te worden gecontroleerd en daarna indien klinisch noodzakelijk (zie hieronder en rubriek 4.4, 4.5 en 4.8).
Volledig bloedbeeld en bloedchemie dienen te worden beoordeeld voorafgaand aan het instellen van Tibsovo, minstens eens per week gedurende de eerste maand van behandeling, eens in de twee weken gedurende de tweede maand en indien klinisch noodzakelijk bij elk medisch bezoek voor de duur van de therapie.
Dosisaanpassing voor gelijktijdige toediening van matige of krachtige CYP3A4-remmers
Indien het gebruik van matige of krachtige CYP3A4-remmers niet kan worden vermeden, dient de aanbevolen dosis ivosidenib te worden verlaagd naar 250 mg (1 x 250 mg tablet) eenmaal daags. Indien er met de matige of krachtige CYP3A4-remmer wordt gestopt, dient de dosis ivosidenib na minstens 5 halfwaardetijden van de CYP3A4-remmer te worden verhoogd naar 500 mg (zie boven en rubriek 4.4 en 4.5).
Dosisaanpassing en behandelingsaanbevelingen voor bijwerkingen
Tabel 1 - Aanbevolen dosisaanpassingen voor bijwerkingen | |
Bijwerking | Aanbevolen actie |
Differentiatiesyndroom |
|
Leukocytose (aantal witte bloedcellen > 25 x 109/l of een absolute toename in totaal aantal witte bloedcellen > 15 x 109/l vanaf baseline, zie rubriek 4.4 en 4.8) |
|
Verlenging van QTc-interval ˃ 480 tot 500 ms |
|
Verlenging van QTc-interval ˃ 500 ms |
|
Verlenging van QTc-interval met klachten/verschijnselen van levensbedreigende ventriculaire aritmie |
|
Andere bijwerkingen van graad 3 of hoger |
|
Graad 1 is licht, graad 2 is matig, graad 3 is ernstig, graad 4 is levensbedreigend.
Speciale populaties
Ouderen
Voor oudere patiënten (≥ 65 jaar) is geen dosisaanpassing vereist (zie rubriek 4.8 en 5.2). Er zijn geen gegevens beschikbaar voor patiënten van 85 jaar of ouder.
Nierfunctiestoornis
Er is geen dosisaanpassing vereist bij patiënten met een lichte (eGFR ≥ 60 tot ˂ 90 ml/min/1,73 m2) of matige (eGFR ≥ 30 tot ˂ 60 ml/min/1,73 m2) nierfunctiestoornis. Er is geen doseringsadvies vastgesteld voor patiënten met een ernstige nierfunctiestoornis (eGFR ˂ 30 ml/min/1,73 m2). Voorzichtigheid is geboden wanneer Tibsovo wordt gebruikt bij patiënten met een ernstige nierfunctiestoornis en deze patiënten dienen nauwlettend te worden gecontroleerd (zie rubriek 4.4 en 5.2).
Leverfunctiestoornis
Er is geen dosisaanpassing vereist voor patiënten met een lichte leverfunctiestoornis (Child-Pugh-klasse A). Er is geen doseringsadvies vastgesteld voor patiënten met een matige of ernstige leverfunctiestoornis (Child-Pugh-klassen B of C). Voorzichtigheid is geboden wanneer Tibsovo wordt gebruikt bij patiënten met een matige of ernstige leverfunctiestoornis en deze patiënten dienen nauwlettend te worden gecontroleerd (zie rubriek 4.4 en 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van Tibsovo bij kinderen en adolescenten in de leeftijd tot 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Tibsovo is voor oraal gebruik.
De tabletten worden eenmaal daags elke dag op ongeveer hetzelfde tijdstip ingenomen. Patiënten mogen 2 uur voor tot en met 1 uur na het innemen van de tabletten niets eten (zie rubriek 5.2). De tabletten moeten in hun geheel met water worden doorgeslikt.
Patiënten dienen het advies te krijgen om grapefruit (pompelmoes) en grapefruitsap (pompelmoessap) tijdens de behandeling te vermijden (zie rubriek 4.5). Patiënten dienen ook het advies te krijgen om het silicagel-droogmiddel in de tabletfles niet in te slikken (zie rubriek 6.5).
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
Gelijktijdige toediening van krachtige CYP3A4-inductoren of dabigatran (zie rubriek 4.5).
Congenitaal lang-QT-syndroom.
Familievoorgeschiedenis van plotseling overlijden of polymorfe ventriculaire aritmie.
QT/QTc-interval > 500 ms, ongeacht de correctiemethode (zie rubriek 4.2 en 4.4)
4.8 Bijwerkingen
Nieuw gediagnosticeerde acute myeloïde leukemie in combinatie met azacitidine
Samenvatting van het veiligheidsprofiel
De vaakst voorkomende bijwerkingen zijn braken (40%), neutropenie (31%), trombocytopenie (28%), elektrocardiogram QT verlengd (21%), insomnia (19%).
De vaakst voorkomende ernstige bijwerkingen zijn differentiatiesyndroom (8%) en trombocytopenie (3%).
Bij patiënten die met ivosidenib in combinatie met azacitidine werden behandeld, was de frequentie van beëindiging van ivosidenib als gevolg van bijwerkingen 6%. Bijwerkingen die leidden tot staken van de behandeling waren elektrocardiogram QT verlengd (1%), insomnia (1%), neutropenie (1%) en trombocytopenie (1%).
De frequentie van dosisonderbreking van ivosidenib als gevolg van bijwerkingen was 35%. De vaakst voorkomende bijwerkingen die leidden tot dosisonderbreking waren neutropenie (24%), elektrocardiogram QT verlengd (7%), trombocytopenie (7%), leukopenie (4%) en differentiatiesyndroom (3%).
De frequentie van dosisverlaging van ivosidenib als gevolg van bijwerkingen was 19%. Bijwerkingen die leidden tot dosisverlaging waren elektrocardiogram QT verlengd (10%), neutropenie (8%) en trombocytopenie (1%).
Lijst van bijwerkingen (in tabelvorm)
De frequenties van bijwerkingen zijn gebaseerd op onderzoek AG120-C-009, waaraan 72 patiënten met nieuw gediagnosticeerde AML deelnamen, die gerandomiseerd waren naar en behandeld werden met ivosidenib (500 mg per dag) in combinatie met azacitidine. De mediane duur van de behandeling met Tibsovo was 8 maanden (spreiding: 0,1 tot 40,0 maanden). De frequentie van bijwerkingen zijn gebaseerd op frequenties van bijwerkingen met alle oorzaken, waarbij een deel van de voorvallen van een bijwerking andere oorzaken dan ivosidenib kan hebben, zoals de ziekte, andere geneesmiddelen of losstaande oorzaken.
De volgende bijwerkingen zijn gemeld tijdens klinische onderzoeken en zijn volgens de volgende frequentie gerangschikt: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000). Binnen elke frequentiegroep worden bijwerkingen in volgorde van afnemende ernst gepresenteerd.
Tabel 2 - Bijwerkingen gemeld bij patiënten met nieuw gediagnosticeerde AML die behandeld werden met ivosidenib in combinatie met azacitidine in klinisch onderzoek AG120-C-009 (N=72) | ||
Systeem/orgaanklassen | Frequentie | Bijwerkingen |
Bloed- en lymfestelselaandoeningen | Zeer vaak | Differentiatiesyndroom, leukocytose, trombocytopenie, neutropenie |
Vaak | Leukopenie | |
Psychische stoornissen | Zeer vaak | Insomnia |
Zenuwstelselaandoeningen | Zeer vaak | Hoofdpijn, duizeligheid |
Vaak | Neuropathie perifeer | |
Maagdarmstelselaandoeningen | Zeer vaak | Braken1 |
Vaak | Orofaryngeale pijn | |
Skeletspierstelsel- en bindweefselaandoeningen | Zeer vaak | Pijn in extremiteit, artralgie, rugpijn |
Onderzoeken | Zeer vaak | Elektrocardiogram QT verlengd |
1 Gegroepeerde term omvat braken en braakneiging. | ||
Eerder behandeld, lokaal gevorderd of gemetastaseerd cholangiocarcinoom
Samenvatting van het veiligheidsprofiel
De vaakst voorkomende bijwerkingen zijn vermoeidheid (43%), nausea (42%), abdominale pijn (35%), diarree (35%), verminderde eetlust (24%), ascites (23%), braken (23%), anemie (19%) en rash (15%).
De vaakst voorkomende ernstige bijwerkingen zijn ascites (2%), hyperbilirubinemie (2%) en cholestatische geelzucht (2%).
Bij patiënten die met ivosidenib werden behandeld, was de frequentie van beëindiging van de behandeling als gevolg van bijwerkingen 2%. Bijwerkingen die leidden tot beëindiging waren ascites (1%) en hyperbilirubinemie (1%).
De frequentie van dosisonderbreking van ivosidenib als gevolg van bijwerkingen was 16%. De vaakst voorkomende bijwerkingen die leidden tot dosisonderbreking waren hyperbilirubinemie (3%), alanine-aminotransferase verhoogd (3%), aspartaataminotransferase verhoogd (3%), ascites (2%) en vermoeidheid (2%).
De frequentie van dosisverlaging van ivosidenib als gevolg van bijwerkingen was 4%. Bijwerkingen die leidden tot dosisverlaging waren elektrocardiogram QT verlengd (3%), en neuropathie perifeer (1%).
Lijst van bijwerkingen (in tabelvorm)
De frequenties van bijwerkingen zijn gebaseerd op onderzoek AG120-C-005, waaraan 123 patiënten met eerder behandeld, lokaal gevorderd of gemetastaseerd cholangiocarcinoom deelnamen, gerandomiseerd naar en behandeld met 500 mg ivosidenib eenmaal daags. De mediane duur van de behandeling met Tibsovo was 2,8 maanden (spreiding: 0,1 tot 45,1 maanden; gemiddelde [standaarddeviatie (SD)] 6,7 [8,2] maanden).
De frequentie van bijwerkingen zijn gebaseerd op frequenties van bijwerkingen met alle oorzaken, waarbij een deel van de voorvallen van een bijwerking andere oorzaken dan ivosidenib kan hebben, zoals de ziekte, andere geneesmiddelen of losstaande oorzaken.
De volgende bijwerkingen zijn gemeld tijdens klinische onderzoeken en zijn volgens de volgende frequentie gerangschikt: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1.000, < 1/100); zelden (≥ 1/10.000, < 1/1.000); zeer zelden (< 1/10.000). Binnen elke frequentiegroep worden bijwerkingen in volgorde van afnemende ernst gepresenteerd.
Tabel 3 - Bijwerkingen gemeld bij patiënten met lokaal gevorderd of gemetastaseerd cholangiocarcinoom die behandeld werden met ivosidenib in klinisch onderzoek AG120-C-005 (N=123) | ||
Systeem/orgaanklassen | Frequentie | Bijwerkingen |
Bloed- en lymfestelselaandoeningen | Zeer vaak | Anemie |
Voedings- en stofwisselingsstoornissen | Zeer vaak | Verminderde eetlust |
Zenuwstelselaandoeningen | Zeer vaak | Neuropathie perifeer, hoofdpijn |
Maagdarmstelselaandoeningen | Zeer vaak | Ascites, diarree, braken, nausea, abdominale pijn |
Lever- en galaandoeningen | Vaak | Cholestatische geelzucht, hyperbilirubinemie |
Huid- en onderhuidaandoeningen | Zeer vaak | Rash1 |
Algemene aandoeningen en toedieningsplaatsstoornissen | Zeer vaak | Vermoeidheid |
Vaak | Vallen | |
Onderzoeken | Zeer vaak | Aspartaataminotransferase |
Vaak | Elektrocardiogram QT verlengd, alanine-aminotransferase verhoogd, wittebloedceltelling verlaagd, plaatjestelling verlaagd | |
1 Gegroepeerde term omvat rash, rash maculopapuleus, erytheem, rash vlekkerig, dermatitis exfoliatief gegeneraliseerd, geneesmiddeleneruptie en geneesmiddelenovergevoeligheid. | ||
Beschrijving van geselecteerde bijwerkingen
Differentiatiesyndroom bij patiënten met acute myeloïde leukemie (zie rubriek 4.2 en 4.4).
In onderzoek AG120-C-009 ervoer 14% van de 72 patiënten met nieuw gediagnosticeerde AML die met Tibsovo in combinatie met azacitidine werden behandeld differentiatiesyndroom. Geen patiënt beëindigde de behandeling met ivosidenib als gevolg van differentiatiesyndroom, en dosisonderbrekingen (3%) om klachten en verschijnselen te behandelen waren bij een minderheid van de patiënten nodig. Alle 10 patiënten die differentiatiesyndroom ervoeren herstelden na de behandeling of na dosisonderbreking van Tibsovo. De mediane tijd tot aanvang van differentiatiesyndroom was 20 dagen. Tijdens combinatietherapie kwam differentiatiesyndroom tussen 3 dagen en tot 46 dagen na instelling van de behandeling op.
Verlenging van het QT‑interval (zie rubriek 4.2, 4.4 en 4.5)
In onderzoek AG120-C-009 werd bij 21% van de 72 patiënten met nieuw gediagnosticeerde AML die met ivosidenib in combinatie met azacitidine werden behandeld elektrocardiogram QT verlengd gemeld; 11% ervoer reacties van graad 3 of hoger. Op basis van de analyse van de ECG’s bleek 15% van de patiënten die met ivosidenib in combinatie met azacitidine werden behandeld, die minstens één ECG-beoordeling na de baseline hadden, een QTc-interval > 500 ms te hebben en had 24% een toename vanaf baseline-QTc van ˃ 60 ms. Eén procent (1%) van de patiënten beëindigde de behandeling met ivosidenib als gevolg van elektrocardiogram QT verlengd. Dosisonderbreking en ‑verlaging waren vereist bij respectievelijk 7% en 10% van de patiënten. De mediane tijd tot aanvang van QT-verlenging bij met ivosidenib behandelde patiënten was 29 dagen. Elektrocardiogram QT verlengd kwam tussen 1 dag en 18 maanden na instelling van de behandeling op.
In onderzoek AG120-C-005 werd bij 10% van de 123 patiënten met lokaal gevorderd of gemetastaseerd cholangiocarcinoom die met monotherapie met ivosidenib werden behandeld elektrocardiogram QT verlengd gemeld; 2% ervoer reacties van graad 3 of hoger. Op basis van de analyse van de ECG’s had 2% van de patiënten een QTc-interval > 500 ms en had 5% verlenging van het QTc-interval ˃ 60 ms vanaf baseline. Dosisverlaging om tekenen/symptomen te behandelen was vereist bij 3% van de patiënten. De mediane tijd tot aanvang van QT-verlenging bij patiënten behandeld met ivosidenib als monotherapie was 28 dagen. Elektrocardiogram QT verlengd trad tussen 1 dag en 23 maanden na het instellen van de behandeling op.
Speciale populaties
Leverfunctiestoornis
De veiligheid en werkzaamheid van ivosidenib is niet vastgesteld bij patiënten met een matige of ernstige leverfunctiestoornis (Child-Pugh-klasse B of C). Een trend naar een hogere incidentie van bijwerkingen werd waargenomen bij patiënten met een lichte leverfunctiestoornis (Child-Pugh-klasse A) (zie rubriek 4.2 en 5.2).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Voor België ( zie details hieronder).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie
Website: www.eenbijwerkingmelden.be
E-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Frankrijk
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/23/1728/001
10. DATUM VAN HERZIENING VAN DE TEKST
08/2024
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4696035 | TIBSOVO 250MG FILMOMH TABL 60 | - | € 13800 | Ja | - | - |