![]() Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
1. NAAM VAN HET GENEESMIDDEL
Bylvay 200 microgram harde capsules
Bylvay 400 microgram harde capsules
Bylvay 600 microgram harde capsules
Bylvay 1200 microgram harde capsules
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Bylvay 200 microgram harde capsules
Elke harde capsule bevat odevixibat-sesquihydraat, overeenkomend met 200 microgram odevixibat
Bylvay 400 microgram harde capsules
Elke harde capsule bevat odevixibat-sesquihydraat, overeenkomend met 400 microgram odevixibat
Bylvay 600 microgram harde capsules
Elke harde capsule bevat odevixibat-sesquihydraat, overeenkomend met 600 microgram odevixibat
Bylvay 1200 microgram harde capsules
Elke harde capsule bevat odevixibat-sesquihydraat, overeenkomend met 1200 microgram odevixibat
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Harde capsule
Bylvay 200 microgram harde capsules
Capsule maat 0 (21,7 mm × 7,64 mm) met ivoorkleurige, opake dop en witte, opake romp, met het opschrift “A200” in zwarte inkt.
Bylvay 400 microgram harde capsules
Capsule maat 3 (15,9 mm × 5,82 mm) met oranje, opake dop en witte, opake romp, met het opschrift “A400” in zwarte inkt.
Bylvay 600 microgram harde capsules
Capsule maat 0 (21,7 mm × 7,64 mm) met ivoorkleurige, opake dop en romp, met het opschrift “A600” in zwarte inkt.
Bylvay 1200 microgram harde capsules
Capsule maat 3 (15,9 mm × 5,82 mm) met oranje, opake dop en romp, met het opschrift “A1200” in zwarte inkt.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
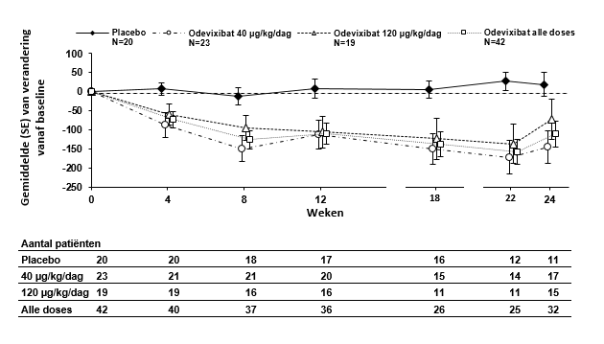
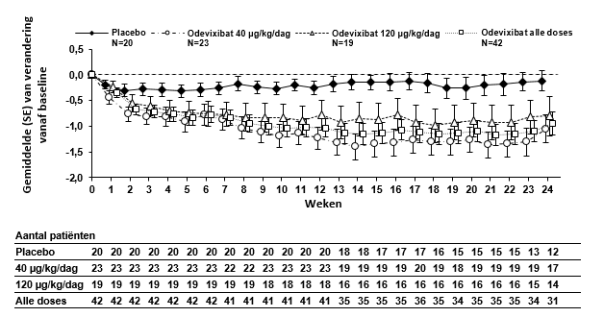
Bylvay is geïndiceerd voor de behandeling van progressieve familiaire intrahepatische cholestase (PFIC) bij patiënten in de leeftijd van 6 maanden of ouder (zie rubrieken 4.4 en 5.1).
4.2 Dosering en wijze van toediening
De therapie moet worden ingesteld door en uitgevoerd onder toezicht van een arts die ervaring heeft met de behandeling van PFIC.
Dosering
De aanbevolen dosis odevixibat is 40 μg/kg eenmaal daags ’s ochtends oraal toegediend. Odevixibat kan met of zonder voedsel worden ingenomen.
Tabel 1 vermeldt de sterkte en het aantal capsules dat op basis van het lichaamsgewicht dagelijks moet worden toegediend om bij benadering tot een dosering van 40 μg/kg/dag te komen.
Tabel 1: Aantal benodigde capsules Bylvay om de nominale dosis van 40 μg/kg/dag te bereiken
Lichaamsgewicht (kg) | Aantal capsules van 200 μg |
| Aantal capsules van 400 μg |
4 tot < 7,5 | 1 | of | N.v.t. |
7,5 tot < 12,5 | 2 | of | 1 |
12,5 tot < 17,5 | 3 | of | N.v.t. |
17,5 tot < 25,5 | 4 | of | 2 |
25,5 tot < 35,5 | 6 | of | 3 |
35,5 tot < 45,5 | 8 | of | 4 |
45,5 tot < 55,5 | 10 | of | 5 |
≥ 55,5 | 12 | of | 6 |
Vetgedrukte sterkten/aantallen van capsules worden aanbevolen, omdat deze naar verwachting makkelijk toe te dienen zijn.
Dosisescalatie
Na aanvang van de behandeling met odevixibat kan bij sommige patiënten geleidelijk een verbetering in pruritus en een daling van het serumgalzuur optreden. Als na drie maanden ononderbroken behandeling geen adequate klinische respons is bereikt, kan de dosis worden verhoogd tot 120 μg/kg/dag (zie rubriek 4.4).
Tabel 2 vermeldt de sterkte en het aantal capsules dat op basis van het lichaamsgewicht dagelijks moet worden toegediend om bij benadering tot een dosering van 120 μg/kg/dag te komen, met een maximale dagelijkse dosis van 7200 μg per dag.
Tabel 2: Aantal benodigde capsules Bylvay om de nominale dosis van 120 μg/kg/dag te bereiken
Lichaamsgewicht (kg) | Aantal capsules van 600 μg |
| Aantal capsules van 1200 μg |
4 tot < 7,5 | 1 | of | N.v.t. |
7,5 tot < 12,5 | 2 | of | 1 |
12,5 tot < 17,5 | 3 | of | N.v.t. |
17,5 tot < 25,5 | 4 | of | 2 |
25,5 tot < 35,5 | 6 | of | 3 |
35,5 tot < 45,5 | 8 | of | 4 |
45,5 tot < 55,5 | 10 | of | 5 |
≥ 55,5 | 12 | of | 6 |
Vetgedrukte sterkten/aantallen van capsules worden aanbevolen, omdat deze naar verwachting makkelijk toe te dienen zijn.
Voor patiënten bij wie na zes maanden ononderbroken dagelijkse behandeling met odevixibat geen behandelvoordeel kan worden vastgesteld, moet een alternatieve behandeling worden overwogen.
Gemiste doses
Als een dosis odevixibat wordt gemist, moet de patiënt de vergeten dosis zo snel mogelijk innemen, zonder de eenmaaldaagse dosis te overschrijden.
Bijzondere populaties
Nierfunctiestoornis
Er zijn geen klinische gegevens beschikbaar voor het gebruik van odevixibat bij patiënten met een matige of ernstige nierfunctiestoornis of terminale nierziekte waarvoor hemodialyse nodig is (zie rubriek 5.2). Vanwege de verwaarloosbare uitscheiding via de nieren, is er echter geen dosisaanpassing vereist voor patiënten met een lichte tot matige nierfunctiestoornis.
Leverfunctiestoornis
Er is geen dosisaanpassing nodig voor patiënten met een lichte of matige leverfunctiestoornis (zie rubrieken 5.1 en 5.2). Odevixibat is onvoldoende bestudeerd bij patiënten met een ernstige leverfunctiestoornis (Child-Pugh C). Vanwege de minimale absorptie is geen dosisaanpassing vereist, maar extra monitoring van bijwerkingen kan bij deze patiënten gerechtvaardigd zijn wanneer odevixibat wordt toegediend (zie rubriek 4.4).
Pediatrische patiënten
De veiligheid en werkzaamheid van odevixibat bij kinderen jonger dan 6 maanden zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Bylvay is bestemd voor oraal gebruik. Het middel moet ’s ochtends worden ingenomen, met of zonder voedsel (zie rubriek 5.2).
De grotere capsules (200 μg en 600 μg) zijn bedoeld om te worden geopend om de inhoud over voedsel of in een vloeistof te strooien, maar ze mogen ook in hun geheel worden doorgeslikt.
De kleinere capsules (400 μg en 1200 μg) zijn bedoeld om in hun geheel te worden doorgeslikt, maar ze mogen ook worden geopend om de inhoud over voedsel of in een vloeistof te strooien.
Als de capsule in haar geheel wordt doorgeslikt, moet de patiënt aangegeven worden de capsule ’s ochtends in te nemen met een glas water.
Toediening in zacht voedselVoor het openen van capsules en het strooien van de inhoud over zacht voedsel moet de patiënt de volgende instructies krijgen:
- Doe een beetje (30 ml/2 eetlepels) zacht voedsel (yoghurt, appelmoes, havermoutpap, geprakte banaan, wortelpuree, chocoladepudding of rijstepap) in een kom. Het voedsel moet op kamertemperatuur of kouder zijn.
- Houd de capsule aan beide uiteinden horizontaal vast, draai in tegengestelde richtingen en trek de capsule uit elkaar om de inhoud te legen in de kom met zacht voedsel. Tik voorzichtig tegen de capsule zodat er geen bolletjes achterblijven.
- Herhaal de vorige stap als er voor de dosis meer dan één capsule nodig is.
- Meng de bolletjes voorzichtig met een lepel door het zachte voedsel.
- Neem de hele dosis onmiddellijk na het mengen in. Bewaar het mengsel niet om later te gebruiken.
- Drink een glas water na de dosis.
- Gooi alle lege capsulehulzen weg.
Voor het openen van capsules en het strooien van de inhoud in een vloeistof moet de verzorger de volgende instructies krijgen:
- Houd de capsule aan beide uiteinden horizontaal vast, draai in tegengestelde richtingen en trek de capsule uit elkaar om de inhoud te legen in een kleine mengbeker. Tik voorzichtig tegen de capsule zodat er geen bolletjes achterblijven.
- Herhaal de vorige stap als er voor de dosis meer dan één capsule nodig is.
- Voeg 1 theelepel (5 ml) van een voor de leeftijd geschikte vloeistof (bijvoorbeeld moedermelk, zuigelingenvoeding of water) toe. Laat de bolletjes ongeveer 5 minuten in de vloeistof zitten, zodat ze helemaal nat kunnen worden (de bolletjes lossen niet op).
- Plaats na 5 minuten de punt van de doseerspuit voor orale toediening helemaal in de mengbeker. Trek de zuiger van de spuit langzaam op om het vloeistof/bolletjesmengsel in de spuit op te zuigen. Druk de zuiger voorzichtig weer omlaag om het vloeistof/bolletjesmengsel terug in de mengbeker te spuiten. Herhaal dit 2 tot 3 keer om ervoor te zorgen dat de bolletjes volledig door de vloeistof worden gemengd (de bolletjes lossen niet op).
- Trek de volledige inhoud op in de spuit door de zuiger tot aan het einde van de spuit te trekken.
- Plaats de punt van de spuit voor in de mond van het kind tussen de tong en de zijkant van de mond en druk vervolgens de zuiger omlaag om het vloeistof/bolletjesmengsel tussen de tong en de zijkant van de mond van het kind te spuiten. Spuit geen vloeistof/bolletjes achter in de keel van het kind, want dit kan kokhalzen of verslikken veroorzaken.
- Indien er wat bolletjes/vloeistofmengsel achterblijven in de mengbeker, herhaalt u de vorige stap totdat de volledige dosis is toegediend. Het mengsel mag niet worden bewaard om later te gebruiken.
- Laat het kind na de toediening moedermelk, zuigelingenvoeding of een andere voor de leeftijd geschikte vloeistof drinken.
- Gooi alle lege capsulehulzen weg.
4.3 Contra-indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De vaakst gemelde bijwerking was diarree (32,2%). Andere gemelde bijwerkingen waren lichte tot matige verhogingen van bloed bilirubine (24,8%), ALAT (14%) en ASAT (9,1%), braken (16,5%), maagpijn (11,6%), en verlaagde vitamine-D- (11%) en -E-spiegels (5%).
Tabel met de lijst van bijwerkingen
De tabel vermeldt bijwerkingen die in klinische onderzoeken zijn vastgesteld bij patiënten met PFIC in de leeftijd van 4 maanden tot 25 jaar (mediane leeftijd: 3 jaar en 7 maanden).
De bijwerkingen zijn naar systeem/orgaanklasse gerangschikt volgens de volgende indeling: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000) en niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 3: Frequentie van bijwerkingen bij patiënten met PFIC
Systeem/orgaanklasse volgens MedDRA | Frequentie | Bijwerking |
Maagdarmstelselaandoeningen | Zeer vaak | diarreea, |
Lever- en galaandoeningen | Zeer vaak | verhoogd bloed bilirubine, |
Vaak | hepatomegalie, | |
Voedings- en stofwisselingsstoornissen | Zeer vaak | vitamine-D-deficiëntie |
Vaak | vitamine-E-deficiëntie |
a Gebaseerd op de gecombineerde frequentie van diarree, hemorragische diarree en zachte ontlasting
b Met inbegrip van boven- en onderbuikpijn
ALAT = alanine aminotransferase
ASAT = aspartaat aminotransferase
Beschrijving van geselecteerde bijwerkingen
Gastro-intestinale bijwerkingen
De meest voorkomende gastro-intestinale bijwerking in klinische studies was diarree. De bijwerkingen diarree, hemorragische diarree en zachte ontlasting waren van korte duur: de meeste duurden ≤ 5 dagen. De meeste gevallen van diarree waren licht tot matig qua intensiteit en niet ernstig van aard. Dosisverlaging, onderbreking van de behandeling en stopzetten van de behandeling wegens diarree werd gerapporteerd bij enkele patiënten die intraveneuze of orale hydratatie nodig hadden wegens diarree (zie rubriek 4.4).
Andere vaak gemelde gastro-intestinale aandoeningen waren braken en buikpijn (inclusief boven- en onderbuikpijn), die allemaal niet ernstig, licht tot matig van aard waren en over het algemeen geen aanpassing van de dosis vereisten.
Lever- en galaandoeningen
De meest voorkomende leverbijwerkingen waren verhogingen van de bilirubine-, ASAT- en ALAT-waarden in het bloed. De meerderheid hiervan was licht tot matig qua ernst. Onderbreking van de behandeling vanwege verhogingen in leverfunctietests is vastgesteld bij patiënten met PFIC die behandeld werden met odevixibat. De meeste afwijkingen in ALAT-, ASAT- en bilirubinewaarden waren gerelateerd aan de onderliggende ziekte, evenals aan intermitterende gelijktijdige virus- of infectieziekten, die vaak voorkomen op de leeftijd van de patiënten. Daarom wordt monitoring van leverfunctietests aanbevolen (zie rubriek 4.4).
Voedings- en stofwisselingsstoornissen
Vanwege de verminderde afgifte van galzuren in de darm en malabsorptie, lopen patiënten met PFIC risico op een tekort aan in vet oplosbare vitaminen (zie rubriek 4.4). Verlagingen van vitaminespiegels werden waargenomen tijdens langdurige behandeling met odevixibat; de meerderheid van deze patiënten reageerde op passende vitaminesuppletie. Deze voorvallen waren mild qua intensiteit en leidden niet tot stopzetting van odevixibat.
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten. www.fagg.be. Afdeling Vigilantie: Website: www.eenbijwerkingmelden.be, e-mail: adr@fagg-afmps.be.
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Ipsen Pharma
70 rue Balard
75015 Paris
Frankrijk
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/21/1566/001
EU/1/21/1566/002
EU/1/21/1566/003
EU/1/21/1566/004
10. DATUM VAN HERZIENING VAN DE TEKST
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau http://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4624292 | BYLVAY 200MCG CAPS 30 | A05AX05 | - | - | Ja | - | - |
| 4624300 | BYLVAY 400MCG CAPS 30 | A05AX05 | - | - | Ja | - | - |
| 4624318 | BYLVAY 600MCG CAPS 30 | A05AX05 | - | - | Ja | - | - |
| 4624326 | BYLVAY 1200MCG CAPS 30 | A05AX05 | - | - | Ja | - | - |