SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Varilrix Poeder en oplosmiddel voor oplossing voor injectie in een voorgevulde spuit.
Varicellavaccin (levend)
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Na reconstitutie bevat één dosis (0,5 ml):
Varicellavirus1 OKA-stam (levend, verzwakt) niet minder dan 103,3 PFU2
1 geproduceerd in diploïde menselijke cellen (MRC-5)
2 plaquevormende eenheden
Dit vaccin bevat sporen neomycine (zie rubriek 4.3).
Hulpstoffen met bekend effect:
Het vaccin bevat 6 mg sorbitol per dosis.
Het vaccin bevat 331 microgram fenylalanine per dosis (zie rubriek 4.4).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder en oplosmiddel voor oplossing voor injectie in een voorgevulde spuit.
Voor reconstitutie is het poeder een licht crème tot geelachtige of roze gekleurde lyofilisaat, en het oplosmiddel is een heldere, kleurloze vloeistof.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Varilrix is geïndiceerd voor actieve immunisatie tegen varicella:
- Bij gezonde personen van 9 tot 11 maanden oud (zie rubriek 5.1), onder speciale omstandigheden:
- Bij gezonde personen vanaf 12 maanden oud (zie rubriek 5.1);
- Voor profylaxe na de blootstelling indien toegediend aan gezonde, gevoelige personen blootgesteld aan varicella binnen 72 uur na contact (zie rubriek 4.4 en 5.1):
- Bij personen met een hoog risico op een ernstige vorm van varicella (zie rubriek 4.3, 4.4 en 5.1).
Het gebruik van Varilrix dient te worden gebaseerd op officiële aanbevelingen.
4.2 Dosering en wijze van toediening
Dosering
De immunisatieschema’s voor Varilrix dienen te worden gebaseerd op officiële aanbevelingen.
Gezonde personen
Zuigelingen van 9 tot en met 11 maanden oud
Zuigelingen van 9 maanden tot en met 11 maanden krijgen twee doses Varilrix om een optimale bescherming tegen varicella te verzekeren (zie rubriek 5.1). De tweede dosis dient te worden toegediend na een interval van minimaal 3 maanden.
Kinderen vanaf 12 maanden oud, adolescenten en volwassenen
Kinderen vanaf 12 maanden oud, adolescenten en volwassenen krijgen twee doses Varilrix om een optimale bescherming tegen varicella te verzekeren(zie rubriek 5.1). De tweede dosis dient over het algemeen ten minste 6 weken na de eerste dosis toegediend te worden. Het interval tussen de doses mag in geen geval minder dan 4 weken zijn.
Personen met een hoog risico op ernstige varicella
Personen met een hoog risico op ernstige varicella kunnen baat hebben bij revaccinatie na het 2-dosisschema (zie rubriek 5.1). Periodieke meting van varicella-antistoffen na immunisatie kan aangewezen zijn om te identificeren wie mogelijk baat heeft bij re-immunisatie. Het interval tussen de doses mag in geen geval minder dan 4 weken zijn.
Overige pediatrische patiënten
De veiligheid en werkzaamheid van Varilrix bij zuigelingen die minder dan 9 maanden oud zijn, is nog niet vastgesteld. Er zijn geen gegevens beschikbaar.
Uitwisselbaarheid
- Een enkele dosis Varilrix mag worden toegediend aan personen die reeds een enkele dosis van een ander varicellabevattend vaccin hebben gekregen.
- Een enkele dosis Varilrix mag worden toegediend gevolgd door een enkele dosis van een ander varicellabevattend vaccin.
Wijze van toediening
Varilrix dient subcutaan (s.c.) of intramusculair (i.m.) te worden toegediend in de regio deltoidea of in het anterolaterale gebied van de dij.
Varilrix dient subcutaan te worden toegediend aan personen met bloedingsstoornissen (bijv. trombocytopenie of een coagulatieaandoening).
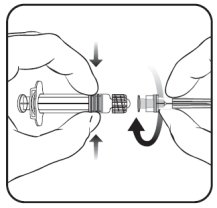
Voor instructies over reconstitutie van het medicinaal product voorafgaand aan toediening, zie rubriek 6.6.
4.3 Contra-indicaties
Varilrix is gecontra-indiceerd bij personen met een ernstige humorale of cellulaire (primaire of verworven) immunodeficiëntie zoals (zie ook rubriek 4.4):
- personen met immunodeficiëntie met een totale lymfocytentelling minder dan 1.200 per mm3;
- personen die overig bewijs vertonen van gebrek aan cellulaire immuuncompetentie (bijv. patiënten met leukemieën, lymfomen, bloeddyscrasieën, klinische manifestatie van HIV-infectie);
- personen die momenteel immunosuppressieve therapie krijgen of deze kort geleden hebben gekregen (inclusief hoge doses corticosteroïden). Varilrix is niet gecontra-indiceerd bij personen die gebruikmaken van lokaal toegediende of laaggedoseerde parenteraal toegediende corticosteroïden (bijv. als profylaxe van astma of substitutietherapie);
- ernstige gecombineerde immunodeficiëntie
- agammaglobulinemie
- AIDS of symptomatische HIV-infectie of een leeftijdsspecifiek CD4+ T-lymfocytenpercentage bij kinderen jonger dan 12 maanden: CD4+ < 25%; bij kinderen tussen 12-35 maanden: CD4+ < 20%; bij kinderen tussen 36-59 maanden: CD4+ < 15%.
Overgevoeligheid voor de werkzame stof(fen) of voor een van de in rubriek 6.1 vermelde hulpstof(fen) of neomycine. Een voorgeschiedenis van contactdermatitis door neomycine is echter geen contra-indicatie.
Varilrix is gecontra-indiceerd bij patiënten die tekenen van overgevoeligheid hebben vertoond na eerdere toediening van het varicellavaccin.
Zwangerschap. Zwangerschap moet worden vermeden gedurende 1 maand na de vaccinatie (zie rubriek 4.6).
4.8 Bijwerkingen
Klinische studiegegevens
Gezonde personen
Meer dan 7.900 personen hebben deelgenomen aan klinische studies voor het beoordelen van het reactogeniciteitsprofiel van het vaccin bij subcutane toediening, hetzij alleen hetzij gelijktijdig met andere vaccins.
Het veiligheidsprofiel dat hieronder wordt weergegeven is gebaseerd op een totaal van 5.369 dosissen Varilrix die als monotherapie werden toegediend aan zuigelingen, kinderen, adolescenten en volwassenen.
Gemelde bijwerkingen zijn opgesomd overeenkomstig de volgende frequentie:
Zeer vaak (>1/10)
Vaak (>1/100, <1/10)
Soms (>1/1.000, <1/100)
Zelden (>1/10.000, <1/1.000)
Zeer zelden (<1/10.000)
In elke frequentiegroep worden de bijwerkingen weergegeven in volgorde van afnemende ernst.
Systeem/orgaanklasse | Frequentie | Bijwerkingen |
Infecties en parasitaire aandoeningen | Soms | infectie van de bovenste luchtwegen, faryngitis |
Bloed- en lymfestelselaandoeningen | Soms | lymfadenopathie |
Psychische stoornissen | Soms | prikkelbaarheid |
Zenuwstelselaandoeningen | Soms | hoofdpijn, slaperigheid |
Oogaandoeningen | Zelden | conjunctivitis |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Soms | hoest, rhinitis |
Maagdarmstelselaandoeningen | Soms | braken, nausea |
Zelden | diarree, abdominale pijn | |
Huid- en onderhuidaandoeningen | Vaak | huiduitslag |
Soms | virale huiduitslag, pruritus | |
Zelden | urticaria | |
Skeletspierstelsel- en bindweefselaandoeningen | Soms | artralgie, myalgie |
Algemene aandoeningen en toedieningsplaatsstoornissen | Zeer vaak | pijn, erytheem |
Vaak | koorts (orale/okseltemperatuur 37,5 °C or | |
Soms | koorts (orale/okseltemperatuur > 39,0°C of rectumtemperatuur > 39,5 °C), | |
Overeenkomstig de MedDRA (Medical Dictionary for Regulatory Activities)-terminologie | ||
Vergeleken met de eerste dosis werd na de tweede dosis een hogere incidentie van pijn, erytheem en zwelling op de injectieplaats waargenomen.
Er werden geen verschillen gezien in het reactogeniciteitsprofiel tussen initieel seropositieve en initieel seronegatieve personen.
In een klinische studie kregen 328 kinderen van 11 tot 21 maanden oud het gecombineerde vaccin van GlaxoSmithKline (GSK) tegen mazelen, bof, rodehond en varicella (met dezelfde varicellastam als Varilrix), via subcutane of intramusculaire weg. Er werd een vergelijkbaar veiligheidsprofiel waargenomen voor beide toedieningswegen.
Personen met een hoog risico op ernstige varicella
Er zijn beperkte gegevens uit klinische studies beschikbaar betreffende personen met een hoog risico op ernstige varicella. Vaccingeassocieerde reacties (hoofdzakelijk papulovesiculaire huiduitslag en koorts) waren echter meestal mild. Net zoals bij gezonde personen zijn erytheem, zwelling en pijn op de injectieplaats mild en van voorbijgaande aard.
Postmarketingsurveillance
De volgende aanvullende bijwerkingen werden geïdentificeerd in zeldzame gevallen tijdens de postmarketingsurveillance. Een juiste schatting van de frequentie kan niet worden gegeven omdat deze reacties vrijwillig zijn gemeld uit een populatie van onbekende grootte.
Systeem/orgaanklasse | Bijwerkingen |
Infecties en parasitaire aandoeningen | herpes zoster |
Bloed- en lymfestelselaandoeningen | trombocytopenie |
Immuunsysteemaandoeningen | anafylactische reacties, overgevoeligheid |
Zenuwstelselaandoeningen | Encefalitis+, cerebrovasculair accident, convulsies, cerebellitis, cerebellitisachtige symptomen (inclusief voorbijgaande loopstoornis en voorbijgaande ataxie) |
Bloedvataandoeningen | vasculitis (inclusief Henoch-Schönlein purpura en syndroom van Kawasaki) |
Huid- en onderhuidaandoeningen | erythema multiforme |
Overeenkomstig de MedDRA (Medical Dictionary for Regulatory Activities)-terminologie
+ Zie de beschrijving van geselecteerde bijwerkingen.
Beschrijving van geselecteerde bijwerkingen
Er is encefalitis waargenomen na vaccinatie met levende verzwakte varicellavaccins. In sommige gevallen is een fatale afloop gemeld, met name bij immuungecompromitteerde personen (zie rubriek 4.4).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
GlaxoSmithKline Biologicals SA
Rue de l'Institut, 89
1330 Rixensart
België
8. NUMMER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
BE129026 : Injectieflacon + voorgevulde spuit
10. DATUM VAN HERZIENING/GOEDKEURING VAN DE TEKST
Goedkeuringsdatum : 10/2025
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 0064527 | VARILRIX 1 DOS INJ + SOLV SC 0,5ML + 2 NAALDEN | J07BK01 | € 50,28 | - | Ja | € 12,48 | € 7,41 |