SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET DIERGENEESMIDDEL
Ficoxil 227 mg kauwtabletten voor honden
4. KLINISCHE GEGEVENS
4.2 Indicatie(s) voor gebruik met specificatie van de doeldiersoort(en)
Voor de verlichting van pijn en ontsteking geassocieerd met osteoartritis bij honden. Voor de verlichting van postoperatieve pijn en ontsteking geassocieerd met weke delen, orthopedische chirurgie en tandheelkunde bij honden.
4.3 Contra-indicaties
Niet gebruiken bij drachtige of lacterende teven.
Niet gebruiken bij dieren jonger dan 10 weken of bij dieren met minder dan 3 kg lichaamsgewicht. Niet gebruiken bij dieren die lijden aan gastro-intestinale bloedingen, bloeddyscrasie of hemorragische
aandoeningen.
Niet gelijktijdig gebruiken met corticosteroïden of andere niet-steroïde anti-inflammatoire geneesmiddelen (NSAID's).
Niet gebruiken bij bekende overgevoeligheid voor het werkzame bestanddeel of (één van) de
hulpstoffen.
4.8 Interactie met andere geneesmiddelen en andere vormen van interactie
Voorbehandeling met andere anti-inflammatoire stoffen kan leiden tot bijkomende of versterkte bijwerkingen en dienovereenkomstig moet een behandelingsvrije periode met dergelijke geneesmiddelen in acht worden genomen van ten minste 24 uur voordat de behandeling met het product wordt gestart. Voor de behandelingsvrije periode dient echter rekening te worden gehouden met de farmacokinetische eigenschappen van de eerder gebruikte producten.
Het product mag niet samen met andere NSAID's of glucocorticosteroïden worden toegediend. Ulceratie van het maagdarmkanaal kan worden verergerd door corticosteroïden bij dieren die niet- steroïde anti-inflammatoire geneesmiddelen krijgen.
Gelijktijdige behandeling met moleculen die een effect hebben op de nierdoorstroming, zoals
diuretica of angiotensineconverterende enzymremmers (ACE-remmers) dienen onderhevig te zijn aan klinische controle. Gelijktijdige toediening van potentieel nefrotoxische geneesmiddelen moet
worden vermeden, aangezien er een potentieel risico bestaat op verhoogde niertoxiciteit. Aangezien anesthetica de nierperfusie kunnen beïnvloeden, moet het gebruik van parenterale vloeistoftherapie tijdens de operatie worden overwogen om mogelijke niercomplicaties te verminderen bij perioperatief gebruik van NSAID's.
Gelijktijdig gebruik van andere werkzame stoffen met een hoge eiwitbinding kan op het gebied van binding concurreren met firocoxib en dus tot toxische effecten leiden.
4.9 Dosering en toedieningsweg
Oraal gebruik.
Osteoartritis:
Dien eenmaal daags 5 mg firocoxib per kg lichaamsgewicht toe, zoals weergegeven in de onderstaande tabel.
De duur van de behandeling is afhankelijk van de waargenomen respons. Aangezien veldonderzoeken beperkt waren tot 90 dagen, dient een langere behandelingsduur zorgvuldig te worden overwogen en moet het dier regelmatig door de dierenarts worden gecontroleerd.
Verlichting van postoperatieve pijn:
Dien zo nodig eenmaal daags 5 mg firocoxib per kg lichaamsgewicht toe zoals weergegeven in de onderstaande tabel gedurende 3 dagen, en start hiermee 2 uur voorafgaand aan de operatie.
Na orthopedische chirurgie en afhankelijk van de waargenomen respons, kan de behandeling volgens hetzelfde dagelijkse doseringsschema na de eerste 3 dagen worden voortgezet, na beoordeling van de behandelende dierenarts.
De volgende tabel is bedoeld als richtlijn voor het toedienen van het diergeneesmiddel in de aanbevolen dosering.
| Aantal tabletten naar grootte |
| |
57 mg | 227 mg | ||
3,0 - 5,5 | ½ |
| 5,2 - 9,5 |
5,6- 7,5 | ¾ |
| 5,7 - 7,6 |
7,6-10 | 1 of ¼ | 5,7 - 7,5 | |
10,1- 13 | 1 ¼ |
| 5,5 - 7,1 |
13,1 - 16 | 1 ½ |
| 5,3 - 6,5 |
16,1-18,5 | 1 ¾ |
| 5,4 - 6,2 |
18,6-22,5 |
| ½ | 5,0 - 6,1 |
22,6-34 |
| ¾ | 5,0 - 7,5 |
34,1-45 |
| 1 | 5,0 - 6,7 |
45,1-56 |
| 1 ¼ | 5,1 - 6,3 |
56,1-68 |
| 1 ½ | 5,0 - 6,1 |
68,1-79 |
| 1 ¾ | 5,0 - 5,8 |
79,1-90 |
| 2 | 5,0 - 5,7 |
![]()
![]()
![]()
![]() = ¼ Tablet = ½ Tablet = ¾ Tablet = 1 Tablet
= ¼ Tablet = ½ Tablet = ¾ Tablet = 1 Tablet
De tabletten kunnen in 2 of 4 gelijke delen worden verdeeld om een nauwkeurige dosering te garanderen.
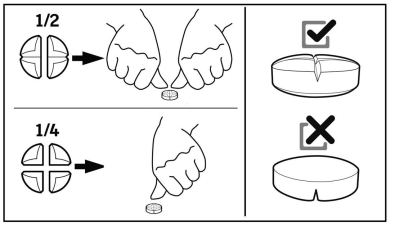
Tabletten kunnen met of zonder voer worden toegediend.
4.11 Wachttijd(en)
Niet van toepassing.