SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET DIERGENEESMIDDEL
CYLANIC 500 mg + 125 mg tabletten voor honden
4. KLINISCHE GEGEVENS
4.2 Indicaties voor gebruik met specificatie van de doeldiersoort(en)
Behandeling van infecties veroorzaakt door bacteriën die gevoelig zijn voor amoxicilline en clavulaanzuur, waaronder: huidaandoeningen (met inbegrip van diepe en oppervlakkige pyodermieën); weke deleninfecties (abcessen en anale sacculitis); gebitsinfecties (bv. gingivitis); urineweginfecties; aandoeningen van de luchtwegen (van de bovenste en de onderste luchtwegen); enteritis.
4.3 Contra-indicaties
Niet gebruiken bij konijnen, cavia’s, hamsters, gerbils of chinchilla’s.
Niet gebruiken bij overgevoeligheid voor de werkzame bestanddelen, voor andere antimicrobiële middelen van de β-lactamgroep, of voor (één van) de hulpstoffen.
Niet gebruiken bij dieren met ernstige verminderde nierfunctie die gepaard gaan met anurie en oligurie.
Niet gebruiken bij herkauwers en paarden.
4.8 Interactie met andere geneesmiddelen en andere vormen van interactie
Chlooramfenicol, macroliden, sulfonamiden en tetracyclinen kunnen de antibacteriële werking van penicillinen remmen vanwege de snelle bacteriostatische werking. Houd rekening met mogelijke kruisallergieën met andere penicillinen. Penicillinen kunnen het effect van aminoglycosiden versterken.
4.9 Dosering en toedieningsweg
Voor orale toediening.
De aanbevolen dosering bedraagt 12,5 mg/kg lichaamsgewicht (10 mg amoxicilline + 2,5 mg clavulaanzuur per kg lichaamsgewicht), 2 maal daags.
De volgende tabel is bedoeld als richtlijn voor het toedienen van de tabletten in de aanbevolen dosering.
Teneinde een juiste dosering te garanderen, dient het lichaamsgewicht zo nauwkeurig mogelijk te worden bepaald. Dit om onderdosering te vermijden.
| Aantal tabletten 2x daags | ||
Lichaamsgewicht | Amoxicilline/clavulaanzuur | Amoxicilline/clavulaanzuur | Amoxicilline/clavulaanzuur |
1-1,25 | ¼ | - | - |
>1,25-2,5 | ½ | - | - |
>2,5-3,75 | ¾ | - | - |
>3,75-5 | 1 | - | - |
>5-6,25 | 1 ¼ | ¼ | - |
>6,25-12,5 | - | ½ | ¼ |
>12,5-18,75 | - | ¾ | - |
>18,75-25 | - | 1 | ½ |
>25-31,25 | - | 1 ¼ | - |
>31,25-37,5 | - | 1 ½ | - |
>37,5-50 | - | - | 1 |
>50-62,5 | - | - | 1 ¼ |
>62,5-75 | - | - | 1 ½ |
![]() = ¼ tablet
= ¼ tablet ![]() = ½ tablet
= ½ tablet ![]() = ¾ tablet
= ¾ tablet ![]() = 1 tablet
= 1 tablet
De tabletten kunnen worden verdeeld in 2 of 4 gelijke delen om een nauwkeurige dosering mogelijk te maken.
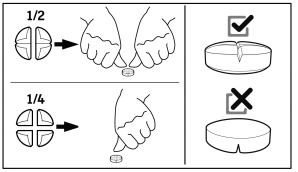
De minimale behandelingsduur bedraagt 5 dagen, waarbij het merendeel van de veelvoorkomende gevallen reageert op een behandeling van tussen de 5 en 7 dagen.
Bij chronische of hardnekkige gevallen kan een langere kuur nodig zijn, bijvoorbeeld bij chronische huidziekten 10 - 20 dagen, chronische blaasontsteking 10 - 28 dagen, aandoening van de luchtwegen 8 - 10 dagen.
In dergelijke gevallen is de totale behandelingsduur ter beoordeling van de dierenarts, maar deze moet lang genoeg zijn om een volledige genezing van de bacteriële aandoening te garanderen.
4.11 Wachttijd
Niet van toepassing.