SAMENVATTING VAN DE PRODUCTKENMERKEN
![]() Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden. Zie rubriek 4.8 voor het rapporteren van bijwerkingen.
1. NAAM VAN HET GENEESMIDDEL
Evrenzo 20 mg filmomhulde tabletten
Evrenzo 50 mg filmomhulde tabletten
Evrenzo 70 mg filmomhulde tabletten
Evrenzo 100 mg filmomhulde tabletten
Evrenzo 150 mg filmomhulde tabletten
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Evrenzo 20 mg filmomhulde tabletten
Elke tablet bevat 20 mg roxadustat.
Evrenzo 50 mg filmomhulde tabletten
Elke tablet bevat 50 mg roxadustat.
Evrenzo 70 mg filmomhulde tabletten
Elke tablet bevat 70 mg roxadustat.
Evrenzo 100 mg filmomhulde tabletten
Elke tablet bevat 100 mg roxadustat.
Evrenzo 150 mg filmomhulde tabletten
Elke tablet bevat 150 mg roxadustat.
Hulpstof(fen) met bekend effect
Elke filmomhulde tablet van 20 mg bevat 40,5 mg lactose, 0,9 mg allurarood AC aluminiumlak en 0,21 mg sojalecithine.
Elke filmomhulde tablet van 50 mg bevat 101,2 mg lactose, 1,7 mg allurarood AC aluminiumlak en 0,39 mg sojalecithine.
Elke filmomhulde tablet van 70 mg bevat 141,6 mg lactose, 2,1 mg allurarood AC aluminiumlak en 0,47 mg sojalecithine.
Elke filmomhulde tablet van 100 mg bevat 202,4 mg lactose, 2,8 mg allurarood AC aluminiumlak en 0,63 mg sojalecithine.
Elke filmomhulde tablet van 150 mg bevat 303,5 mg lactose, 3,7 mg allurarood AC aluminiumlak en 0,84 mg sojalecithine.
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Filmomhulde tabletten (tabletten).
Evrenzo 20 mg tabletten
Rode, ovale tabletten (ongeveer 8 mm × 4 mm) met aan één kant ‘20’ weergegeven.
Evrenzo 50 mg tabletten
Rode, ovale tabletten (ongeveer 11 mm × 6 mm) met aan één kant ‘50’ weergegeven.
Evrenzo 70 mg tabletten
Rode, ronde tabletten (ongeveer 9 mm) met aan één kant ‘70’ weergegeven.
Evrenzo 100 mg tabletten
Rode, ovale tabletten (ongeveer 14 mm × 7 mm) met aan één kant ‘100’ weergegeven.
Evrenzo 150 mg tabletten
Rode, amandelvormige tabletten (ongeveer 14 mm × 9 mm) met aan één kant ‘150’ weergegeven.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Evrenzo is geïndiceerd voor de behandeling van volwassen patiënten met symptomatische anemie gerelateerd aan chronische nierschade, CNS (chronic kidney disease, CKD).
4.2 Dosering en wijze van toediening
De behandeling met roxadustat dient te worden ingesteld door een arts die ervaring heeft met de behandeling van anemie. Alle andere oorzaken van anemie dienen te worden geëvalueerd voordat wordt begonnen met de therapie met Evrenzo en wanneer wordt besloten om de dosis te verhogen.
De symptomen en gevolgen van anemie kunnen variëren op basis van leeftijd, geslacht en algemene ziektelast; er is een evaluatie van een arts nodig van het klinische verloop en de toestand van de individuele patiënt. Naast de aanwezigheid van symptomen van anemie kunnen criteria als de snelheid van afname van hemoglobine (Hb), een eerdere respons op ijzertherapie, en het risico dat een transfusie van rode bloedcellen (RBC) nodig is, relevant zijn in de evaluatie van het klinische verloop en de toestand van de individuele patiënt.
Dosering
De aangewezen dosis roxadustat moet driemaal per week oraal worden ingenomen, en niet op opeenvolgende dagen.
De dosis moet per persoon worden vastgesteld om een Hb-streefwaarde van 10 tot 12 g/dl te bereiken en te handhaven, zoals hieronder beschreven.
Als er na 24 weken therapie geen klinisch betekenisvolle stijging in de Hb-waarde wordt bereikt mag de behandeling met roxadustat niet worden voortgezet. Alternatieve oorzaken voor een inadequate respons moeten worden gezocht en behandeld alvorens opnieuw te starten met Evrenzo.
Aanvangsdosering bij het instellen van de behandeling
Voordat met de behandeling wordt begonnen, moet voor voldoende ijzervoorraad worden gezorgd.
Patiënten die momenteel niet worden behandeld met een erytropoëse-stimulerend middel (erythropoiesis-stimulating agent, ESA)
Voor patiënten die met de behandeling van anemie beginnen en nog niet met een ESA zijn behandeld, is de aanbevolen aanvangsdosering roxadustat 70 mg driemaal per week bij patiënten die minder dan 100 kg wegen, en 100 mg driemaal per week bij patiënten die 100 kg of meer wegen.
Patiënten die overstappen van een ESA
Patiënten die momenteel met een ESA worden behandeld, kunnen worden overgezet op roxadustat. Conversie van dialysepatiënten die verder stabiel zijn op behandeling met een ESA dient echter alleen te worden overwogen wanneer er een geldige klinische reden is (zie rubriek 4.4 en 5.1).
Conversie van niet-dialysepatiënten die verder stabiel zijn op behandeling met een ESA is niet onderzocht. Een beslissing om deze patiënten met roxadustat te behandelen, moet worden gebaseerd op een afweging van de baten en risico’s voor de individuele patiënt.
De aanbevolen aanvangsdosering van roxadustat is gebaseerd op de gemiddelde voorgeschreven ESA-dosering in de 4 weken voor de conversie (zie tabel 1). De eerste dosis roxadustat dient in de plaats te komen van de eerstvolgende geplande dosis van de huidige ESA.
Tabel 1. Aanvangsdoseringen van driemaal per week in te nemen roxadustat bij patiënten die overstappen van een ESA
Intraveneuze of subcutane dosering darbepoëtine alfa (microgram/week) | Intraveneuze of subcutane dosering epoëtine (IE/week) | Intraveneuze of subcutane dosering methoxypolyethyleenglycol-epoëtine bèta (microgram/maand) | Dosering roxadustat (milligram driemaal per week) |
Minder dan 25 | Minder dan 5 000 | Minder dan 80 | 70 |
25 tot 40 | 5 000 tot en met 8 000 | 80 tot en met 120 | 100 |
40 tot en met 80 | Meer dan 8 000 tot en met 16 000 | Meer dan 120 tot en met 200 | 150 |
Meer dan 80 | Meer dan 16 000 | Meer dan 200 | 200 |
ESA: erytropoëse-stimulerend middel
Doseringsaanpassing en Hb-controle
De geïndividualiseerde onderhoudsdosering varieert van 20 mg tot 400 mg driemaal per week (zie rubriek Maximale aanbevolen dosering). Het Hb-gehalte dient elke twee weken te worden gecontroleerd totdat het gewenste Hb-gehalte van 10 tot 12 g/dl is bereikt en gestabiliseerd, en daarna elke 4 weken, of zoals klinisch aangewezen.
De dosering roxadustat kan 4 weken na het begin van de behandeling ten opzichte van de aanvangsdosering stapsgewijs omhoog of omlaag worden aangepast, en elke 4 weken daarna, tenzij het Hb-gehalte met meer dan 2 g/dl toeneemt. In dat geval dient de dosering onmiddellijk met één stap te worden verlaagd. Houd bij het aanpassen van de dosering roxadustat rekening met het huidige Hb-gehalte en de recente snelheid van de wijziging van het Hb-gehalte over de afgelopen 4 weken, en volg de stappen voor doseringsaanpassing volgens het algoritme voor doseringsaanpassing dat is beschreven in tabel 2.
De stapsgewijze doseringsaanpassingen omhoog of omlaag dienen de reeks van de beschikbare doses te volgen:
20 mg‑40 mg‑50 mg‑70 mg‑100 mg‑150 mg‑200 mg‑250 mg‑300 mg‑400 mg (alleen voor patiënten met CNS die dialyse ondergaan).
Tabel 2. Regels voor doseringsaanpassing
Verandering in Hb over de voorgaande 4 weken1 | Huidig Hb-gehalte (g/dl): | |||
Lager dan 10,5 | 10,5 tot 11,9 | 12,0 tot 12,9 | 13,0 of hoger | |
Verandering in waarde van | Geen verandering | Verlaag dosering met één stap | Verlaag dosering met één stap | Onderbreek toediening, |
Verandering in waarde tussen | Verhoog dosering met één stap | Geen verandering | Verlaag dosering met één stap | |
Verandering in waarde van | Verhoog dosering met één stap | Verhoog dosering met één stap | Geen verandering | |
De dosering roxadustat mag niet vaker dan eens per 4 weken worden aangepast, tenzij het Hb-gehalte op enig moment binnen een periode van 4 weken met meer dan 2 g/dl toeneemt. In dat geval dient de dosering onmiddellijk met één stap te worden verlaagd. | ||||
Indien een extra dosisverlaging vereist is voor een patiënt die al de laagste dosering krijgt (20 mg driemaal per week), verlaag de dosis van 20 mg dan niet door de tablet te breken, maar verlaag de doseringsfrequentie naar tweemaal per week. Indien een verdere verlaging van de dosis nodig is, kan de doseringsfrequentie verder worden verlaagd naar eenmaal per week.
Onderhoudsdosering
Na stabilisering op streefniveau van Hb-gehalte tussen 10 en 12 g/dl moet het Hb-gehalte nog steeds regelmatig worden gecontroleerd en moeten de regels voor doseringsaanpassing nog steeds worden gevolgd (zie tabel 2).
Patiënten die met dialyse beginnen tijdens hun behandeling met roxadustat
Er is geen specifieke doseringsaanpassing vereist voor patiënten met CNS die met dialyse starten terwijl zij met roxadustat worden behandeld. De normale regels voor doseringsaanpassing (zie tabel 2) moeten worden gevolgd.
Gelijktijdige roxadustatbehandeling met inductoren of remmers
Wanneer gelijktijdige behandeling met sterke remmers (bijv. gemfibrozil) of inductoren (bijv. rifampicine) van CYP2C8, of remmers (bijv. probenecide) van UGT1A9 wordt ingesteld of stopgezet: het Hb-gehalte moet routinematig worden gecontroleerd en de regels voor doseringsaanpassing moeten worden gevolgd (zie tabel 2; zie ook rubriek 4.5 en 5.2).
Maximale aanbevolen dosering
Patiënten die geen dialyse ondergaan, mogen niet meer krijgen dan een roxadustatdosering van 3 mg/kg lichaamsgewicht of 300 mg driemaal per week, afhankelijk van welke lager is.
Patiënten die wel dialyse ondergaan, mogen niet meer krijgen dan een roxadustatdosering van 3 mg/kg lichaamsgewicht of 400 mg driemaal per week, welke lager is.
Gemiste dosis
Indien een dosis is gemist en het meer dan 1 dag duurt tot de volgende geplande dosis, moet de gemiste dosis zo snel mogelijk worden ingenomen. Indien het één dag of korter duurt tot de volgende geplande dosis, moet de gemiste dosis worden overgeslagen en moet de volgende dosis worden ingenomen op de volgende geplande dag. In beide gevallen dient het gewone doseringsschema daarna te worden hervat.
Speciale patiëntengroepen
Ouderen
Er is geen aanpassing van de aanvangsdosering nodig bij oudere patiënten (zie rubriek 5.2).
Patiënten met een leverfunctiestoornis
Er is geen aanpassing van het aanvangsdoseringsniveau nodig bij patiënten met een lichte leverfunctiestoornis (Child‑Pugh-klasse A) (zie rubriek 4.4 en 5.2).
Voorzichtigheid is geboden bij het voorschrijven van roxadustat aan patiënten met een matige leverfunctiestoornis. De aanvangsdosering moet met de helft worden verlaagd of verlaagd tot het doseringsniveau dat het dichtst ligt bij de helft van de aanvangsdosering wanneer een behandeling wordt ingesteld bij patiënten met een matige leverfunctie (Child‑Pugh-klasse B). Evrenzo wordt niet aanbevolen voor gebruik bij patiënten met een ernstige leverfunctiestoornis (Child‑Pugh-klasse C) aangezien de veiligheid en werkzaamheid niet zijn geëvalueerd bij deze populatie (zie rubriek 4.4 en 5.2).
Pediatrische patiënten
De veiligheid en werkzaamheid van roxadustat bij kinderen in de leeftijd jonger dan 18 jaar zijn niet vastgesteld. Er zijn geen gegevens beschikbaar.
Wijze van toediening
Evrenzo filmomhulde tabletten dienen oraal met of zonder voedsel te worden ingenomen. De tabletten dienen in hun geheel te worden ingeslikt en niet gekauwd, gebroken of fijngemaakt vanwege het gebrek aan klinische gegevens onder deze omstandigheden, en om de lichtgevoelige tabletkern tegen fotodegradatie te beschermen.
De tabletten dienen te worden ingenomen ten minste 1 uur na toediening van fosfaatbinders (behalve lanthanum) of andere geneesmiddelen die multivalente kationen, zoals calcium, ijzer, magnesium of aluminium bevatten (zie rubriek 4.5 en 5.2).
4.3 Contra-indicaties
Evrenzo is gecontra-indiceerd in de volgende omstandigheden:
- Overgevoeligheid voor de werkzame stof, pinda, soja of voor een van de in rubriek 6.1 vermelde hulpstoffen.
- Het derde trimester van de zwangerschap (zie rubriek 4.4 en 4.6).
- Borstvoeding (zie rubriek 4.6).
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
De veiligheid van Evrenzo werd geëvalueerd bij 3 542 niet-dialyseafhankelijke (non-dialysis dependent, NDD) en 3 353 dialyseafhankelijke (dialysis dependent, DD) patiënten met anemie en CNS die ten minste één dosis roxadustat hebben ontvangen.
De vaakst voorkomende (≥ 10%) bijwerkingen die verband houden met roxadustat, zijn hypertensie (13,9%), trombose van de vaattoegang (12,8%), diarree (11,8%), perifeer oedeem (11,7%), hyperkaliëmie (10,9%) en nausea (10,2%).
De vaakst voorkomende (≥ 1%) ernstige bijwerkingen die verband houden met roxadustat, waren sepsis (3,4%), hyperkaliëmie (2,5%), hypertensie (1,4%) en diep veneuze trombose (1,2%).
Lijst van bijwerkingen in tabelvorm
De bijwerkingen die werden gezien tijdens klinische onderzoeken en/of gedurende postmarketingervaring, worden in deze rubriek per frequentiecategorie aangegeven.
De frequentiecategorieën zijn als volgt gedefinieerd: zeer vaak (≥ 1/10); vaak (≥ 1/100, < 1/10); soms (≥ 1/1 000, < 1/100); zelden (≥ 1/10 000, < 1/1 000); zeer zelden (< 1/10 000); niet bekend (kan met de beschikbare gegevens niet worden bepaald).
Tabel 3. Bijwerkingen
Systeem/orgaanklassen volgens MedDRA | Frequentiecategorie | Bijwerking |
Infecties en parasitaire aandoeningen | Vaak | Sepsis |
Bloed- en lymfestelselaandoeningen | Vaak | Trombocytopenie |
Endocriene aandoeningen | Niet bekend | Secundaire hypothyroïdie |
Voedings- en stofwisselingsstoornissen | Zeer vaak | Hyperkaliëmie |
Psychische stoornissen | Vaak | Insomnia |
Zenuwstelselaandoeningen | Vaak | Insulten, hoofdpijn |
Soms | Herseninfarct | |
Bloedvataandoeningen | Zeer vaak | Hypertensie, trombose van de vaattoegang (VAT)1 |
Vaak | Diep veneuze trombose (DVT) | |
Ademhalingsstelsel-, borstkas- en mediastinumaandoeningen | Soms | Longembolie |
Maagdarmstelselaandoeningen | Zeer vaak | Nausea, diarree |
Vaak | Constipatie, braken | |
Lever- en galaandoeningen | Soms | Hyperbilirubinemie |
Huid- en onderhuidaandoeningen | Niet bekend | Gegeneraliseerde exfoliatieve dermatitis (DEG) |
Algemene aandoeningen en toedieningsplaatsstoornissen | Zeer vaak | Perifeer oedeem |
Onderzoeken | Niet bekend | Bloed thyroïd-stimulerend hormoon (TSH) verlaagd, |
1Deze bijwerking wordt in verband gebracht met patiënten met CNS die dialyse ondergingen, terwijl zij roxadustat kregen. | ||
Beschrijving van geselecteerde bijwerkingen
Trombotische vasculaire voorvallen
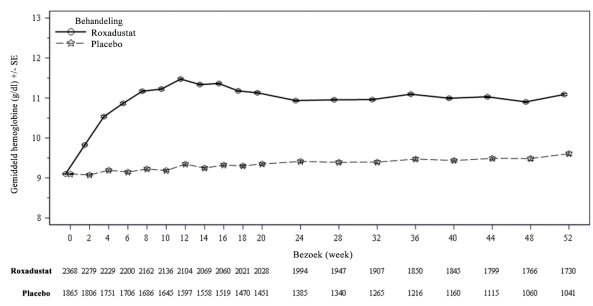
Bij patiënten die CNS hebben en geen dialyse ondergaan, kwamen voorvallen van DVT soms voor: ze kwamen voor bij 1,0% (0,6 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, en bij 0,2% (0,2 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de placebogroep. Bij patiënten die CNS hebben en wel dialyse ondergaan, kwamen voorvallen van DVT voor bij 1,3% (0,8 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, en bij 0,3% (0,1 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de ESA-groep (zie rubriek 4.4).
Bij patiënten die CNS hebben en geen dialyse ondergaan, werd longembolie waargenomen bij 0,4% (0,2 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, vergeleken met 0,2% (0,1 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de placebogroep. Bij patiënten die CNS hebben en wel dialyse ondergaan, werd longembolie waargenomen bij 0,6% (0,3 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, vergeleken met 0,5% (0,3 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de ESA-groep (zie rubriek 4.4).
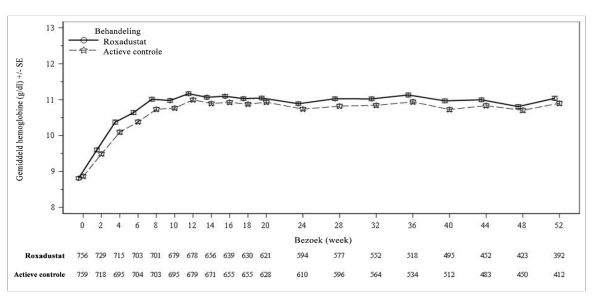
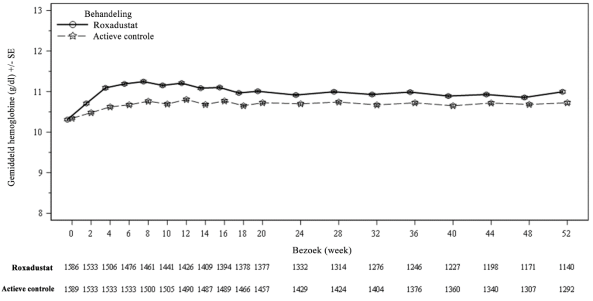
Bij patiënten die CNS hebben en dialyse ondergaan, werd trombose van de vaattoegang waargenomen bij 12,8% (7,6 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, vergeleken met 10,2% (5,4 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de ESA-groep (zie rubriek 4.4).
Bij patiënten die CNS hebben en geen dialyse ondergaan, was de totale incidentie van ischemische vasculaire CZS-voorvallen hoger in de roxadustatgroep (3,9%) dan in de placebogroep (2,4%) en was het met follow-up aangepaste incidentiecijfer hoger in de roxadustatgroep (2,3) dan in de placebogroep (1,8). Herseninfarcten bleken 0,2% vaker voor te komen in de roxadustatgroep dan in de placebogroep (0,6%, vergeleken met 0,4%).
Bij patiënten die CNS hebben en dialyse ondergaan, was de totale incidentie van voorvallen door ischemische vasculaire CZS-voorvallen in de groep met roxadustatbehandeling (4,8%) vergelijkbaar met die in de actieve controle groep (4,2%). Het incidentiecijfer per 100 patiëntjaren van blootstelling was 2,8 in de groep met roxadustatbehandeling, vergeleken met 2,2 in de actieve controle groep. Ischemische beroertes bleken 0,2% vaker voor te komen in de roxadustatgroep dan in de groep met actieve comparator (0,8%, vergeleken met 0,6%).
Insulten
Bij patiënten die CNS hebben en geen dialyse ondergaan, kwamen insulten voor bij 1,1% (0,6 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, en bij 0,2% (0,2 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de placebogroep (zie rubriek 4.4).
Bij patiënten die CNS hebben en wel dialyse ondergaan, kwamen insulten voor bij 2,0% (1,2 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, en bij 1,6% (0,8 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de ESA-groep (zie rubriek 4.4).
Sepsis
Bij patiënten die CNS hebben en geen dialyse ondergaan, werd sepsis waargenomen bij 2,1% (1,3 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, vergeleken met 0,4% (0,3 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de placebogroep. Bij patiënten die wel dialyse ondergaan, werd sepsis waargenomen bij 3,4% (2,0 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de roxadustatgroep, vergeleken met 3,4% (1,8 patiënten met voorvallen per 100 patiëntjaren van blootstelling) in de ESA-groep (zie rubriek 4.4).
Huidreacties
Gegeneraliseerde exfoliatieve dermatitis, onderdeel van ernstige huidreacties (SCAR), is gerapporteerd gedurende postmarketingsurveillance en is in verband gebracht met roxadustat behandeling (frequentie niet bekend).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden via het nationale meldsysteem:
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Astellas Pharma Europe B.V.
Sylviusweg 62
2333 BE Leiden
Nederland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
12 x 1 filmomhulde tabletten
EU/1/21/1574/001 ‑ 005
36 x 1 filmomhulde tabletten
EU/1/21/1574/006 ‑ 010
10. DATUM VAN HERZIENING VAN DE TEKST
17/09/2025
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu/.
1
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4386942 | EVRENZO 20MG FILMOMH TABL 12 X 1 | € 52,15 | - | Ja | € 2 | € 1 | |
| 4386959 | EVRENZO 50MG FILMOMH TABL 12 X 1 | € 116,72 | - | Ja | € 2 | € 1 | |
| 4386975 | EVRENZO 70MG FILMOMH TABL 12 X 1 | € 159,02 | - | Ja | € 2 | € 1 | |
| 4386967 | EVRENZO 100MG FILMOMH TABL 12 X 1 | € 222,47 | - | Ja | € 2 | € 1 | |
| 4386983 | EVRENZO 150MG FILMOMH TABL 12 X 1 | € 328,22 | - | Ja | € 2 | € 1 |