SAMENVATTING VAN DE PRODUCTKENMERKEN
1. NAAM VAN HET GENEESMIDDEL
Evrysdi 0,75 mg/ml poeder voor drank
2. KWALITATIEVE EN KWANTITATIEVE SAMENSTELLING
Elke fles bevat 60 mg risdiplam in 2 g poeder voor drank.
Elke milliliter van de klaargemaakte oplossing bevat 0,75 mg risdiplam.
Hulpstoffen met bekend effect
Elke milliliter bevat 0,38 mg natriumbenzoaat (E 211) en 2,97 mg isomalt (E 953).
Voor de volledige lijst van hulpstoffen, zie rubriek 6.1.
3. FARMACEUTISCHE VORM
Poeder voor drank.
Lichtgeel, geel, grijsgeel, groengeel of lichtgroen poeder.
4. KLINISCHE GEGEVENS
4.1 Therapeutische indicaties
Evrysdi is geïndiceerd voor de behandeling van 5q spinale spieratrofie (SMA) bij patiënten met een klinische diagnose van SMA type 1, type 2 of type 3, of met één tot en met vier kopieën van het SMN2-gen.
4.2 Dosering en wijze van toediening
De behandeling met risdiplam dient geïnitieerd te worden door een arts met ervaring in de behandeling van SMA.
Dosering
De aanbevolen eenmaal daagse dosis risdiplam wordt bepaald aan de hand van leeftijd en lichaamsgewicht (zie tabel 1).
Tabel 1. Evrysdi poeder voor drank dosering op basis van leeftijd en lichaamsgewicht
Leeftijd* en lichaamsgewicht | Aanbevolen dagelijkse dosis |
< 2 maanden oud | 0,15 mg/kg |
2 maanden tot < 2 jaar oud | 0,20 mg/kg |
≥ 2 jaar oud (< 20 kg) | 0,25 mg/kg |
≥ 2 jaar oud (≥ 20 kg) | 5 mg |
* gebaseerd op gecorrigeerde leeftijd voor prematuren | |
Er is als alternatieve doseringsvorm een filmomhulde tablet beschikbaar voor patiënten ≥ 2 jaar met een lichaamsgewicht van ≥ 20 kg. Raadpleeg de Samenvatting van de productkenmerken (SmPC) van Evrysdi filmomhulde tabletten. De tablet of het tabletmengsel mag niet via een neus-maagsonde of maagsonde worden toegediend. Het poeder voor drank kan echter wel via een neus-maagsonde of maagsonde worden toegediend. De arts moet de gepaste farmaceutische vorm voorschrijven volgens de benodigde dosis en de behoeften van de patiënt, waaronder het vermogen van de patiënt om te kunnen slikken. Voor patiënten die moeite hebben met het doorslikken van een hele tablet, kan de tablet worden gedispergeerd of kan het poeder voor drank worden voorgeschreven.
Behandeling met een dagelijkse dosis hoger dan 5 mg is niet onderzocht.
Uitgestelde of gemiste doses
Als een geplande dosis wordt gemist, moet deze zo snel mogelijk worden toegediend als dit nog binnen 6 uur is van het geplande tijdstip van de dosis. Anders moet de gemiste dosis worden overgeslagen en moet de volgende dosis de volgende dag worden toegediend op het reguliere geplande tijdstip.
Als een dosis niet volledig wordt doorgeslikt of in geval van braken na het innemen van een dosis risdiplam, mag er geen extra dosis worden toegediend om de onvolledige dosis in te halen. De volgende dosis moet worden toegediend op het reguliere geplande tijdstip.
Ouderen
Op basis van beperkte gegevens bij proefpersonen van 65 jaar en ouder is er geen dosisaanpassing nodig bij ouderen (zie rubriek 5.2).
Verminderde nierfunctie
Risdiplam is niet onderzocht bij deze populatie. Het wordt niet verwacht dat een dosisaanpassing nodig is bij patiënten met een verminderde nierfunctie (zie rubriek 5.2).
Verminderde leverfunctie
Er is geen dosisaanpassing nodig bij patiënten met een licht of matig verminderde leverfunctie. Patiënten met een ernstig verminderde leverfunctie zijn niet onderzocht en zouden een verhoogde blootstelling aan risdiplam kunnen hebben (zie rubriek 5.1 en 5.2).
Pediatrische patiënten
Er zijn geen gegevens beschikbaar over de farmacokinetiek van risdiplam bij patiënten jonger dan 16 dagen.
Wijze van toediening
Oraal gebruik.
Evrysdi poeder voor drank moet worden klaargemaakt door een beroepsbeoefenaar in de gezondheidszorg (bijv. een apotheker), voordat het wordt verstrekt. Het wordt aanbevolen dat een beroepsbeoefenaar in de gezondheidszorg met de patiënt of verzorger bespreekt hoe de voorgeschreven dagelijkse dosis bereid moet worden voorafgaand aan de toediening van de eerste dosis.
Evrysdi wordt eenmaal per dag met of zonder voedsel oraal ingenomen, telkens op ongeveer hetzelfde tijdstip, met gebruik van de meegeleverde herbruikbare doseerspuit voor orale toediening. Evrysdi mag niet worden gemengd met melk of flesvoeding.
Evrysdi moet direct nadat het in de doseerspuit is opgetrokken worden ingenomen. Als het niet binnen 5 minuten wordt ingenomen moet de inhoud worden verwijderd uit de spuit en moet een nieuwe dosis worden klaargemaakt. Bij knoeien of contact met de huid moet het betrokken gebied met water en zeep worden gewassen.
De patiënt moet water drinken nadat Evrysdi is ingenomen om zeker te zijn dat het geneesmiddel volledig is ingeslikt. Als de patiënt niet kan slikken en een neussonde of maagsonde heeft, kan Evrysdi poeder voor drank via de sonde worden toegediend. Na toediening van Evrysdi moet de sonde worden doorgespoeld met water.
Keuze van de doseerspuit voor orale toediening bij de voorgeschreven dagelijkse dosis:
Grootte van de doseerspuit | Toedieningsvolume | Maatverdeling op de doseerspuit |
1 ml | 0,3 ml tot 1 ml | 0,01 ml |
6 ml | 1 ml tot 6 ml | 0,1 ml |
12 ml | 6,2 ml tot 6,6 ml | 0,2 ml |
Voor de berekening van het toe te dienen volume moet rekening worden gehouden met de maatverdeling op de doseerspuit. Het dosisvolume moet worden afgerond naar de dichtstbijzijnde maatstreep op de geselecteerde doseerspuit voor orale toediening.
4.3 Contra‑indicaties
Overgevoeligheid voor de werkzame stof of voor een van de in rubriek 6.1 vermelde hulpstoffen.
4.8 Bijwerkingen
Samenvatting van het veiligheidsprofiel
Bij patiënten met eerste SMA-symptomen op zuigelingenleeftijd waren pyrexie (54,8%), huiduitslag (29,0%) en diarree (19,4%) de vaakst voorkomende bijwerkingen tijdens klinische onderzoeken met risdiplam.
Bij patiënten die SMA op latere leeftijd kregen waren pyrexie (21,7%), hoofdpijn (20,0%), diarree (16,7%) en huiduitslag (16,7%) de vaakst voorkomende bijwerkingen tijdens klinische onderzoeken met risdiplam.
De bovengenoemde bijwerkingen traden op zonder identificeerbaar klinisch of tijdspatroon en herstelden over het algemeen ondanks dat de behandeling werd voortgezet bij zowel patiënten met eerste SMA‑symptomen op zuigelingenleeftijd als patiënten die SMA op latere leeftijd kregen.
Lijst van bijwerkingen in tabelvorm
Bij elke bijwerking is de indeling in frequentiecategorieën gebaseerd op de volgende conventie: zeer vaak (≥ 1/10), vaak (≥ 1/100, < 1/10), soms (≥ 1/1.000, < 1/100), zelden (≥ 1/10.000, < 1/1.000), zeer zelden (< 1/10.000), niet bekend (kan met de beschikbare gegevens niet worden bepaald). Bijwerkingen uit klinische onderzoeken in tabel 2 zijn weergegeven per systeem/orgaanklasse volgens MedDRA.
Tabel 2. Bijwerkingen waargenomen in klinische onderzoeken met risdiplam en ervaring na het in de handel brengen bij patiënten met eerste SMA-symptomen op zuigelingenleeftijd en SMA op latere leeftijd
Systeem/orgaanklasse | Eerste SMA-symptomen op zuigelingenleeftijd | SMA op latere leeftijd |
Infecties en parasitaire aandoeningen | ||
Urineweginfectie (waaronder cystitis) | Vaak | Vaak |
Zenuwstelselaandoeningen | ||
Hoofdpijn | Niet van toepassing | Zeer vaak |
Maagdarmstelselaandoeningen | ||
Diarree | Zeer vaak | Zeer vaak |
Misselijkheid | Niet van toepassing | Vaak |
Mondulceraties en aften | Vaak | Vaak |
Huid‑ en onderhuidaandoeningen | ||
Huiduitslag* | Zeer vaak | Zeer vaak |
Cutane vasculitis** | Niet bekend | |
Skeletspierstelsel- en bindweefselaandoeningen | ||
Artralgie | Niet van toepassing | Vaak |
Algemene aandoeningen en toedieningsplaatsstoornissen | ||
Pyrexie (waaronder hyperpyrexie) | Zeer vaak | Zeer vaak |
*Omvat dermatitis, acneïforme dermatitis, allergische dermatitis, erytheem, folliculitis, huiduitslag, erythemateuze uitslag, maculopapuleuze uitslag, papuleuze uitslag
**Cutane vasculitis werd gemeld na het in de handel brengen. De symptomen herstelden na permanente stopzetting van risdiplam. De frequentie kan niet worden bepaald op basis van de beschikbare gegevens.
Veiligheidsprofiel bij presymptomatische patiënten
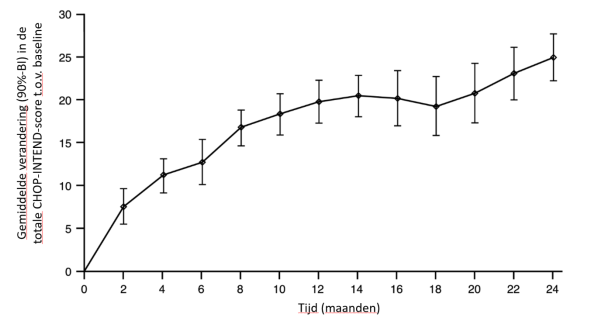
Op basis van de primaire analyse van RAINBOWFISH komt het veiligheidsprofiel van Evrysdi bij presymptomatische patiënten overeen met het veiligheidsprofiel dat werd waargenomen bij symptomatische patiënten die SMA op zuigelingenleeftijd en op latere leeftijd kregen. In het RAINBOWFISH-onderzoek waren 26 patiënten met presymptomatische SMA geïncludeerd, die tussen 16 en 41 dagen oud waren op het moment van de eerste dosis (spreiding van gewicht: 3,1 tot 5,7 kg). De mediane blootstellingsduur was 20,4 maanden (spreiding: 10,6 tot 41,9 maanden). Er zijn beperkte gegevens van na het in de handel brengen beschikbaar van neonaten < 20 dagen oud.
Veiligheidsprofiel bij patiënten die eerder werden behandeld met andere SMA-modificerende therapieën
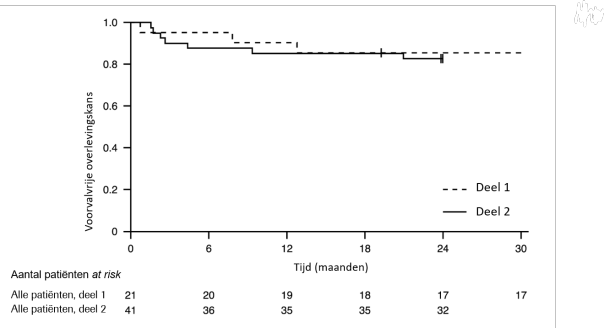
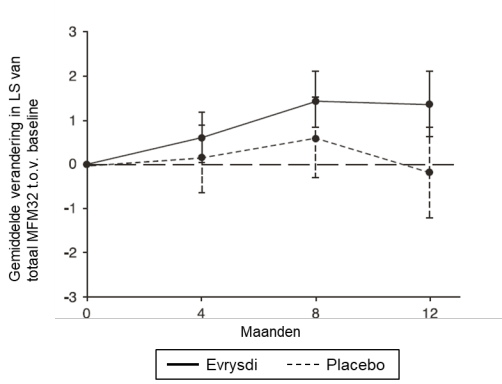
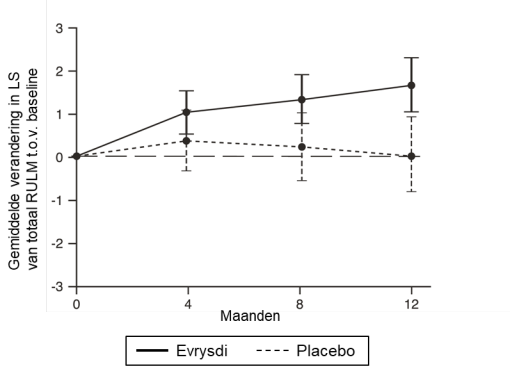
Het veiligheidsprofiel van risdiplam bij patiënten die eerder werden behandeld voor SMA (waaronder eerdere behandeling met nusinersen of met onasemnogeen abeparvovec) komt overeen met het veiligheidsprofiel van patiënten die niet eerder behandeld waren voor SMA en die risdiplam kregen in de klinische onderzoeken FIREFISH, SUNFISH en RAINBOWFISH (zie rubriek 5.1).
Melding van vermoedelijke bijwerkingen
Het is belangrijk om na toelating van het geneesmiddel vermoedelijke bijwerkingen te melden. Op deze wijze kan de verhouding tussen voordelen en risico’s van het geneesmiddel voortdurend worden gevolgd. Beroepsbeoefenaren in de gezondheidszorg wordt verzocht alle vermoedelijke bijwerkingen te melden (zie hieronder voor details).
België
Federaal Agentschap voor Geneesmiddelen en Gezondheidsproducten
www.fagg.be
Afdeling Vigilantie:
Website: www.eenbijwerkingmelden.be
e-mail: adr@fagg-afmps.be
7. HOUDER VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Duitsland
8. NUMMER(S) VAN DE VERGUNNING VOOR HET IN DE HANDEL BRENGEN
EU/1/21/1531/001
10. DATUM VAN HERZIENING VAN DE TEKST
8 januari 2026
Gedetailleerde informatie over dit geneesmiddel is beschikbaar op de website van het Europees Geneesmiddelenbureau https://www.ema.europa.eu.
PRIJZEN
| CNK code | Verpakking | ATC5 code | Prijs | Af-fabriek prijs | Voorschriftplichtig | Remgeld reguliere tegemoetkoming | Remgeld verhoogde tegemoetkoming |
|---|---|---|---|---|---|---|---|
| 4342846 | EVRYSDI 0,75MG/ML POEDER VOOR DRANK FL 1 X 60MG | M09AX10 | - | - | Ja | - | - |